Рак мочевого пузыря (РМП) является одной из наиболее распространенных злокачественных опухолей, составляя 70% новообразований органов мочевого тракта и около 4,5% в структуре всей онкологической патологии. Среди всех онкоурологических заболеваний РМП занимает 2-е место после рака предстательной железы. Заболеваемость РМП ежегодно растет, особенно в индустриально развитых странах, как в абсолютном числовом выражении, так и по отношению к частоте рака большинства других локализаций. Рост показателей заболеваемости населения России РМП составляет 5,8% [1]. Вместе с тем своевременная диагностика опухолей мочевого пузыря и лечение больных данной патологией остаются сложными и актуальными проблемами современной онкоурологии. Это связано со многими анатомо-физиологическими особенностями мочевого пузыря, склонностью опухоли к рецидивированию (частота возникновения рецидивов после органосохраняющих операций составляет 50–90%).
Длительное и устойчивое излечение больных РМП сегодня обеспечивает радикальное оперативное вмешательство. Пик заболеваемости регистрируют в возрасте 50–80 лет. У пациентов данной возрастной категории в большинстве случаев кроме симптомов опухолевого заболевания отмечают сопутствующую сердечно-сосудистую, дыхательную, эндокринную и другую патологию различной степени выраженности, что повышает риск оперативного лечения. Хирургическое вмешательство сопровождается снижением функции иммунной системы, дыхательной функции легких, увеличением риска возникновения тромбоэмболических осложнений, кардиологических расстройств и т.д. За последние годы с развитием хирургических технологий удалось повысить эффективность оперативного лечения больных РМП за счет минимизации операционной травмы и ранней реабилитации пациентов. Все это послужило толчком к развитию мультимодальной программы «Хирургия быстрого восстановления» (ХБВ), впервые разработанной датским анестезиологом H. Kehlet (1997). Цель данной программы – максимальное ограничение физической травмы, обусловленной хирургическим вмешательством, борьба с послеоперационной болью и обеспечение выздоровления без осложнений в возможно короткие сроки. Программа ХБВ охватывает вопросы предоперационной подготовки, особенностей оперативной техники, ведение послеоперационного периода у больных, подлежащих оперативным вмешательствам на органах брюшной полости. Она основана на патофизиологических принципах и призвана снижать реакцию организма на стресс от хирургической травмы и боли, ускорять выздоровление за счет ранней активизации и питания, сокращать период нахождения больного в стационаре, что очень важно для пациентов. Применение программы ХБВ в европейских урологических клиниках в отношении больных РМП значительно ускорило сроки реабилитации и улучшило их качество жизни [3, 4].
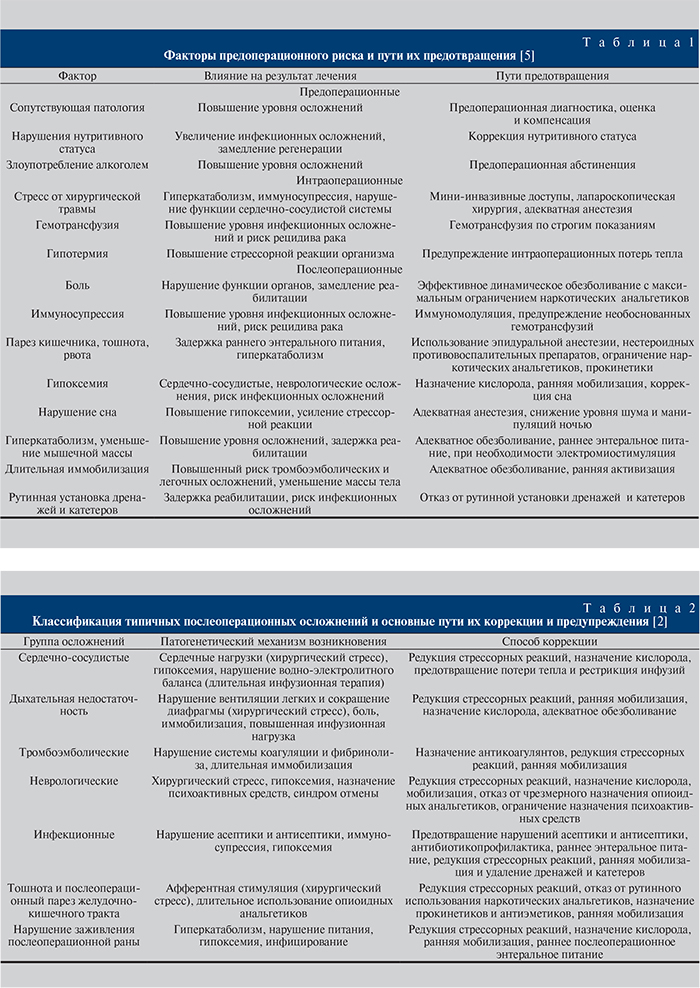
Общие сведения о программе ХБВ у больных РМП, результаты ее применения Продолжительность послеоперационного периода у пациентов, которым выполняются операции по поводу злокачественных опухолей мочевого пузыря, составляет в среднем 14–21 сут. [2]. Возникает вопрос: почему технически удачно выполненная радикальная цистэктомия в ряде случаев приводит к осложнениям в послеоперационном периоде? Можно ли, зная патогенез стрессорного ответа организма на хирургическую травму, прогнозировать такие неблагоприятные факторы и вовремя их корректировать. H. Kehlet [2] классифицирует указанные неблагоприятные последствия стрессорных реакций, выделяя факторы предоперационного риска (табл. 1). В зависимости от указанных факторов предоперационного риска им же [2] была разработана классификация типичных послеоперационных осложнений, основные пути их коррекции и предупреждения (табл. 2). Несмотря на значительный прогресс в понимании патофизиологических основ хирургической стрессорной реакции, тактика наиболее рациональной и эффективной терапии до сих пор не разработана. По данным литературы, у 11–70% больных развиваются различные послеоперационные осложнения, которые в 2,7–26,9% случаев служат причиной летальных исходов [1, 7–11, 13–17]. В структуре осложнений имеют место длительный парез кишечника, ранняя спаечная кишечная непроходимость – 5,6–70%, несостоятельность межкишечных анастомозов – 4–11,7%, несостоятельность уретерокишечных анастомозов – 19%, раневые осложнения (инфекция, эвентрация) – 11%, сепсис (уросепсис) – 1,7–3%, ТЭЛА, инфаркт миокарда, инсульт – 1–3% [5].
По определению H. Kehlet [2], программа ХБВ «…предусматривает применение эпидуральной или регионарной анестезии, мини-инвазивных оперативных вмешательств и агрессивной послеоперационной реабилитации, включающей раннее энтеральное питание и раннюю активизацию. В комбинации эти меры позволяют снижать стрессорные реакции организма и значительно сокращать время, необходимое для полного восстановления». H. Kehlet [2] выделяет 18 компонентов программы ХБВ:
- Информирование пациента и необходимые рекомендации.
- Отказ от использования механической очистки толстого кишечника.
- Отказ от премедикации опиоидными анальгетиками.
- Назначение пробиотиков перед операцией.
- Отказ от предоперационного голодания.
- Назначение пищевых углеводных смесей за 3–4 ч до операции.
- Использование регионарной анестезии и короткодействующих анальгетиков.
- Контроль и рестрикция инфузии коллоидных и кристаллоидных растворов до и во время операции.
- Мини-инвазивные оперативные доступы: поперечная лапаротомия, применение ретракторов и ранорасширителей для экспозиции операционного поля, лапароскопическая хирургия.
- Предотвращение гипотермии во время и после операции.
- Назначение высоких концентраций кислорода до операции.
- Максимальное уменьшение использования опиоидных анальгетиков.
- Отказ от рутинной установки в брюшную полость дренажей и назогастрального зонда.
- Раннее удаление мочевого, центрального венозного и эпидурального катетера, дренажей.
- Назначение прокинетиков в послеоперационном периоде.
- Назначение раннего послеоперационного энтерального питания.
- Ранняя активизация пациента.
- Отказ от необоснованных гемотрансфузий.
Подавляющее большинство этих пунктов имеет высокую степень достоверности с позиций доказательной медицины (табл. 3). Наиболее высокую степень доказательности (1А) имеют положения об отказе от механической очистки толстой кишки, применении мини-инвазивных оперативных доступов, об отказе от рутинной установки дренажей в брюшную полость, от использования или раннее удаление назогастрального зонда.
В литературе последних лет представлено много убедительных данных в пользу эффективности программы ХБВ в комплексе хирургического лечения заболеваний органов брюшной полости. S. Muller и соавт. [6] по результатам рандомизированного исследования сообщают о значительном уменьшении количества послеоперационных осложнений III и IV классов по Clavien–Dindo (16 у 76 пациентов группы ХБВ и 37 у 75 пациентов контрольной группы, р<0,0014). Регрессивный анализ, проведенный авторами исследования, убедительно демонстрирует, что нефункционирующий эпидуральный катетер и перегрузки инфузионными растворами – это независимые прогностические факторы послеоперационных осложнений.
Наиболее существенное влияние на течение послеоперационного периода оказывают метаболические нарушения, обусловленные стрессорным ответом на хирургическую травму.
В результате вмешательства выделяются стрессорные гормоны — глюкагон, кортизол и катехоламины, а также масса цитокинов. Это приводит к развитию состояния, подобного сахарному диабету 2 типа с избытком секреции инсулина [7]. По данным [8], для максимального предотвращения инсулинорезистентности рекомендуется назначать пищевые смеси с содержанием углеводов. За 4 ч до операции углеводы могут быть назначены в виде жидкости, поскольку за это время происходит полная эвакуация из желудка. Кроме того, по данным тех же авторов, послеоперационная гипергликемия обусловливает повышение уровня послеоперационных осложнений, в частности необходимость нахождения в отделении интенсивной терапии и инфицирование послеоперационной раны.
Одним из элементов программы ХБВ является предотвращение гипотермии во время операции. Доказано, что во время операции, которая длится 4 ч и более, базальная температура (температура ядра) снижается на 1–3°С, тем самым в 2–3 раза повышая риск послеоперационных инфекционных осложнений, вызывая увеличение кровопотери, приводя к возникновению в послеоперационном периоде аритмий, в частности желудочковой тахикардии [9]. Гипотермия сама по себе является стрессорным фактором, к тому же препараты для общей анестезии нарушают работу терморегуляторного центра гипоталамуса. В результате неспецифической реакции на стресс происходит выделение катехоламинов и глюкокортикоидов, что может приводить к указанным выше последствиям. А. Kurz и соавт. [10] установили, что предотвращение интраоперационной гипотермии позволяет снижать уровень инфекционных осложнений со стороны операционной раны и сокращать продолжительность госпитализации.
H. Nielsen сообщает о корреляции между периоперационной гемотрансфузией, интенсивной кровопотерей, повышенным риском инфекционных осложнений и возможностью рецидива рака [11]. Даже аутологическая гемотрансфузия заготовленных до операции компонентов крови может вызывать отдаленные неблагоприятные последствия, поскольку токсичные молекулы, содержащиеся в гранулах лейкоцитов и тромбоцитов (миелопероксидазы, гистамин и др.), высвобождаются из этих клеток через 2 нед. с момента заготовки какого-либо препарата крови.
Существует много сообщений о негативном влиянии травмы на иммунную систему. Объемные оперативные вмешательства вызывают иммуносупрессию, что проявляется нарушением реакций гиперчувствительности заторможенного типа (IV класс по Джеллу–Кумбсу). Изменения в иммунной системе приводят к повышению частоты инфекционных осложнений и, возможно, влияют на частоту рецидивирования злокачественной опухоли [12]. По данным [11, 12], интраоперационные гемотрансфузии достоверно усиливают иммуносупрессию. Следует отметить, что применение иммуномодулирующих препаратов, таких как тимопоэтин, человеческие иммуноглобулины, гранулоцитарный колониестимулирующий фактор и антагонисты рецепторов гистамина 2-го типа, у пациентов, которым выполнены большие по объему оперативные вмешательства, не продемонстрировали достоверной эффективности в снижении частоты послеоперационных инфекционных осложнений [12, 13]. В связи с этим наиболее рациональной тактикой предупреждения иммуносупрессии у хирургических больных остаются уменьшение операционной травмы и адекватная послеоперационная анальгезия.

Все хирургические операции сопровождаются болью, которая может усиливать эндокринные и метаболические реакции, вегетативные рефлексы, мышечный спазм, тошноту, послеоперационный парез кишечника и тем самым увеличивать сроки выздоровление пациента. Наркотические анальгетики широко применяют в хирургической клинике как эффективное средство для контроля боли. Длительное назначение этих препаратов вызывает толерантность и требует повышения их дозы, что приводит к увеличению продолжительности послеоперационного пареза кишечника и может вызывать послеоперационную динамическую кишечную непроходимость [14], поэтому ограничение применения наркотических анальгетиков является основным методом профилактики послеоперационной кишечной непроходимости. Для достижения данной цели существуют два пути: первый – более широкое применение эпидуральной анестезии в отношении пациентов, которым планируется оперативное вмешательство по поводу РМП, второй – введение в клиническую практику применения антагонистов опиоидных рецепторов. В США и странах Европы исследуются эффекты таких антагонистов опиоидных рецепторов, как альвимопан и метилналтрексон [15, 16]. Данные препараты не проникают через гематоэнцефалический барьер и таким образом блокируют депрессивное влияние наркотических анальгетиков на желудочно-кишечную моторику без потери анальгетического эффекта. По данным рандомизированного двойного слепого исследования, у пациентов, получавших альвимопан, достоверно снизилась частота возникновения тошноты, рвоты, также уменьшилась продолжительность периода послеоперационного пареза кишечника по сравнению с группой пациентов, получавших плацебо (р<0,001) [17]. Метилналтрексон – чистый антагонист μ-опиоидных рецепторов, в отличие от альвимопана, является жирорастворимым; не проникает через гематоэнцефалический барьер и максимально активен лишь по отношению к периферическим рецепторам. По данным рандомизированного двойного слепого исследования, парентеральное применение метилналтрексона достоверно сокращает продолжительность послеоперационного пареза кишечника при сравнимых побочных эффектах [18]. Связь между болевой импульсацией и кишечной моторикой впервые установлена в эксперименте на животных [19]. При чрезмерной болевой афферентации возможны иррадиация нервных импульсов в соответствующие ядра симпатического ствола и чрезмерная симпатическая стимуляция кишечника, что будет вызывать его длительный парез после выполнения оперативных вмешательств на органах брюшной полости. Из этих соображений блокада афферентации от симпатических волокон с сохранением парасимпатической иннервации позволит эффективно улучшать моторику кишечника [20]. На сегодня разработано несколько методик эффективной борьбы с болью во время и после операции. При больших по объему оперативных вмешательствах, в частности при хирургическом лечении РМП, эффективной комбинацией считается применение длительной эпидуральной анестезии вместе с назначением нестероидных противовоспалительных препаратов (НПВП) с наркотическими анальгетиками в низких дозах [2, 21, 22]. Контролируемая пациентом анестезия наркотическими анальгетиками «по требованию» демонстрирует удовлетворительные результаты, но, по данным [24], она значительно менее эффективна, чем эпидуральная анестезия. Тем не менее адекватная анестезия сама по себе не приводит к ускорению активизации и не влияет на реабилитацию и продолжительность госпитализации. Несмотря на это, оптимальное обезболивание — один из залогов снижения уровня послеоперационных осложнений.
Послеоперационная кишечная непроходимость служит наиболее распространенной причиной длительной госпитализации в абдоминальной хирургии. По определению А. Bauer и соавт. [25], под послеоперационным парезом кишечника понимают ятрогенное нарушение координации кишечной моторики, связанное в большинстве случаев с операциями на органах брюшной полости, которая длится более 48 ч после операции. Тошнота, рвота и динамическая кишечная непроходимость – одни из наиболее распространенных послеоперационных осложнений, которые к тому же могут быть решающими в послеоперационной реабилитации. Патогенез этих осложнений многофакторный и зависит от объема операции, пола, вида анестезии и от использования наркотических анальгетиков [26, 27]. После операций по поводу РМП восстановление функции тонкого кишечника происходит через несколько часов после операции, желудка – 24–48 ч, толстого кишечника – 48–72 ч, причем восстановление моторики ободочной кишки является определяющим фактором в патогенезе послеоперационной кишечной непроходимости [28]. В исследовании [29] была выявлена корреляция между развитием послеоперационной кишечной непроходимости, продолжительностью операции, кровопотерей и количеством использованных наркотических анальгетиков. Послеоперационный парез кишечника сопровождает все операции на органах брюшной полости, продолжается от 24 до 48 ч и связан в первую очередь с хирургической травмой, гипонатриемией и отеком стенки кишечника, что приводит к его ишемии и повышению интраабдоминального давления [30]. Наиболее адекватными способами предотвращения и лечения тошноты и рвоты в раннем послеоперационном периоде являются назначение антиэметиков, среди которых наиболее эффективны антагонисты 5-НТ3-рецепторов серотонина, а также адекватный контроль боли с ограниченным применением наркотических анальгетиков, регионарной анестезии и системным назначением НПВП (возможно назначение селективных ингибиторов циклооксигеназы ЦОГ-2).
По данным J. Rosenberg и соавт. [31], постоянная послеоперационная гипоксемия длится 2–5 сут. после больших по объему оперативных вмешательств, причем наиболее значительные эпизоды гипоксии имеют место преимущественно ночью. Причиной ранней послеоперационной гипоксии в первую очередь является нарушение вентиляционной функции легких, вызванное действием миорелаксантов и наркотических анальгетиков. Поздняя послеоперационная гипоксия (более 5 сут. после операции) может быть причиной сердечно-сосудистых, инфекционных и неврологических осложнений; провоцировать возникновение сердечных аритмий, в частности фибрилляции предсердий и желудочковых тахикардий [31]. Поздняя послеоперационная ишемия может также быть фактором риска инфекционных осложнений, в первую очередь со стороны послеоперационной раны, поскольку недостаточное снабжение кислородом значительно ухудшает регенерацию и уменьшает устойчивость к гноеродным микроорганизмам [31]. Использование адекватного подхода к анестезии (эпидуральная анестезия и ограниченное применение наркотических анальгетиков) позволяет своевременно восстанавливать оксигенацию и предотвращать возникновение указанных осложнений. Посредством оксигенотерапии можно эффективно устранять осложнения, обусловленные послеоперационной гипоксией, однако режимы дозирования и длительности использования кислорода на сегодняшний день не детерминированы.
Традиционно больным после резекции кишки различного объема рекомендуется длительный постельный режим с ограничением двигательной активности, однако известно и доказано с позиций доказательной медицины, что длительная иммобилизация повышает риск тромбоэмболических осложнений и осложнений со стороны дыхательной системы (дыхательная недостаточность, госпитальная пневмония и др.). Также длительное нахождение в постели может приводить к ортостатическим нарушениям при изменении положения тела, к потере мышечной массы и снижению мышечного тонуса, что негативно влияет на реабилитацию. Следует отметить, что исследования, направленные на определение воздействия непосредственно ранней активизации пациента на моторику пищеварительного тракта, оказались безрезультатными: J. Waldhausen и соавт. [32] продемонстрировали одинаковую электромиографическую активность желудка, подвздошной и ободочной кишки в послеоперационный период как у иммобилизованных пациентов, так и у тех, которым проводили раннюю активизацию.
Fa-Si Oen и соавт. [33] с высокой степенью достоверности (IIА) продемонстрировали отсутствие значительной разницы в частоте несостоятельности анастомоза и инфицирования послеоперационной раны в группах пациентов, которым назначали механическую очистку кишечника и голодание перед операцией, получавших углеводородные пищевые смеси вечером перед операцией вместе с осмотическими слабительными средствами на основе полиэтиленгликоля [33]. Аналогичные данные получены в рандомизированном исследовании Р. Bucher и соавт. [34]. По данным [35], недостатком назначения осмотических слабительных средств является электролитный дисбаланс из-за значительной потери жидкости и дефицита магния в ранний послеоперационный период. Эффективность перорального назначения антибиотиков в комплексе подготовки ободочной кишки не продемонстрировала преимуществ перед послеоперационным профилактическим курсом внутривенной антибиотикотерапии.
В последние годы сообщается об отсутствии необходимости рутинной назогастральной декомпрессии в плановой хирургии. Сообщается о таких осложнениях назогастральной интубации, как гипертермия, пневмония, повреждение полости носа и носоглотки [36–38]. Несмотря на это, значительная часть хирургов продолжает выполнять рутинную назогастральную интубацию, будучи убежденными в том, что это позволит снизить уровень послеоперационных осложнений, таких как тошнота, рвота, аспирация и несостоятельность анастомоза. По данным мета-анализа 37 рандомизированных исследований с участием 6850 пациентов, установлено, что рутинное использование назогастрального зонда приводит к таким осложнениям, как госпитальная пневмония, аспирация, ателектазы, а его применение оправданно и имеет объективные показания только в 5% случаев [16]. Также доказано, что рутинная назогастральная декомпрессия не предотвращает возникновения инфекционных осложнений со стороны послеоперационной раны, не уменьшает продолжительности госпитализации и не сокращает время до начала энтерального питания.
Дренирование брюшной полости используют для устранения скоплений жидкости, таких как асцитическая жидкость, кровь, желчь, лимфа, панкреатический сок или кишечное содержимое. Все они могут становиться источником инфекции, а в случае панкреатического сока и желчи оказывать прямое токсическое воздействие на прилежащие ткани. Другой функцией дренажей брюшной полости является выявление и предотвращение таких осложнений раннего послеоперационного периода, как кровотечение, несостоятельность анастомозов и пр. Таким образом, роль профилактического дренирования брюшной полости при больших по объему оперативных вмешательствах трудно переоценить. Впервые дренирование брюшной полости выполнил Sims в конце XVIII в., с начала XIX в. дренирование брюшной полости было популяризировано британским хирургом Lawson Tait, который сформулировал показания к нему: «When in doubt – drain» («Когда имеешь сомнение – дренируй») [39]. Однако за последние годы концепция дренирования брюшной полости после оперативных вмешательств существенно изменилась в пользу отказа от него. В течение последних трех десятилетий ряд хирургов переоценили роль профилактического дренирования брюшной полости с учетом данных многих рандомизированных контролируемых исследований. И все же сегодня, несмотря на убедительные данные необоснованности рутинного дренирования брюшной полости, большинство хирургов по всему миру продолжают выполнять эту манипуляцию. Из доступных источников по данной тематике наибольшего внимания заслуживает мета-анализ, проведенный Н. Petrowsky и соавт. [40]. Проанализировано 8 рандомизированных исследований из разных центров с общим дизайном: в основную группу вошли пациенты, которым не выполняли рутинного дренирования брюшной полости после резекции кишки, в контрольную – те, кому манипуляцию проводили во всех случаях. Уровень достоверности трех исследований был определен как IА [41–43]. Другие исследования имели меньший уровень доказательности – 2А. В работах [44, 45] продемонстрированы высокие уровни послеоперационных инфекционных осложнений у пациентов контрольных групп, однако основная тенденция характеризуется отсутствием корреляции между частотой инфекционных осложнений и наличием дренажа в брюшной полости. Среди 717 пациентов основной группы и 673 – контрольной частота несостоятельности анастомоза варьировалась от 1 до 23% (клинически или рентгенологически) и не коррелировала с наличием и отсутствием дренажа. Также была установлена статистическая значимость между частотой осложнений со стороны дыхательной системы и наличием дренажа брюшной полости [42, 44–46]. Согласно данным [47], только в 1 случае из 20 при несостоятельности анастомоза кишечное содержимое или гной выделялись через дренаж, что свидетельствует о низкой чувствительности дренирования брюшной полости как метода диагностики несостоятельности анастомоза.
Задержка кишечного содержимого в ободочной кишке способствует размножению анаэробных микроорганизмов, в то время как нормальная кокковая флора (стрептококки и стафилококки) могут проникать через кишечную стенку, попадать в кровоток и быть потенциальными источниками инфицирования. Пищевые смеси для энтерального питания обычно содержат углеводородные волокна, такие как пектин, целлюлоза, коллоиды и крахмал. Углеводные цепи отщепляются от волокон и поглощаются энтероцитами, продуцирующими кишечную слизь, другая часть волокон утилизируется кишечными микроорганизмами. Если нормальная микрофлора ободочной кишки не получает достаточного количества углеводов из пищевых волокон, она начинает расщеплять слизь для получения пластического материала, что снижает барьерную функцию ободочной кишки [48]. По данным мета-анализа 15 рандомизированных исследований, в которых принимали участие 1352 пациента, раннее энтеральное питание безопасно для пациентов после резекции кишки различного объема [49]. По нашему мнению, весьма неоднозначными и наименее освещенными в научной литературе остаются вопросы нутритивной поддержки и коррекции нутритивного статуса пациентов, которым планируется хирургическое лечение РМП по программе ХБВ. По мнению авторов, наибольшего успеха в этом можно достичь только при индивидуальной коррекции нутритивного статуса. Объективное обследование должно включать взвешивание, определение роста и индекса массы тела.
Схемы периоперационной инфузионной терапии, применяемые в плановой абдоминальной хирургии, достаточно разнообразны, существует много рекомендаций по поводу их использования. Продолжаются дебаты относительно количества и типа инфузионной терапия при плановых операциях большого объема [50]. V. Nisanevich и соавт. [49] у пациентов, которым в день операции было назначено 5,9 л кристаллоидных растворов, констатировали большую продолжительность послеоперационного пареза кишечника, большее число послеоперационных осложнений и более продолжительную госпитализацию по сравнению с пациентами, получившими до 3, 1 л. В мета-анализе 7 рандомизированных исследований сравнения «свободного режима» и «режима рестрикции» инфузионной терапии [51] показана неопределенность оптимального режима инфузионной терапии относительно программы ХБВ и необходимость его модификации. Перспективным считается применение целевой инфузионной терапии, режим которой предусматривает контроль фракции выброса с помощью чреспищеводной эхокардиографии. Однако публикаций, демонстрирующих результаты применения данной методики в комплексе программы ХБВ в хирургии мочевого пузыря, в литературе найти не удалось. Следует также отметить существующую в литературе неопределенность относительно режимов стандартной инфузионной терапии, «режима рестрикции» и «свободного режима». Так, согласно V. Nisanevich и соавт., «режим рестрикции» предусматривает введение в среднем 1,4±0,9 л растворов, в то время как Brandstrup и соавт. определяют «стандартный режим» как 5,4 л в среднем, а V. Nisanevich под «свободным режимом» понимает введение 3,8±1,2 л растворов [49]. Р.В. Хабалова и соавт. указывают, что оптимальный объем интраоперационной инфузии коллоидных и кристаллоидных растворов при хирургическом лечении РМП по программе ХБВ не должен превышать 3000 мл. Таким образом, поиск оптимального режима инфузионной терапии продолжается и достичь терминологического консенсуса пока не удается [52].
Основным достижением хирургии последних лет является внедрение лапароскопических технологий и программ ускоренной реабилитации – обе программы направлены на уменьшение послеоперационных осложнений, сокращение сроков выздоровления и уменьшение продолжительности госпитализации. Впервые лапароскопическую цистэктомию по поводу РМП выполнил R. Parra в 1992 г. [53]. Дальнейшие исследования [54–55] продемонстрировали безопасность и эффективность лапароскопических операций по поводу злокачественных образований мочевого пузыря. Также указывается, что посредством подобного рода вмешательств удается снижать частоту осложнений, выраженность послеоперационной боли и ускорять реабилитацию [56]. При оценке показателей онкологической эффективности лапароскопической цистэктомии (количество удаленных лимфатических узлов, отдаленных результатов – 5-летняя выживаемость и безрецидивный период) установлено, что лапароскопические операции не уступают открытым ни по одному из указанных параметров [57].
Анализ данных литературы показал, что мультимодальная программа ХБВ повышает эффективность оперативного лечения больных РМП. Использование программы ХБВ пациентами с опухолями мочевого пузыря способствует сокращению сроков реабилитации и снижению числа осложнений. Несмотря на то что эффективность отдельных компонентов программы ХБВ представлена в публикациях с высокой степенью достоверности, на сегодня многие вопросы предоперационной подготовки, особенностей оперативной техники и послеоперационного ведения пациентов остаются дискутабельными, что определяет актуальность дальнейших исследований эффективности этой программы.


