Введение. Рак предстательной железы (РПЖ) – распространенное заболевание у мужчин и занимает второе место по встречаемости среди злокачественных новообразований (после рака кожи), являясь второй по частоте причиной летального исхода от онкологических заболеваний [1]. В структуре заболеваемости злокачественными новообразованиями мужского населения России на долю РПЖ в 2004 г. приходилось 6,9%, в 2009-м – уже 10,7%. Согласно данным Американской ассоциации рака, в 2014 г. РПЖ выявили у 233 тыс. пациентов, при этом больные РПЖ составили 27% всех больных со злокачественными новообразованиями. В том же, 2014 г. от этого заболевания умерли 29 480 мужчин, что составило 10% от всех случаев летального исхода среди мужчин [2].
За последние годы существенно изменилось понимание этиологии и патогенеза данного заболевания, а также отношение к его лечению. Разработаны эффективные лекарственные средства, увеличивающие продолжительность жизни пациентов с распространенным РПЖ; определились различия в понятиях «гормонрезистентный РПЖ» и «андрогеннезависимый РПЖ»; появились данные, свидетельствующие о гормональной регуляции РПЖ, несмотря на его кастрационную резистентность [3–7]. Несмотря на определенные успехи, некоторые аспекты, касающиеся РПЖ, требуют дальнейшего изучения. К ним относятся поиск маркеров, позволяющих не только выявлять группу людей с высоким риском развития данного заболевания, но и прогнозировать течение заболевания, а также разработка адъювантных методов лечения, направленных на излечение пациентов с местнораспространенной формой РПЖ высокого риска. Крайне актуальной остается проблема отбора пациентов, которым лечение РПЖ жизненно необходимо и принесет больше пользы, чем вреда.
Агрессивность РПЖ зависит от стадии заболевания, степени дифференцировки ткани опухоли и от сроков его обнаружения [8]. По данным аутопсий клинически незначимый РПЖ выявлен у 75% мужчин старше 85 лет, умерших не от РПЖ, а от другой соматической патологии [9]. В работе J. Johansson представлены данные о течении этого заболевания у 223 пациентов с РПЖ, которым не проводилось лечение и скрининг ПСА, в период с 1979 по 2003 г.
Пяти- и 10-летняя раково-специфическая выживаемость составила 94 и 87% соответственно, что позволяет говорить об отсутствии необходимости активного лечения РПЖ у пациентов с ожидаемой продолжительностью жизни менее 10 лет [10, 11]. Однако через 15–20 лет после диагностирования РПЖ наблюдался рост показателя раково-специфической смертности [12, 13]. Спустя 30 лет наблюдения частота местного прогрессирования заболевания составила 41%, отдаленные метастазы выявляли у 18% больных, показатель общей смертности от РПЖ составил 17%. От момента постановки диагноза РПЖ до развития метастазов прошло в среднем 9,2 года, до возникновения летального исхода от РПЖ – 9,5 лет [14].

Важной вехой в диагностике РПЖ стало открытие простатспецифического антигена (ПСА). Уровень этого маркера в сыворотке крови у мужчин в возрасте 50–70 лет является значимым фактором прогрессирования РПЖ [15]. Однако следует отметить, что специфичность данного показателя в отношении диагностики РПЖ довольно низка, поскольку уровень ПСА может повышаться при доброкачественной гиперплазии предстательной железы, ее воспалении или травме, острой задержке мочи, инфекции мочевыводящих путей и других состояниях [8].
В настоящее время нет единого мнения в отношении порогового значения ПСА, специфичного именно для РПЖ. Согласно [16], среди мужчин (средний возраст –72 года) с гистологически подтвержденным РПЖ у 6,6% уровень ПСА был менее 0,5 нг/мл, у 10% – от 0,6 до 1 нг/мл, у 17% – от 1,1 до 2 нг/мл, у 24% – от 2,1 до 3 нг/мл, а у 27% – от 3,1 до 4 нг/мл. Контрольный уровень ПСА 4 нг/мл имеет чувствительность 78,7% и специфичность 59,2% [17]. Повышение порогового значения до 5 нг/мл увеличивает специфичность до 95%, при этом снижая чувствительность до 33% [18]. Важно помнить, что ПСА как скрининговый инструмент не позволяет дифференцировать РПЖ высокого и низкого рисков, а также выявлять его клинически незначимую форму [19].
Американские и европейские исследования по влиянию скрининга на летальность от РПЖ неоднозначны. Согласно данным американского исследования PLCO (Colorectal and Ovarian Cancer Screening Trial), период наблюдения в котором составил 11 лет, проведение скрининга при помощи ПСА не влияет на летальность от РПЖ. В исследовании ERSPC (European Randomized Study of Screening of Prostate Cancer) было показано, что скрининг с использованием ПСА позволяет снижать канцер-специфическую смертность на 20%, а именно уменьшение на 7 смертей от РПЖ на 100 тыс. населения [20, 21]. В настоящее время предметом дискуссии является необходимость проведения популяционного скрининга на РПЖ или скрининга по запросу. В связи с тем что данные о прогностической значимости скрининга на РПЖ противоречивы, во многом из-за разного уровня доказанности [22] и невозможности правильно сопоставить преимущества и недостатки методик [23], на сегодняшний день выполнение популяционного скрининга нецелесообразно, несмотря на доказанность его роли в снижении смертности от РПЖ [20, 21]. Однако мужчинам, заинтересованным в ранней диагностике РПЖ, особенно при отягощенном анамнезе, возможно проведение скрининга.
Согласно рекомендациям Американской Ассоциации урологов по ранней диагностике РПЖ (2013), проведение скрининга по ПСА не рекомендуется мужчинам моложе 40 лет, мужчинам с умеренным риском РПЖ (в отсутствие РПЖ в семейном анамнезе) в возрасте 40–54 лет, мужчинам старше 70 лет и мужчинам любого возраста при ожидаемой продолжительность жизни менее 10–15 лет [24]. Сходные рекомендации представлены и европейскими специалистами, согласно которым скрининг по ПСА рекомендован мужчинам в возрасте 50–70 лет, а в возрастной группе старше 70 лет – в зависимости от ожидаемой продолжительности жизни [25].
Скрининг на РПЖ нередко приводит к гипердиагностике этого заболевания, что требует выделения группы пациентов, которым необходимо лечение, пользы от которого они получат больше, чем вреда. В настоящее время общепринято, что первостепенной задачей любого вида лечения, включая хирургическое, является не столько увеличение продолжительности жизни больных, сколько улучшение их качества жизни, что, безусловно, распространяется и на пациентов с РПЖ [26]. Наиболее уязвимы люди пожилого и старческого возраста, поскольку частота РПЖ увеличивается с возрастом, достигая пика к 70–74 годам жизни мужчин. За последние годы все большее внимание уделяется клинически незначимому РПЖ, так называемому РПЖ с низкой вероятностью прогрессирования заболевания до клинических симптомов и/или летального исхода. При выборе метода лечения пациентов с данным вариантом течения РПЖ врач встречается с наибольшими трудностями, поскольку необходимо сбалансировать пользу и вред от выбранной тактики ведения. Важную роль при этом, безусловно, играет клинический опыт врача и знание особенностей течения заболевания.
Пациентам старшего возраста чаще проводят лучевую и гормональную терапию. Говоря о последней, можно утверждать, что она замедляет рост РПЖ, но возникающее при этом снижение уровня тестостерона сопровождается множеством побочных эффектов. У большинства пожилых пациентов после прекращения гормонального лечения уровень тестостерона не восстанавливается до исходного [27] и даже непродолжительное назначение гормональной терапии может спровоцировать развитие побочных эффектов гипогонадизма. Кроме общеизвестной токсичности гормональная терапия снижает минерализацию и прочность костной ткани, увеличивает риск развития переломов, особенно шейки бедренной кости. Показано, что риск переломов у мужчин с РПЖ, получающих гормональную терапию, возрастает на 13–30% по сравнению с мужчинами с РПЖ, но не получавшими этот вид терапии [28, 29]. Гормональная терапия усиливает истощение мышечной массы в объеме до 2–5% в течение нескольких недель после начала гормональной терапии, что может стать одной из причин общей слабости, физического недомогания и падений у мужчин старшей возрастной группы [30]. Помимо этого развитие сахарного диабета и его осложнений, сердечно-сосудистых и тромбоэмболических осложнений у мужчин, которым проводится гормональная терапия, встречается гораздо чаще, чем у мужчин, не получающих гормональную терапию [31]. В связи с этим лечение необходимо проводить только потенциально излечимым пациентам с клинически значимым РПЖ и высоким риском прогрессирования заболевания, однако правильное выявление данной группы пациентов остается сложной задачей для урологов.
В настоящее время довольно часто при отборе пациентов для динамического наблюдения используют критерии J. Epstein [32], а также разные варианты, предложенные M. Patel и соавт. [33]. К сожалению, эффективность использования этих критериев, по данным разных исследований, составляет около 73% [33, 34]. В последние годы клиницисты широко используют модели прогнозирования риска прогрессирования РПЖ [34]. Одним из ведущих критериев отбора пациентов является ожидаемая продолжительность жизни, что особенно актуально для пациентов старшей возрастной группы. Нормограммы, используемые для определения клинически незначимого РПЖ, впервые были представлены в 2005 г. на конференции по консенсусу стадирования Глисона. В настоящее время нормограммы в первоначальном виде утратили свое практическое значение, поскольку, несмотря на стандартизацию определения уровня ПСА, предложенную ВОЗ, различия все же сохраняются и могут обусловить неправильную оценку риска [35].
В нашей стране встречаются единичные работы, посвященные активному наблюдению пациентов с РПЖ, тем не менее результаты их многообещающие [36].
Таким образом, на сегодняшний день нет однозначного подхода к обследованию и лечению пациентов с подозрением на РПЖ с учетом возраста и сопутствующей патологии, что и послужило основанием для проведения данного исследования.
Цель: оценка течения РПЖ у мужчин разного возраста с сопутствующей патологией.
Материалы и методы. Настоящее открытое нерандомизированное исследование основано на ретроспективном анализе результатов обследования 408 пациентов в возрасте от 50 до 92 лет (средний возраст – 74,3 года).
 Пациенты были обследованы и наблюдались в ФГБУ «Поликлиника № 1» УДП РФ в период с 1989 по 2015 г. Всем пациентам было проведено клиническое обследование, включившее оценку жалоб, сбор анамнеза, пальцевое ректальное исследование, УЗИ предстательной железы, гистологическое исследование биопсийного материала ткани простаты и определение уровня ПСА. У 30 (7,4%) пациентов диагностирована стадия Т1, у 273 (66,9%) – Т2, у 91 (22,3%) – Т3 и у 14 (3,4%) – Т4.
Пациенты были обследованы и наблюдались в ФГБУ «Поликлиника № 1» УДП РФ в период с 1989 по 2015 г. Всем пациентам было проведено клиническое обследование, включившее оценку жалоб, сбор анамнеза, пальцевое ректальное исследование, УЗИ предстательной железы, гистологическое исследование биопсийного материала ткани простаты и определение уровня ПСА. У 30 (7,4%) пациентов диагностирована стадия Т1, у 273 (66,9%) – Т2, у 91 (22,3%) – Т3 и у 14 (3,4%) – Т4.
Средний уровень ПСА сыворотки крови обследованных пациентов составил 37,7 нг/мл (от 3,5 до 269 нг/мл).
Критерии включения: мужчины в возрасте 50 лет и старше; РПЖ, подтвержденный данными гистологического исследования.
Критерии исключения: системные заболевания; пациенты с метастазами; проведение химио- или лучевой терапии в анамнезе жизни или заболевания; период наблюдения менее 6 мес.
Из сопутствующей патологии ведущими оказались заболевания сердечно-сосудистой системы: ишемическая болезнь сердца – 325 (79,7%) человек, артериальная гипертензия – 307 (75,2%), инфаркт миокарда в анамнезе – 78 (19,1%), фибрилляция предсердий – 79 (19,4%), перенесенное острое нарушение мозгового кровообращения – 27 (6,6%), а также сахарный диабет – 44 (10,8%). На втором месте после заболеваний сердечно-сосудистой системы были онкологические заболевания другой локализации, которые диагностированы у 77 (18,8%) мужчин.
Максимальный период наблюдения за больными составил 22 года, минимальный – 6 мес (в среднем 15,4 года).
Статистическая обработка данных осуществлена в программе Statistica 10.0. Нормальность распределения определена с помощью критериев Шапиро–Уилка. Количественные показатели представлены в виде среднего (М) и стандартного отклонений (S). Проведен многофакторный анализ с помощью модели пропорциональных рисков Кокса. Для анализа выживаемости пациентов использован метод Каплана–Майера. Статистически значимыми считали значения при р<0,05.
Результаты. В соответствии с возрастом установления диагноза РПЖ пациенты были разделены на 4 группы: в возрастную группу до 60 лет вошли 38 (9,3%) мужчин, 60–69 – 95 (23,3%), 70–79 – 150 (36,8%) и 80 лет и старше – 125 (30,6%). Распределение пациентов по другим основным прогностическим признакам развития и прогрессирования РПЖ (уровню ПСА и характеристики опухоли по Глисону) представлены в табл. 1.
У 51,2% пациентов исходно уровень ПСА не превышал 10 нг/мл, и у 73,8% пациентов исходно была выявлена опухоль высокой степени дифференцировки (Глисон менее 7).
За период наблюдения умерли 159 (39%) человек, из них 51 (32%) – от РПЖ, 108 (68%) – от других заболеваний. Причиной летального исхода последних были онкологические – 22 (20,4%) человека, сердечно-сосудистые и бронхолегочные заболевания – 86 (79,6%). Средний возраст умерших пациентов составил 78±8,6 года.
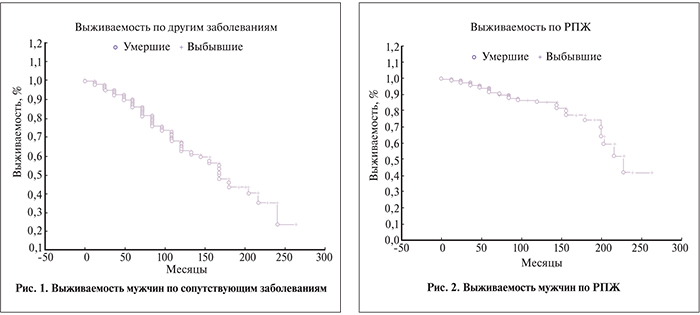
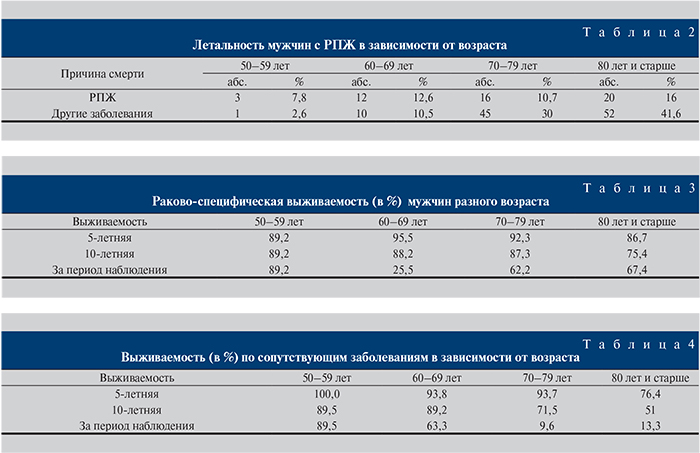
Согласно полученным данным, раково-специфическая выживаемость за период наблюдения составила 41,4±12,4%, выживаемость по другим заболеваниям – 23,4±10,6% (р<0,05).
В нашем исследовании 5-летняя общая выживаемость составила 77,7±7,8%, 10-летняя – 52,9±9,0%, тогда как 15-летняя – уже только 31,5±4,0%, а 20-летняя – лишь 9,1%. Сходная тенденция наблюдалась и в отношении показателя раково-специфической выживаемости (рис. 1, 2).
Полученные данные свидетельствуют о том, что раково-специфическая выживаемость, как и выживаемость по другим заболеваниям, тесно связана с возрастом, в котором поставлен диагноз РПЖ (табл. 2–4).
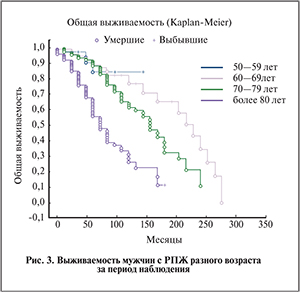
Худшие показатели выживаемости регистрировали у пациентов, у которых РПЖ диагностирован в возрасте старше 60 лет (рис. 3).
Обсуждение. Первые данные, полученные нами [37, 38], свидетельствовали о том, что в целом в группе пациентов с РПЖ раково-специфическая выживаемость и выживаемость по другим заболеваниям мало различаются, однако существенно варьируются в зависимости от возраста.
В данной работе мы оценили значение РПЖ и других заболеваний как причину летального исхода в большой популяции пациентов. За период наблюдения умерли 159 мужчин, из них 51 – от РПЖ и 108 – от других заболеваний. Ведущие причины летального исхода – онкологические заболевания другой локализации и сердечно-сосудистые заболевания. Средний возраст умерших пациентов составил 78±8,6 года. Большинство (75,4%) пациентов были в возрасте старше 70 лет.
Раково-специфическая выживаемость составила 41,4±12,4%, по другим заболеваниям – 23,4±10,6% (p<0,05).
Полученные нами результаты соответствуют данным о выживаемости пациентов с РПЖ, представленным в уже ставшей классической работе С. Parker [39], согласно которым имеет место значительное увеличение смертности через 10 лет от момента постановки диагноза РПЖ. В нашем наблюдении общая выживаемость прогрессивно снижалась: если 5-летняя выживаемость составила 77,7±7,8%, то 20-летняя уже не превышала 9,1%. Сходная тенденция имелась и в отношении снижения раково-специфической выживаемости. Следует отметить тот факт, что смертность от других заболеваний в этой группе превышала раково-специфическую смертность.
Анализируя полученные результаты, мы отметили, что 5- и 10-летняя раково-специфическая выживаемость по группам больных практически не различается, тогда как выживаемость по другим заболеваниям в возрасте 60 лет значительно снижается. Важно отметить, что у пациентов старше 70 лет наблюдалось снижение выживаемости при наличии сопутствующей патологии по сравнению с пациентами без сопутствующих заболеваний. Объяснение столь высокой смертности от других заболеваний кажется вполне логичным и естественным для пациентов старше 70 лет, причина же высокой смертности от РПЖ среди пациентов в возрасте 60–69 лет не совсем ясна. Мы изучили исходные данные пациентов в возрасте 60–69 лет, умерших от рака, и выяснили, что у большинства (9 из 14) умерших пациентов диагностирован рак стадии Т3 и более с высоким уровнем ПСА и высоким значением индекса Глисона. Таким образом, выявленный в более молодом возрасте рак имеет более агрессивное течение. Согласно нашим результатам, РПЖ, выявленный в возрасте старше 70 лет, вносит лишь небольшую лепту в летальность пациентов этого возраста, т.е. практически все мужчины с РПЖ в возрасте старше 70 лет умирают от других заболеваний. Можно предположить, что у пациента с РПЖ вероятность умереть от основного заболевания оказалась меньше, чем от любого другого. Также мы отметили, что худшие показатели общей выживаемости отмечены у пациентов, у которых РПЖ диагностирован в возрасте старше 60 лет. В связи с этим есть основания полагать, что проведение скрининга после 70 лет для мужчин с отягощенным соматическим статусом излишние, поскольку в этой возрастной группе основной причиной смерти пациентов с РПЖ являются другие заболевания (заболевания сердечно-сосудистой системы, онкологические заболевания другой локализации). У пациентов в возрасте 60–69 лет причиной смерти могут выступать как РПЖ, так и другие заболевания. В связи с этим для пациентов моложе 70 лет, особенно в возрастной группе до 60 лет, крайне важны ранняя диагностика и оценка исходных прогностических критериев развития и прогрессирования РПЖ. Это подтверждает сделанный нами ранее вывод, согласно которому шансы у пациента с РПЖ умереть от основного заболевания ниже, чем от других заболеваний.
Использование того или иного метода лечения в каждой возрастной группе с учетом общесоматического статуса пациента требует дальнейшего изучения, поскольку активное применение гормональной терапии примерно в два раза увеличивает вероятность смерти от прогрессирования сердечно-сосудистых заболеваний у пациентов старших возрастных групп [26, 28]. В связи с этим необходимо дифференцированно подходить к выбору тактики лечения пациента с РПЖ, включая и возможность динамического наблюдения пациентов с клинически незначимым РПЖ. Это имеет свои социальные, психологические и экономические преимущества, которые могут оказаться очень важными для пациента, особенно с небольшой прогнозируемой продолжительностью жизни, так как при этом не ухудшается качество жизни.
Заключение. Ведение больных РПЖ, особенно старших возрастных групп, остается сложной задачей, требующей, с одной стороны, строгого следования стандартам лечения, разработанным на основе принципов доказательной медицины, с другой – индивидуального подхода к каждому больному. Гармоничное сочетание этих факторов и динамическое наблюдение этих пациентов могут оказаться чрезвычайно важными для системы здравоохранения в целом, так как снижаются затраты на лечение, нивелируются ненужные траты на лечение клинически не значимых опухолей, траты на лечение осложнений активного лечения.


