Введение. Несмотря на то что клинические результаты и исходы высокоинтенсивной ультразвуковой аблации (High Intensity Focused Ultrasound – HIFU) при лечении локализованного рака предстательной железы пока окончательно не валидизированы и остаются спорными, полученные в последние годы данные об этом методе лечения впечатляющи: сообщается о хороших показателях выживаемости без биохимического рецидива [1–5]. Спасительная дистанционная лучевая терапия (СДЛТ) уже давно широко применяется после радикальной простатэктомии [6, 7], хотя положительный эффект от ее применения, идеальный кандидат для ее получения и оптимальный срок для начала терапии остаются дискуссионными [8–10]. Одно из первых исследований по применению СДЛТ при рецидиве после HIFU-аблации на небольшой выборке пациентов продемонстрировало многообещающие результаты [11]. Целью настоящего исследования было определить предиктивные факторы успеха или неудачи СДЛТ при рецидиве после HIFU-аблации.
Материалы и методы. Объектом исследования явились пациенты с морфологически доказанным при биопсии локализованным раком простаты. Больные проходили лечение с декабря 2008 г. в клинике урологии Клинической больницы им. С. Р. Миротворцева СГМУ, где им было проведено первичное оперативное лечение рака простаты методом HIFU-аблации на аппарате Ablatherm Integrated Imaging («EDAP TMS», Франция). Критерий включения: проведение HIFU-аблации в качестве первичного лечения локализованного рака предстательной железы (T1–T2) без предшествующего применения других методов, включая гормональную и лучевую терапию.

Далее для анализа была отобрана сплошная выборка пациентов с гистологически подтвержденным рецидивом локализованного рака простаты после одного или двух сеансов HIFU-аблации, получавших СДЛТ с гормональной терапией и без таковой. Местный рецидив подтверждали при получении положительного результата контрольной биопсии простаты в отсутствие метастазов и признаков экстрапростатического распространения опухоли по данным магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) органов грудной клетки и брюшной полости и остеосцинтиграфии.
 Пациенты были разделены по группам до проведения HIFU-аблации на категории низкого (28%), промежуточного(56%) и высокого (16%) рисков, по классификации прогностических факторов Д’Амико [7, 12]. По классификации TNM (2002) и градации по шкале Глисона пациенты (доля в %) распределись следующим образом: со стадией T1 – 48%, T2 – 50%, T3 – 2% и ≤6 балов (61%), 7 балов (31%), ≥8 (8%) соответственно.
Пациенты были разделены по группам до проведения HIFU-аблации на категории низкого (28%), промежуточного(56%) и высокого (16%) рисков, по классификации прогностических факторов Д’Амико [7, 12]. По классификации TNM (2002) и градации по шкале Глисона пациенты (доля в %) распределись следующим образом: со стадией T1 – 48%, T2 – 50%, T3 – 2% и ≤6 балов (61%), 7 балов (31%), ≥8 (8%) соответственно.
Главным оцениваемым параметром была выживаемость без прогрессирования (ВБП), которую определяли по отсутствию биохимического рецидива (ASTRO: три последовательных подъема уровня простатспецифического антигена [ПСА] со скоростью прироста 0,75 нг/мл и более в год или по критерию Штутгарта надир ПСА плюс 1,2 нг/мл) и отсутствию необходимости в назначении дополнительных методов лечения [13–23].
Все пациенты заполняли опросники самостоятельной оценки состояния: «Общие терминологические критерии нежелательных явлений» (Common Terminology Criteria for Adverse Event — CTCAE, версия 4.0), Опросник симптомов недержания мочи, ISQ (Incontinence Symptom Questionnaire) и «Международный индекс эректильной функции 5» (МИЭФ-5). Пациенты заполняли анкеты и опросники до и после HIFU-аблации, непосредственно до СДЛТ, через 3 мес и через 1 год после СДЛТ.
Данные CTCAE позволяли оценивать переносимость СДЛТ после HIFU-аблации, включая нежелательные явления (НЯ) со стороны акта мочеиспускания и желудочно-кишечного тракта (ЖКТ). Нежелательные явления определяли как мягкие (степень 1), средние (степень 2), тяжелые (степень 3), жизнеугрожающие или инвалидизирующие (степень 4), смерть, связанную с НЯ (степень 5).
В соответствии со шкалой МИЭФ-5 при минимальном показателе 5 говорили о тяжелой эректильной дисфункции (ЭД), при максимальном – 25 – об ее отсутствии.
Статистический анализ выполняли с помощью программного пакета SPSS, версия 15 (SPSS Inc., США). Надир ПСА, будучи важным параметром после СДЛТ, анализировали как количественную и категориальную переменную после определения ряда пороговых значений. Анализ выживаемости выполняли с помощью logrank-теста; проводили мультивариабельный анализ с моделью регрессии Кокса для идентификации предиктивных факторов неудачи терапии. Статистически значимыми считали различия при p<0,05.
Результаты. С декабря 2008 г. 270 пациентам был выполнен 1 или 2 сеанса HIFU-аблации. Из 270 пациентов 49 подверглись СДЛТ, из них 32 с гистологически доказанным местным рецидивом рака простаты с минимальным периодом наблюдения в 1 год были отобраны в аналитическую группу (табл. 1).
Спасительную дистанционную лучевую терапию выполняли после последнего сеанса HIFU-аблации через срок, медиана которого составила 6 мес. Все пациенты подверглись конформной дистанционной лучевой терапии в дозе, медиана которой была равной 72 Гр (65–78 Гр). Медиана срока наблюдения за пациентами составила 11±3 мес. Шестнадцати (50%) пациентам параллельно со СДЛТ проводилась андроген-депривационная терапия с помощью аналогов рилизинг-фактора лютеинизирующего гормона (ЛГРГ). Вопрос о назначении андрогенной депривации решался индивидуально с учетом группы онкологического риска, надира ПСА и согласия пациента.
Онкологический контроль
Медиана срока наблюдения за пациентами (n=32) составила 32,5 (от 5 до 60) мес. Медиана надира ПСА после СДЛТ была равной 0,05 (от 0 до 6,1) нг/мл, медиана срока до достижения надира – 12 (от 2 до 48) мес. Всего у 3 пациентов терапия оказалась неудачной в соответствии с принятым определением биохимического рецидива. В этой подгруппе пациентов медиана уровня ПСА до СДЛТ составила 3,76 (от 0,5 до 8,11) нг/мл, а медиана надира ПСА после СДЛТ – 0,78 (от 0 до 3,8) нг/мл. Для сравнения: у пациентов, у которых СДЛТ была успешной, уровень ПСА до СДЛТ составил 1,5 (от 0,1 до 7) нг/мл, а надир ПСА после СДЛТ – 0,04 (от 0,02 до 1,41) нг/мл.
Гормональная терапия была назначена 3 пациентам после неудачи лучевой терапии через срок, медиана которого составила 5 мес. Пятилетняя ВБП для всех 32 пациентов составила 81,25%; для групп низкого, промежуточного и высокого онкологического рисков – 93, 70 и 58,5% соответственно (рис. 1, 2).
При унивариабельном анализе уровень ПСА до СДЛТ, принадлежность к группе риска, надир ПСА после СДЛТ, надир ПСА выше 0,2 нг/мл и время до достижения надира были предиктором неудачи СДЛТ (рис. 3, табл. 2). Сумма баллов Глисона, клиническая стадия, доза облучения, порог дозы облучения в 72 Гр, доля положительных биопсий меньше 33%, 33–50% и более 50%, а также объем простаты не были значимым фактором неудачи СДЛТ. При мультивариабельном анализе надир ПСА после СДЛТ с порогом 0,2 нг/мл и время достижения этого надира были значимым предиктором неудачи.
Безопасность
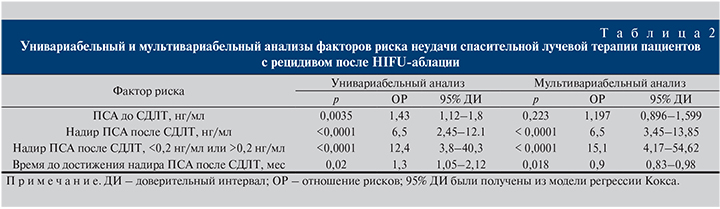
Ранние НЯ определялись как развившиеся в ближайшие 3 мес после лучевой терапии, а поздние НЯ – спустя 1 год и более (табл. 3). Не сообщалось о серьезных побочных явлениях со стороны ЖКТ, и, в частности, не отмечалось случаев образования ректоуретральных свищей. Большинство НЯ со стороны мочевыделительной системы были представлены ургентностью. У 3 пациентов отмечена острая задержка мочи, потребовавшая трансуретральной резекции простаты (степень 3). Одному пациенту потребовалось отведение мочи в связи с хронической задержкой мочи (степень 4; рис. 4).
Частота недержания мочи возросла с 28% до СДЛТ до 32% через 1 год после СДЛТ, достигнув максимума 39% через 3 мес после СДЛТ. Различия между состоянием до СДЛТ и состоянием через 1 год после СДЛТ не были статистически значимыми.
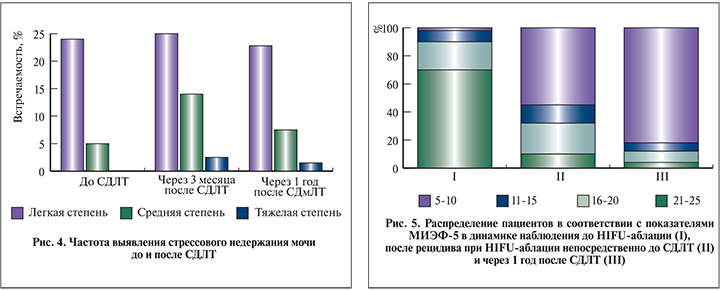
Все 32 пациента заполнили опросник МИЭФ-5 во всех временных точках (рис. 5). Результаты показали, что тяжесть ЭД возрастала после HIFU-аблации и затем снова после СДЛТ.
Обсуждение. HIFU-аблация, будучи активно изучаемым методом, по данным ряда публикаций, продемонстрировала приемлемые онкологические результаты в лечении локализованного рака простаты, особенно при заболевании низкого и промежуточного рисков. Основным ограничением остается недостаточный период наблюдения за больными во многих исследованиях, что и делает этот метод лечения спорным; однако в некоторых исследованиях первоначальные обнадеживающие результаты были подтверждены и на отдаленных сроках. Медиана срока наблюдения за пациентами в них достигала 6,4 года [7, 13, 14, 17, 21].
Было продемонстрировано, что примерно у 15% пациентов отмечается местный рецидив заболевания и эти пациенты становятся кандидатами для паллиативной гормонотерапии либо спасительной радикальной простатэктомии, или дистанционной лучевой терапии с куративной целью [4, 7, 18, 20]. Потенциал спасительной простатэктомии после HIFU-аблации был продемонстрирован на небольших группах пациентов [25]. Кроме того, в литературе описаны результаты лечения пациентов методом СДЛТ с рецидивом после HIFU-аблации [11]. Пятилетняя выживаемость без признаков заболевания составила 80% у пациентов с положительным результатом контрольной биопсии. В то же время в случаях, когда местный рецидив не подтверждался гистологически, она составляла только 44%, что может быть объяснено тем, что причиной биохимического рецидива было наличие субклинических метастазов [11]. В данной когорте пациентов местный рецидив был подтвержден положительным результатом биопсии в отсутствие признаков экстрапростатического распространения и метастазирования по данным МРТ, КТ органов грудной клетки и брюшной полости и остеосцинтиграфии.
Для того чтобы оценить онкологическую эффективность СДЛТ после HIFU-аблации, требовалось принять определение успешности или неуспешности терапии, учтя тот факт, что спасительное лечение было проведено на предстательной железе, которая уже была подвергнута аблации с помощью высокоинтенсивного ультразвука. Использование определения биохимического рецидива Финикс (надир+2 нг/мл) привело бы к переоценке результата, потому что оно не может быть применено по отношению к простате, на которой уже была предпринята попытка куративного лечения. С другой стороны, обычное определение успешности СДЛТ после радикальной простатэктомии (ПСА менее 0,2 нг/мл или неопределяемый уровень ПСА) привело бы к недооценке результата, так как простата в случае СДЛТ после HIFU-аблации не удалена из организма [26]. Таким образом, в соответствии с руководством по ведению пациентов с повышением уровня ПСА после первой попытки лечения было выбрано компромиссное определение. Оно подразумевало комбинацию определения рецидива по ASTRO (три последовательных повышения уровня ПСА и скорость прироста данного параметра более 0,75 нг/мл в год), определения Болла (уровень ПСА более 1,5 нг/мл) и критерия Штутгарта (надир ПСА плюс 1,2 нг/мл) [3, 24]. Применение адъювантной терапии считалось показателем неудачи спасительного лечения. Учитывая, что биохимический рецидив после лучевой терапии развивается обычно в течение третьего года после облучения [27], считаем, что наше исследование, в котором средний период наблюдения составил 37 мес, по всей видимости, отражает истинную эффективность СДЛТ после HIFU-аблации. Выживаемость без прогрессирования, равная 81,25%, достигнутая 32 пациентами, очень благоприятно выглядит на фоне показателей 10–55%, зарегистрированных у пациентов, получивших СДЛТ после радикальной простатэктомии [8].

Также в литературе имеются данные о результатах сальважной HIFU-аблации после неудачной ДЛТ.
В исследовании с участием 167 пациентов и медианой периода наблюдения, равной 18 мес, сообщается, что показатели выживаемости без признаков заболевания составили 53, 42 и 25% для групп пациентов низкого, промежуточного и высокого рисков соответственно [28]. Аналогичные показатели в нашем исследовании составили 93, 67 и 55%, что позволяет предположить, что спасительная ДЛТ после HIFU-аблации обеспечивает лучший, чем обратная тактика, результат. Мультивариабельный анализ показал, что основными предикторами неудачи СДЛТ были надир ПСА более 0,2 нг/мл и срок до достижения надира. Было установлено, что в случае первичной лучевой терапии надир ПСА 0,2 нг/мл и задержка его достижения коррелируют с выживаемостью без биохимического рецидива; то же справедливо и для HIFU-аблации.
Нами получены сопоставимые показатели частоты токсических явлений степени 1 и 2. Нежелательные явления степени 3 со стороны мочевыделительной системы отмечались несколько чаще, чем при лучевой терапии в монорежиме, но все равно не представляли значительной проблемы. Все это требует мультидисциплинарного подхода к решению вопросов о лечении пациентов с агрессивными опухолями.
Показатели частоты недержания мочи не были значительно выше через 1 год после СДЛТ по сравнению с их уровнем до СДЛТ. Частота недержания мочи тяжелой степени через 1 год после СДЛТ была очень низкой, составив всего 1%. Лечение с проведением СДЛТ после HIFU -аблации оказалось менее агрессивным, чем при выполнении спасительной HIFU-аблации при рецидиве после дистанционной лучевой терапии. При последней частота тяжелого недержания мочи достигает 10% [27]. Период наблюдения за пациентами в данном исследовании представляется адекватным поставленным задачам. При небольшом периоде наблюдения возможна недооценка частоты поздних осложнений, так как, по данным многих авторов, осложнения развиваются через срок, медиана которого составляет 14–18 мес [5, 7, 10]. Что касается показателей эректильной функции, то они ухудшились сначала после HIFU-аблации, а затем еще и после СДЛТ. Это НЯ также нужно учитывать при попытке найти точку равновесия между функциональными и онкологическими результатами.
Заключение. Таким образом, наша работа подтвердила возможность и целесообразность выполнения лучевой терапии после HIFU-аблации. Исходя из онкологических результатов и допустимой частоты НЯ, СДЛТ можно рассматривать как вариант терапии при рецидивах после HIFU.


