Введение. Рак мочевого пузыря (РМП) является пятым по частоте встречаемости злокачественным новообразованием в Европе, насчитывая более 150 тыс. новых случаев в год [1]. От 50 до 80% от всех впервые выявленных опухолей мочевого пузыря относятся к так называемому РМП без мышечной инвазии (РМПБМИ), при котором, несмотря на в целом благоприятный прогноз, отмечается частое местное рецидивирование, обусловливающее необходимость тщательного наблюдения и выполнения повторных эндоскопических процедур, что делает лечение этого новообразования одним из самых дорогостоящих [2].
В ряде исследований были документированы причины рецидивов РМПБМИ, среди которых наиболее важной и потенциально предотвратимой является нерадикальность трансуретральной резекции (ТУР), связанная в том числе с трудностью визуализации всех очагов опухоли во время операции [3, 4]. Для решения данной проблемы был предложен ряд способов, наиболее широко используемым из которых стала ТУР под контролем фотодинамической диагностики (ФДД) [5]. В настоящее время наиболее распространены два фотосенсибилизатора: 5-аминолевулиновая кислота (5-АЛК) и гексиламинолевулинат (ГАЛ). Несмотря на то что последний препарат является единственным зарегистрированным фотосенсибилизатором при данной патологии, 5-АЛК имеет существенное преимущество по соотношению эффективность/стоимость при сопоставимой клинической эффективности [6].
 К настоящему времени накоплена значительная доказательная база, свидетельствующая о превосходстве диагностической чувствительности ФДД в выявлении РМПБМИ по сравнению с обычной цистоскопией в белом свете за счет некоторого снижения специфичности [7]. Однако основные ожидания от использования данной технологии связаны с улучшением отдаленных результатов лечения из-за снижения количества рецидивов. Для оценки этой возможности был проведен ряд рандомизированных контролируемых исследований и мета-анализов, продемонстрировавших различные результаты, что стало причиной дискуссий о роли ФДД в лечении РМПБМИ [8–10].
К настоящему времени накоплена значительная доказательная база, свидетельствующая о превосходстве диагностической чувствительности ФДД в выявлении РМПБМИ по сравнению с обычной цистоскопией в белом свете за счет некоторого снижения специфичности [7]. Однако основные ожидания от использования данной технологии связаны с улучшением отдаленных результатов лечения из-за снижения количества рецидивов. Для оценки этой возможности был проведен ряд рандомизированных контролируемых исследований и мета-анализов, продемонстрировавших различные результаты, что стало причиной дискуссий о роли ФДД в лечении РМПБМИ [8–10].
Целью данного исследования стала систематическая оценка в опубликованной к настоящему времени рецензируемой литературе влияния ТУР под контролем ФДД с использованием 5-АЛК в качестве фотосенсибилизатора на безрецидивную выживаемость пациентов, страдающих РМПБМИ.
Материалы и методы
Критерии включения в мета-анализ
Целью поиска в электронных базах данных были публикации, отвечающие следующим критериям: проспективные рандомизированные контролируемые исследования (РКИ), в которых сравнивалась эффективность ТУР под контролем ФДД (экспериментальная группа) с ТУР в белом свете либо под контролем синего с предварительным введением плацебо (группа контроля); в качестве фотосенсибилизатора при ФДД должна использоваться 5-АЛК; оценка эффекта вмешательств должна проводиться в отношении пациентов с РМПБМИ после визуально полного эндоскопического удаления опухоли; в качестве критерия эффективности должна использоваться безрецидивная выживаемость или время до развития клинического рецидива. Такие публикации, как письма редактору, тезисы и материалы научных конференций, а также исследования, оценивающие частоту резидуальной опухоли, выявленной в результате ранней повторной ТУР, не принимались к дальнейшему рассмотрению.
Стратегия поиска исследований
На первом этапе проведен систематический поиск в электронных базах данных PubMed и Кокрановской базе систематических обзоров, клинических испытаний и оценок медицинских технологий (до февраля 2016 г.). Дополнительно проанализированы систематические обзоры и мета-анализы по вышеуказанной теме и их библиографические списки. Поисковый запрос в базу данных PubMed приведен в табл. 1. После исключения дублирующих источников выполнен их скрининговый просмотр, отобраны полные тесты работ для более глубокого изучения. Проведена аналогичная работа по поиску источников в русскоязычных базах данных «Российская медицина» Центральной научной медицинской библиотеки Первого МГМУ им. И. М. Сеченова (1988 г. – февраль 2016 г.) и научной электронной библиотеки eLIBRARY.RU (до февраля 2016 г.); стратегия поиска в русскоязычных ресурсах приведена в табл. 2.
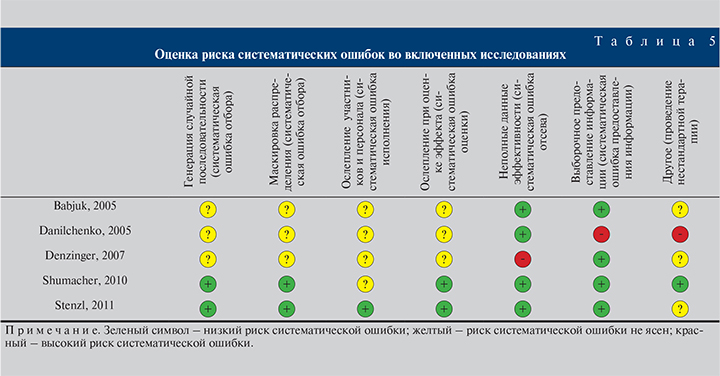
Оценка риска систематической ошибки во включенных исследованиях
Качество отобранных исследований независимо друг от друга оценивали два автора данной работы с использованием Кокрановского инструмента по оценке риска систематической ошибки [11]. В случае различий в оценках между исследователями вопрос подвергался совместному обсуждению, окончательное решение принималось при достижении согласия. В зависимости от результирующего риска систематической ошибки исследования определяли в группу высокого (наличие ≥1 оценки высокого риска), промежуточного (нет высокого и ≥3 оценок с неизвестным риском) и низкого (все остальные исследования) рисков.

Извлечение, преобразование и синтез данных
Для определения различий в исходах в экспериментальной и контрольной группах, представленных безрецидивной выживаемостью, мы использовали суммацию отношения рисков (ОР) рецидива, что считается наиболее адекватным показателем, характеризующим цензурированные данные [12]. Для этого требовались вычисление натурального логарифма ОР для каждого исследования, его стандартного отклонения (СО) и оценка количества участников в каждой группе для определения удельного веса исследования. Полностью необходимые данные не были приведены ни в одной публикации, поэтому для вычисления натуральных логарифмов ОР и их СО использовали непрямые методы, описанные ранее [13, 14].
При вычислении искомых показателей несколькими методами и наличии разбежек в их значениях выбирали таковые, полученные наиболее достоверными методами, вычисляли среднее арифметическое при одинаковой достоверности методов или выбирали наиболее достоверные результаты после обсуждения всеми авторами. Для вычисления величин ОР использовали электронные таблицы, разработанные J. Tierney и соавт. [15].
Полученные для каждого исследования показатели ОР, их 95% доверительные интервалы (ДИ) и весовые коэффициенты были обобщены с использованием модели случайных эффектов. Для синтеза полученных данных использовали программу Review Manager (RevMan) v.5.3.5.
Оценка гетерогенности, анализ чувствительности и подгрупповой анализ
Для анализа степени однородности суммарных оценок применяли критерии τ2, χ2 и I2. При выявлении статистически значимой гетерогенности оценок эффекта в анализируемых исследованиях проводили анализ чувствительности, включивший оценку возможного избыточного влияния одиночного исследования на результаты анализа. Также был проведен подгрупповой анализ со стратификацией исследований в зависимости от риска систематической ошибки, длительности наблюдения и количества участвующих центров.
Оценка систематической ошибки, связанной с публикацией результатов исследований
Строили воронкообразный график с отображением логарифма ОР против его СО для каждого исследования. Асимметрия графика была оценена с использованием регрессионного теста M. Egger и соавт. [16]. Также принимали во внимание наличие выявленных неопубликованных исследований.
Результаты
Результаты поиска
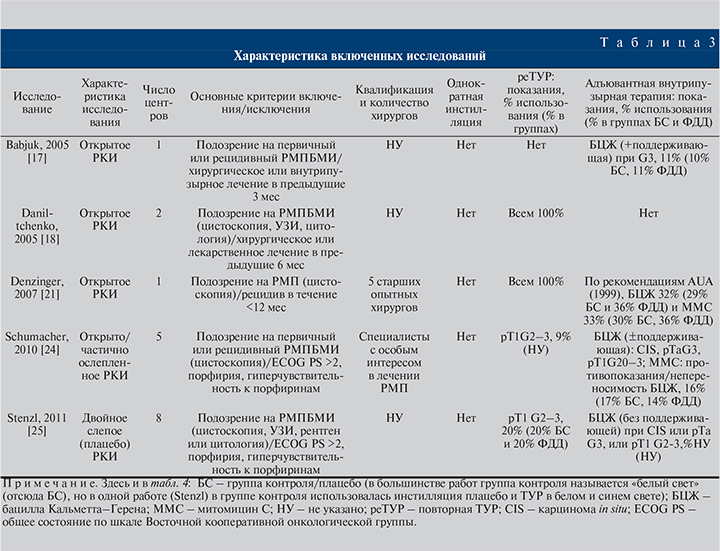
Поиск в базах данных выявил 297 публикаций, из которых 249 были исключены на основании скринингового анализа заглавий и/или содержания рефератов. Для детального прочтения было отобрано 48 полнотекстовых источников, из которых в мета-анализ включено 5 публикаций. Блок-схема, отображающая ход поиска публикаций и причины исключения из окончательного анализа, показана на рис. 1.
Для трех работ [17–19] выявлено четыре дублирующие публикации на русском, чешском и немецком языках, из которых для мета-анализа были отобраны англоязычные тексты. Кроме того, обнаружено, что работы [18, 20] и [19, 21, 22] являются анализом одной и той же когорты пациентов с разным сроком наблюдения или определенной подгруппы пациентов [22]. В этих случаях для мета-анализа отбирали публикации с наибольшей длительностью наблюдения и общей когортой пациентов [18, 21]. В ходе поиска была выявлена одна работа по теме обзора, опубликованная только в виде тезиса доклада [23] и, соответственно, не включенная в мета-анализ.

Характеристика включенных исследований
Большинство включенных исследований являлись открытыми РКИ (табл. 3), количество участвовавших в исследовании центров колебалось от 1 до 8. Основные критерии включения/исключения из отобранных исследований были примерно сходными во всех анализируемых публикациях. Опыт и квалификация хирургов были описаны только в двух работах. Исследования существенно различались по частоте использования дополнительных лечебных воздействий: если однократная ранняя внутрипузырная инстилляция химиопрепарата не использовалась ни в одном исследовании, частота выполнения реТУР колебалась от 0 до 100%, а внутрипузырная химиo- или иммунотерапия применялась в 0–65% случаев.
Число включенных (рандомизированных) пациентов в различных работах колебалось от 115 до 381 (табл. 4). От 5 до 37% от всех рандомизированных пациентов оказались неоцениваемыми. Критерии отнесения пациента к неоцениваемым несколько различались: общими для всех исследований были выявление мышечной инвазии и показания к цистэктомии, в то же время в двух работах [17, 21] в качестве дополнительного критерия было отсутствие опухоли при ТУР, причем в одной из них [21] наблюдались существенные различия в количестве неоцениваемых пациентов в группах преимущественно из-за различий по частоте отсутствия опухоли. Длительность наблюдения колебалась от 12 [24, 25] до 83–86 мес [21]. Во всех работах эффект лечения был выражен безрецидивной выживаемостью, в двух исследованиях [17, 18] дополнительно рассчитывалась медиана безрецидивной выживаемости и только в одном [21] – ОР рецидива. В трех исследованиях наблюдалось статистически значимое увеличение безрецидивной выживаемости в экспериментальной группе по сравнению с контролем, в двух остальных статистически значимых различий не было. В четырех работах проводился подгрупповой анализ эффективности лечения (см. табл. 4).
Риск систематических ошибок во включенных исследованиях
Во всех публикациях, кроме одной [24], процесс рандомизации (генерация случайной последовательности и маскировка распределения на группы) не был описан достаточно полно для исключения возможности систематической ошибки. Учитывая мультицентровый характер исследования A. Stenzl и соавт. [25] и используемые критерии GCP, было принято решение о присвоении данной работе низкого риска систематической ошибки по данному разделу.
Что касается методов маскировки, то в одном исследовании использовалось ослепление участников и персонала [25], еще в одном [24] указывалось на ослепление патоморфологов, исследовавших полученные препараты после ТУР. В обеих этих работах оценка результатов лечения проводилась урологами, не осведомленными о выполнении пациентами ФДД. В остальных исследованиях нет упоминания о каких-либо методах маскировки при оценке эффекта лечения, однако, учитывая невысокий риск систематической ошибки в данном случае, в этих работах данный риск считали неизвестным.
 Длительность наблюдения в группах была сопоставимой во всех анализируемых исследованиях. В работе S. Denzinger и соавт. [22] имела место очень высокая (37%) доля неоцениваемых пациентов, причем наблюдалась существенная разница в их количестве в зависимости от группы (31% в контрольной и 42% в экспериментальной), что обусловливало высокий риск систематической ошибки.
Длительность наблюдения в группах была сопоставимой во всех анализируемых исследованиях. В работе S. Denzinger и соавт. [22] имела место очень высокая (37%) доля неоцениваемых пациентов, причем наблюдалась существенная разница в их количестве в зависимости от группы (31% в контрольной и 42% в экспериментальной), что обусловливало высокий риск систематической ошибки.
При оценке источников систематической ошибки предоставления информации мы выявили возможность смешения двух событий в качестве конечной точки исследования: 1) выявления гистологически остаточной опухоли при реТУР и 2) диагностики клинического рецидива при контрольном обследовании. В этом отношении заслуживает внимания работа D. Danilchenko и соавт. [18], где за рецидив принималось выявление остаточной опухоли в результате реТУР. В остальных работах, несмотря на отсутствие четкого разделения остаточной опухоли и клинического рецидива, анализ кривых безрецидивной выживаемости показал отсутствие смешения вышеуказанных событий.
В качестве дополнительного источника систематической ошибки считали проведение пациентам нестандартной терапии (например, неиспользование внутрипузырной терапии), что могло искажать конечные результаты лечения и модифицировать эффективность ФДД. В этом отношении наиболее подверженным риску систематической ошибки было исследование D. Danilchenko и соавт. [18], где внутрипузырная терапия не проводилась, а всем пациентам выполнялась реТУР, что также не соответствует рекомендациям по лечению РМПБМИ. В работах [17, 21, 25] мы не смогли оценить риск систематической ошибки, связанной с проведением нестандартного лечения, из-за отсутствия внутрипузырной терапии пациентов с высоким риском рецидива [17, 25] и избыточного использования реТУР [21]. Результирующая оценка риска систематических ошибок во включенных исследованиях показана в табл. 5. Таким образом, в двух исследованиях выявлен низкий риск систематических ошибок: в одном – промежуточный, в двух — высокий (см. табл. 4).
Извлечение, преобразование и синтез данных
Для одного исследования [21] натуральный логарифм ОР и его СО были вычислены на основании представленного значения ОР рецидива, его 95% ДИ и количества событий (рецидивов) в каждой группе. Из двух публикаций [18, 25] необходимые показатели получены на основе анализа величины критерия р и количества событий в группах и из двух [17, 24] – только на основании анализа числовых значений и графиков безрецидивной выживаемости, а также таблиц количества пациентов, подверженных риску.
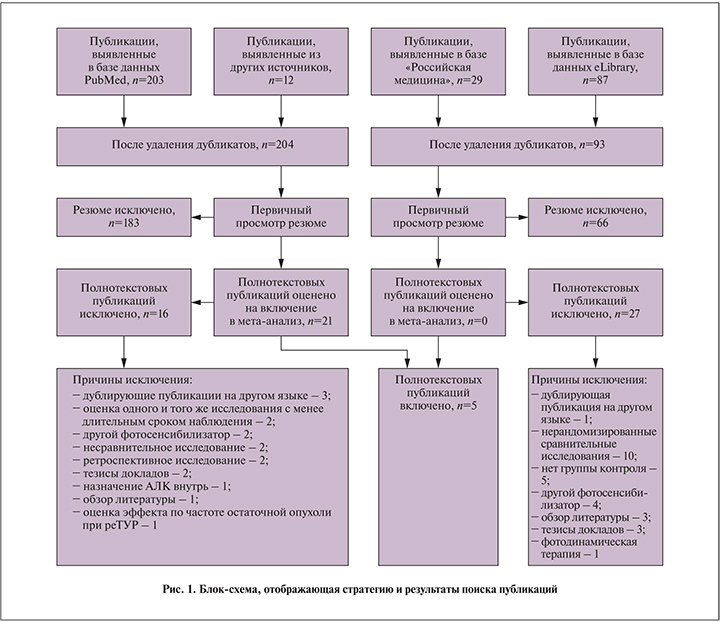
После суммации эффекта в пяти исследованиях, включивших 1089 пациентов (544 в экспериментальной группе и 543 в группе контроля) ОР рецидива составило 0,71 (95% ДИ – 0,48–1,04; p=0,08; рис. 2). Наблюдалась значительная гетерогенность в величине эффекта между различными исследованиями (p=0,001; I2=78%). При проведении анализа чувствительности источник гетерогенности выявить не удалось. Для дальнейшего изучения выявленной гетерогенности выполнен подгрупповой анализ в соответствии с ранее определенными критериями. К сожалению, сформированные подгруппы по трем критериям в значительной мере совпадали. В результате была выделена подгруппа 1 (исследования с высоким риском систематической ошибки, моно- или двуцентровые, с длительным периодом наблюдения) и подгруппа 2 (исследования с низким риском систематической ошибки, мультицентровые, с коротким периодом наблюдения). Анализ в сформированных подгруппах выявил наличие слабой гетерогенности (p=0,31; I2=14% и p=0,18; I2=44% в подгруппах 1 и 2 соответственно) и выраженные различия между подгруппами (p=0,001; I2=90,5%). В подгруппе 1 эффект ФДД статистически значимо превышал таковой стандартного лечения (ОР – 0,51; 95% ДИ – 0,38–0,69; p<0,0001), в то время как в подгруппе 2 величина эффекта находилась в пределах статистической погрешности (ОР – 1,04; 95% ДИ – 0,77–1,42; p=0,78; рис. 2).
Риск систематической ошибки, связанной с публикацией результатов исследований
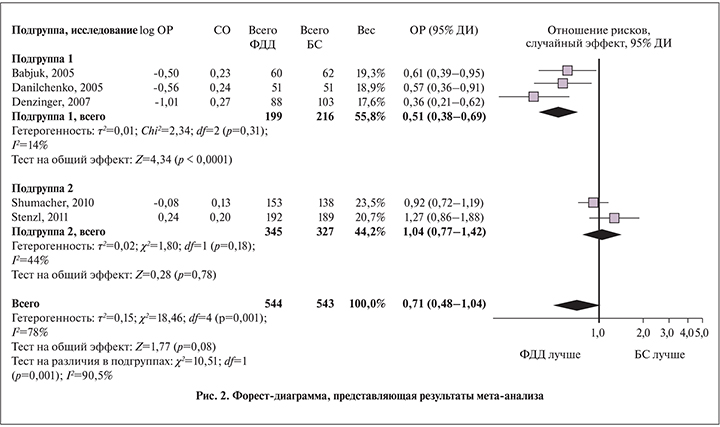
Хотя вид воронкообразного графика (рис. 3) и тест регрессионной асимметрии M. Egger (односторонний, p=0,10) не выявили признаков «публикационной» систематической ошибки, учитывая информацию о наличии неопубликованного отрицательного исследования P. Alken и соавт. [23], авторы приняли решение о наличии риска такой ошибки при рассмотрении результатов данного мета-анализа.
Обсуждение. В современной онкоурологии вопрос о долговременной эффективности ТУР под контролем ФДД с 5-АЛК дискутабелен. Примечательно, что различные результаты показывали не только вышеупомянутые рандомизированные сравнительные исследования, но и мета-анализы, посвященные данному вопросу.
Всего в ходе поиска до февраля 2016 г. обнаружено 6 мета-анализов (табл. 6). Два из них [26–28] включали три ранних, резко позитивных исследования, и их положительные результаты, по всей видимости, чересчур оптимистичны. Поскольку мета-анализ [29] был посвящен исключительно оценке результатов применения ГАЛ, основной интерес представляют три оставшиеся работы [9, 10, 30].
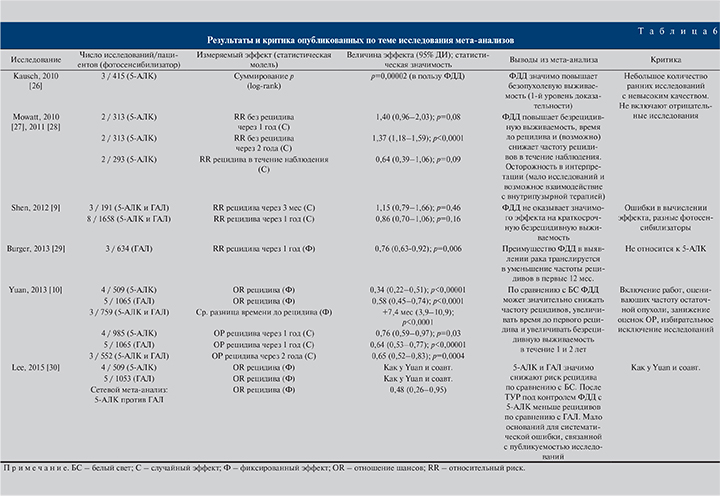
В мета-анализе [9] авторы оценили ОР рецидива в течение 3 и 12 мес после ТУР с ФДД (в анализ были включены исследования, использовавшие ГАЛ и 5-АЛК) по сравнению с ТУР без ФДД и не установили значимого влияния на эти показатели. Детальный анализ приведенных данных из анализируемых публикаций выявил массу грубых ошибок [31]. Наиболее ярким несоответствием является оценка 3- и 12-месячного риска рецидива в работе D. Daniltchenko и соавт. [18] в пользу контрольной группы, в то время как оригинальное исследование показало обратное.
В последующем мета-анализе [10] сравнивали отдаленные результаты ТУР и ФДД по сравнению с ТУР без ФДД по четырем показателям: отношению шансов рецидива (без указания временных рамок), средней разнице времени до рецидива и отношению шансов рецидива через 1 и 2 года. Из четырех исследований, включенных в оценку первого показателя, два [20, 32] оценивали частоту остаточной опухоли, кроме того, из публикации M. Babjuk и соавт. [17] также взяты данные о частоте остаточной опухоли. И только из одной работы [19] для анализа отобрано число первых рецидивов на протяжении всего периода наблюдения. Оценка второго и четвертого показателей включила исследования, использовавшие ГАЛ, а оценка третьего не включала работу [18]. Кроме того, вызывает сомнения правильность оценки рисков в исходных исследованиях. Так, в работе A. Stenzl и соавт. [25] риск рецидива был выше в группе ФДД, тогда как в мета-анализе Н. Yuan и соавт. [10] он оказался выше в контрольной группе.
В 2015 г. был опубликован сетевой мета-анализ J. Lee и соавт. [30], в котором вычисление отношения шансов рецидива полностью копировало результаты, полученные H. Yuan и соавт. [10], а значит, в действительности оценивало риск выявления остаточной опухоли при повторной ТУР с включением данных о рецидивах из одного исследования.
В нашей работе мы постарались избежать ошибок предыдущих мета-анализов и крайне ответственно подошли к включению исследований и сбору первичных данных. Сложность суммации результатов включенных исследований была обусловлена различной длительностью наблюдения за пациентами, причем в наиболее качественных работах оценивались только 12-месячные результаты, что ограничивало максимальный срок оценок частот рецидивов для подсчета показателей относительного риска (relative risk) или отношения шансов (odds ratio). Чтобы обойти это ограничение, а также для более полного отражения цензурированных данных, представленных в изучаемых работах, использовали показатель ОР (hazard ratio), который представляет собой результат деления рискового коэффициента наступления неблагоприятного исхода в экспериментальной группе, полученного из функции выживаемости, на аналогичный показатель в группе контроля. Для суммации ОР из исследований с различным сроком наблюдения (от 1 до 8 лет) необходимо допущение о его постоянстве в течение всего времени наблюдения, что, по-видимому, в целом верно для анализируемых работ. Недостатком избранного подхода было использование непрямых методов вычисления эффекта в анализируемых исследованиях, причем в двух из них пришлось использовать анализ кривых выживаемости и таблиц динамики количества пациентов, подверженных риску.
В отличие от предыдущих мета-анализов наша работа позволила сделать четыре важных заключения: 1) в целом мы не выявили статистически значимого эффекта ТУР под контролем ФДД; 2) наблюдалась выраженная гетерогенность в оценках эффекта в различных исследованиях; 3) эта гетерогенность могла быть обусловлена как качеством проведения исследования, так и фактом его проведения в специализирующемся на ФДД центре, причем выраженный эффект наблюдался среди публикаций с высоким риском систематических ошибок и одновременно моно- и двуцентровых исследованиях; 4) значительная доля исследований (2 из 5) характеризовалась высоким риском систематических ошибок, кроме того, мы не смогли исключить вероятность «публикационной» систематической ошибки в нашей работе.
Каковы возможные объяснения полученных результатов? Самое простое объяснение заключается в том, что ранние олигоцентровые положительные исследования необъективны и мы должны ориентироваться на результаты отрицательных методологически выверенных мультицентровых работ. Тем не менее считаем, что есть и другое объяснение различий эффектов в подгруппах.
Так, несмотря на то что ФДД является существенным технологическим шагом вперед на пути к улучшению визуализации РМПБМИ, этот метод основан на субъективной визуальной оценке, которая в большой степени зависит от исследователя, его опыта и квалификации. Кроме того, для трансформации преимуществ данной технологии в отношении улучшения полноты удаления опухоли этот метод требует достаточных хирургических навыков эндоскопического удаления или абляции выявленных очагов. Хотя ТУР мочевого пузыря считается технически простой операций, подходящей для начального обучения урологов, существует много доказательств того, что это не так, если говорить о качественном выполнении данного вмешательства [33]. Вариации в технике выполнения этой операции, различный опыт и квалификация хирургов обусловливают значительную вариабельность в частоте рецидивов после ТУР [4]. Недавние споры об эффективности различных хирургических технологий, используемых в лечении рака предстательной железы, наглядно продемонстрировали существенную роль конкретного хирурга [34], его опыта [35], зачастую существенно превышающую роль применяемого хирургического оборудования [36].
Принимая во внимание все вышеуказанное, по нашему мнению, необходимым условием адекватной оценки эффективности ТУР под контролем ФДД является достаточный опыт выполнения данных процедур [37], что не всегда соблюдалось в мультицентровых исследованиях, но предположительно присутствовало в моно- и двуцентровых работах. Таким образом, другим объяснением различий в эффективности ФДД между выделенными подгруппами может быть более квалифицированное выполнение процедуры в олигоцентровых исследованиях, обусловленное опытом проведения ФДД.
К сожалению, учитывая ограниченность доказательной базы, в данной работе невозможно прийти к определенным выводам. Для разрешения противоречий требуются дальнейшие исследования с участием хирургов с большим опытом проведения ФДД, а также со стратификацией в зависимости от индивидуального хирурга, поскольку данный фактор, не учтенный в подавляющем большинстве исследований, может быть источником значимой вариабельности эффективности лечения.
Заключение. Несмотря на то что в целом мы не выявили статистически значимого снижения риска рецидива при проведении ФДД совместно с ТУР по сравнению с только ТУР для пациентов, страдающих РПМБМИ, такой эффект наблюдался в подгруппе, объединившей исследования с высоким риском систематической ошибки, одно- или двуцентровые и с длительным периодом наблюдения. Значение данной находки не вполне понятно из-за возможности альтернативных вариантов объяснения выявленных различий. В целом наблюдалось недостаточное качество доказательной базы в значительной доле включенных исследований, кроме того, нельзя было исключить возможность наличия «публикационной» систематической ошибки.



