ЭПИДЕМИОЛОГИЯ
Рак предстательной железы (РПЖ) является одним из наиболее распространенных злокачественных заболеваний у мужчин. Ежегодно в мире регистрируют более 550 тыс. новых случаев РПЖ. Именно с этим связан тот факт, что диагностике и лечению данной патологии в последнее время уделяется все больше внимания как за рубежом, так и в Российской Федерации.
Наиболее высокие показатели заболеваемости РПЖ отмечены в США, Канаде и в ряде стран Европы, где он выходит на 1-е место в структуре онкологических заболеваний. Рак предстательной железы (РПЖ) занимает второе место в структуре заболеваемости злокачественными новообразованиями мужского населения России и составляет 14,3% [140]. У мужчин в возрасте старше 60 лет этот показатель увеличивается до 18,5%. В 2014 г. в России выявлено 37168 новых случаев РПЖ, при этом средний возраст мужчин с впервые выявленным РПЖ составил 64,4 лет (в 2003 г. данный показатель был несколько выше – 70,4 лет). Стандартизованный показатель заболеваемости РПЖ в 2014 г. в России составил 39,38 на 100 тысяч мужского населения. При среднегодовом темпе прироста 7,11%, прирост заболеваемости РПЖ с 2004 по 2014 г. составил 116,68%. В 2014 г. по сравнению с 2004-м у мужчин на фоне значительного снижения стандартизованного показателя смертности (-12,3%) от всех злокачественных новообразований идет нарастание показателя смертности от злокачественных опухолей предстательной железы (26,2%). Так, у мужчин 60–69 лет, РПЖ является причиной смерти в 6,2% случаев, а в возрастной группе >70 лет достигает 14,16%, занимая второе место после опухолей трахеи, бронхов и легкого [140].
Распространенность РПЖ зависит от этнических и географических особенностей. Как мы уже писали, наиболее высокая заболеваемость у афроамериканцев, проживающих в США (на 60% выше, чем у белых американцев), наименее высокая у китайцев, проживающих в Китае [107].
Помимо расовых особенностей факторами риска развития РПЖ считают генетическую предрасположенность, возраст мужчины и особенности питанияА. Вероятность развития опухоли предстательной железы у мужчины, у которого один из ближайших родственников первой степени родства (отец или брат) болел РПЖ, вдвое выше, чем в популяции; если болели двое родственников или более, риск заболевания РПЖ возрастает в 5–11 раз [41, 108]. Показатель заболеваемости белых американцев в возрасте до 65 лет составляет 44 на 100 тыс., а в возрасте 65–74 лет – 900 на 100 тыс. [107]. Риск развития РПЖ повышается у мужчин, употребляющих большое количество жиров животного происхождения [29].
ПРОФИЛАКТИКА
В настоящее время специфическая профилактика РПЖ не разработана. В некоторых исследованиях изучалась профилактическая роль финастерида (ингибитора 5-α-редуктазы)C [111], соевых продуктовC [53], ликопинаB [38], селенаC [128], витамина ЕD [48].
СКРИНИНГ
Популяционным или массовым скринингом считают обследование мужчин (входящих в группу риска) без симптомов заболевания. Обычно оно проводится в рамках клинического исследования и инициируется исследователем. В отличие от этого, ранняя диагностика проводится в отдельных клинических случаях и инициируется лицом (пациентом), проходящим обследование, и/или его лечащим врачом. Оба типа обследований преследуют две цели:
- снижение смертности от РПЖ (цель обследования заключается не в выявлении как можно большего количества новообразований, а в увеличении продолжительности выживаемости, что в значительной мере зависит от своевременной диагностики);
- повышение качества жизни (при оценке увеличения продолжительности жизни используется индекс QUALYs «поправка на качество жизни»).
В 2009 г. опубликованы результаты европейского мультицентрового рандомизированного исследования скрининга рака простаты (ERSPC), включившего более 180 тыс. мужчин, согласно которым проведение скрининга РПЖ с помощью ПСА через 9 лет наблюдения снизило смертность от данного заболевания на 20%. В последующие годы было отмечено, что при увеличении срока наблюдения за пациентами снижение смертности стало еще более значительным. Так, через 14 лет смертность от РПЖ в одном из центров, участвовавших в исследовании, снизилась на 44%. При медиане наблюдения 12 лет частота метастатического рака простаты в группе скрининга оказалась меньше на 31%.

В 2009 г. вышли в свет результаты американского исследования по скринингу рака простаты, легких, кишечника и яичников (PLCO), где статистически доказано, что скрининг РПЖ с помощью ПСА не привёл к уменьшению смертности от РПЖ. Нужно отметить, что в отличие от европейского протокола американское исследование было менее массовым и продолжительным. Предварительное тестирование на ПСА 44% мужчин до рандомизации уже уменьшило число выявленных случаев РПЖ, т.е. фактически данный протокол сравнивал более интенсивный скрининг РПЖ с менее интенсивным, что неоднократно отмечено в научной литературе.
В настоящее время как Европейская ассоциация урологов (EAU), так и Американская ассоциация урологов (AUA) рекомендуют проведение скрининга/ранней диагностики РПЖ с помощью ПСА у мужчин, информированных о преимуществах (главное – снижение смертности от РПЖ) и недостатках данного подхода [134–138].
КЛАССИФИКАЦИЯ
Классификация по системе TNM
Т – первичная опухоль
- Тх – недостаточно данных для определения первичной опухоли.
- Т0 – первичная опухоль не определяется.
- Т1 – клинически неопределяемая опухоль (не пальпируется и не визуализируется):
- Т1а – опухоль случайно выявлена при операции (объем опухолевой ткани не более 5% резецированной ткани предстательной железы);
- T1b – опухоль случайно выявлена при операции (объем опухолевой ткани более 5% резецированной ткани предстательной железы);
- Т1с – опухоль выявлена при игольчатой биопсии (выполненной в связи с повышением уровня ПСА).
- Т2 – опухоль локализуется в предстательной железе1:
- Т2а – опухоль локализуется в одной доле и занимает <50% пораженной доли;
- T2b – опухоль локализуется в одной доле и занимает >50% пораженной доли;
- T2с – опухоль располагается в обеих долях.
- Т3 – опухоль выходит за пределы капсулы предстательной железы2:
- Т3а – опухоль прорастает в парапростатическую клетчатку (с одной или с обеих сторон);
- T3b – опухоль прорастает в семенные пузырьки.
- Т4 – опухоль прорастает в окружающие органы и ткани, кроме семенных пузырьков (шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или переднюю брюшную стенку).
N – регионарные лимфатические узлы3
- Nх – недостаточно данных для определения статуса лимфатических узлов.
- N0 – нет метастазов в регионарные лимфатические узлы.
- N1 – метастазы в регионарные лимфатические узлы.
М – отдаленные метастазы4
- Мх – недостаточно данных для определения отдаленных метастазов.
- М0 – нет отдаленных метастазов.
- М1 – отдаленные метастазы:
- М1а – метастазы в лимфатические узлы, не относящиеся к регионарным;
- M1b – метастазы в кости;
- М1с – метастазы в другие органы.
рТ – патоморфологическая оценка первичной опухоли
- рТ2 – опухоль ограничена капсулой предстательной железы:
- рТ2а – опухоль локализована в одной доле, занимает менее 50% доли;
- pT2b – опухоль локализована в одной доле, занимает более 50% доли;
- pT2c – опухоль локализована в обеих долях
- рТ3 – экстракапсулярное распространение опухоли:
- рТ3а – экстракапсулярная инвазия в клетчатку;
- pT3b – инвазия семенных пузырьков.
- рТ4 – прорастание в мочевой пузырь, прямую кишку или мышцы.
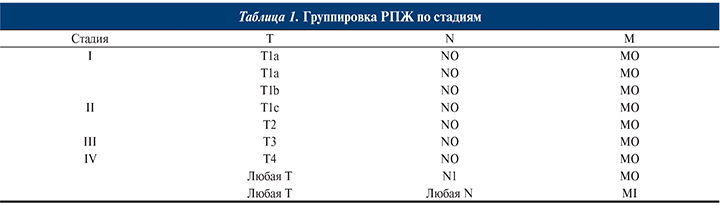
Группировка РПЖ по стадиям представлена в табл. 1.
Морфологическая классификация РПЖ
- Аденокарцинома:
- мелкоацинарная;
- крупноацинарная;
- криброзная;
- папиллярная;
- солидно-трабекулярная;
- эндометриоидная;
- железисто-кистозная;
- слизеобразующая.
- Переходно-клеточный рак.
- Плоскоклеточный рак.
Морфологическая классификация по шкале Глисона
Для оценки степени дифференцировки РПЖ наибольшее распространение получила классификация, предложенная канадским патоморфологом Глисоном (Gleason). По классификации Глисона, степень дифференцировки опухоли оценивают по 5-балльной шкале: 1 балл – наиболее высокодифференцированная опухоль, 5 баллов – низкодифференцированная опухоль. Поскольку РПЖ, как правило, представляет собой опухоль с неоднородной морфологической структурой, принято выделять наиболее распространенную гистологическую градацию (первичный балл) и следующую по частоте встречаемости градацию дифференцировки (вторичный балл). При сложении первичной и вторичной оценок получают сумму Глисона (от 2 до 10 баллов). Классификация Глисона имеет особое прогностическое значение для предсказания патоморфологической стадии процесса и оценки результатов лечения РПЖ.
В 2014 г. на съезде общества уропатологов (International Society of Urological Pathology [ISUP]) описана классификация прогностических групп в зависимости от дифференцировки опухоли предстательной железы по данным биопсии, см. табл. 2. Авторы делают вывод, что опухоли с дифференцировкой 7 (3+4) или 7 (4+3) баллов по Глисону имеют различное прогностическое значение. Ряд авторов рекомендуют использовать предложенную классификацию, однако для избежания путаницы рекомендовано дополнительно указывать привычную классификацию по Глисону.
ДИАГНОСТИКА
АНАМНЕЗ
Как правило, на ранних стадиях РПЖ симптоматика отсутствует, так как чаще всего поражаются периферические отделы простаты. При новообразованиях появляются симптомы, которые можно разделить на три группы:
- симптомы инфравезикальной обструкции: ослабление и прерывистость струи мочи, ощущение неполного опорожнения мочевого пузыря, учащение мочеиспускания, императивные позывы к мочеиспусканию, стрессовое недержание мочи;
- симптомы, связанные с местным прогрессированием опухоли: гемоспермия, гематурия, недержание мочи, эректильная дисфункция, боль в надлобковой области и промежности;
- симптомы, связанные с отдаленными метастазами: боль в костях, пояснице (при обструкции мочеточников), отек нижних конечностей (лимфостаз), параплегия (компрессия спинного мозга), потеря массы тела, анемия, уремия, кахексия.
Основные методы диагностики – пальцевое ректальное исследование, определение концентрации ПСА в сыворотке крови и трансректальное УЗИА [37].
Пальцевое ректальное исследование
Позволяет выявить РПЖ в периферических отделах при объеме узлов не менее 0,2 мл. Проведение этого обследования для скрининга у бессимптомных мужчин приводит к выявлению РПЖ только в 0,1–4% случаев [19, 80].
Определение простатспецифического антигена
ПСА – калликреинподобная сериновая протеаза, секретируемая эпителиальными клетками предстательной железы. Это не опухолеспецифический, а органоспецифический маркер, поэтому сывороточный уровень ПСА может повышаться не только при РПЖ, но и при доброкачественной гиперплазии предстательной железы и хроническом простатите.
Острая задержка мочеиспускания, биопсия предстательной железы, оперативные вмешательства (трансуретральная резекция, аденомэктомия) также приводят к повышению уровня ПСА в течение нескольких недель, что необходимо учитывать при интерпретации данных. Пальцевое ректальное обследование влечет клинически значимое повышение уровня этого маркера [23].
Средним нормальным уровнем ПСА считают 2,5 нг/мл. Кроме того, следует учитывать возрастные нормы уровня маркера: в возрасте 40–49 лет – 0–2,5 нг/мл, 50–59 лет – 0–3,5 нг/мл, 60–69 лет – 0–4,5 нг мл, 70–79 лет – 0–6,5 нг/млВ [71]. Терапия финастеридом доброкачественной гиперплазии предстательной железы приводит к снижению концентрации ПСА, при этом нормальным следует считать уровень 2 нг/млА [31].

При повышении уровня ПСА выше нормы показана биопсия предстательной железы.
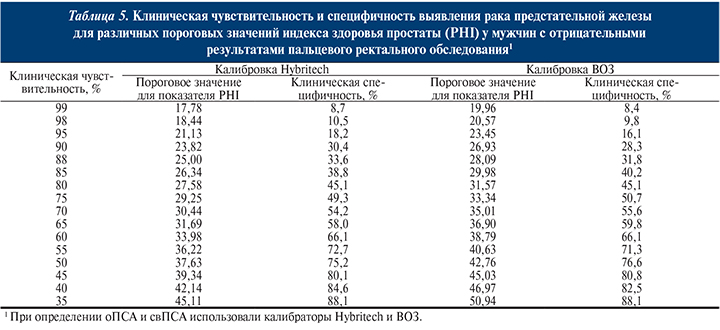
При показателе ПСА 2,5–10,0 нг/мл у большинства пациентов (75%) диагностируют доброкачественные заболевания предстательной железы, при уровне ПСА выше 10 нг/мл наиболее вероятен РПЖА [15]. В то же время у 13,2% мужчин в возрасте 50–66 лет с сывороточной концентрацией ПСА 3–4 нг/мл при биопсии диагностируют клинически значимый РПЖС [64].
В 2006 г. на основании результатов крупного исследования, включившего 9459 мужчин, продемонстрировано, что дискриминационный уровень ПСА 4 нг/мл не является адекватным и введены его возрастные нормы (табл. 3, 4) А [111]. Также показано, что снижение дискриминационного уровня ПСА приводит к ненужным биопсиям и увеличению диагностики клинически незначимого рака. Таким образом, общепризнанным дискриминационным уровнем ПСА у мужчин старше 60 лет принят уровень 2,5 нг/мл. При повышении уровня ПСА более 2,5 нг/мл рекомендуется проведение детального обследования (ПРИ, ТРУЗИ с биопсией предстательной железы).
Для повышения специфичности маркерной диагностики при выявлении раннего РПЖ применяют следующие модификации определения ПСА:
- плотность – отношение уровня ПСА к объему предстательной железы (в см3), вычисленному по данным трансректального УЗИ. Для РПЖ более характерна плотность >0,15В [6];
- плотность переходных зон – отношение уровня ПСА к объему переходных зон предстательной железы (в см3), вычисленному по данным трансректального УЗИ. Для РПЖ характерна плотность переходных зон >0,35В [132];
- молекулярные формы (фракции) – отношение уровня свободного ПСА к уровню общего ПСА. Для РПЖ более характерно отношение <0,1А [14, 17];
- скорость прироста ПСА – увеличение уровня ПСА в течение определенного времени. При увеличении концентрации ПСА более чем на 0,35 нг/мл в год возрастает вероятность РПЖC [13].
Модификации, повышающие специфичность ПСА-диагностики раннего РПЖ, применяют не только для первичной диагностики, но и для определения показаний к повторной биопсии предстательной железы у мужчин с отсутствием данных о РПЖ при первичной биопсии [14].

Помимо основного теста для ранней диагностики РПЖ определение уровня ПСА используют также для стадирования опухолевого процесса и мониторинга больных после проведенного местного лечения или в процессе системного леченияА [56, 75, 106].
Применение индекса здоровья простаты (показателя PHI – от англ. Prostate health index), основанного на определении фракции свободного ПСА (-2проПСА), позволяет повысить диагностическую и прогностическую ценность исследования, в особенности при значении общего ПСА от 2,5 до 10 нг/мл.
Анализ ПСА3 [139]
ПСА3 является одним из наиболее изученных новых биомаркеров, определяемых в моче, полученной после 3-кратного массажа ПЖ во время ПРИ. В настоящее время доступны дорогостоящие коммерческие тест-системы Progensa для определения в моче ПСА3. Показатель ПСА3 превосходит общий ПСА и процент свободного ПСА при выявлении РПЖ у мужчин с повышенным уровнем ПСА.
Уровень ПСА3 отражает небольшие, но значимые увеличения частоты положительного результата биопсии. Показатель ПСА3 может применяться вместе с ПСА и другими клиническими факторами риска в номограммах или других системах стратификации риска для принятия решения о проведении первичной или повторной биопсии. Уровень ПСА3 нарастает с увеличением объема РПЖ. Существуют противоречивые данные о том, что ПСА3 является независимым предиктором суммы Глисона.
Применение ПСА3 в качестве средства мониторирования при активном наблюдении не подтверждено.
В настоящее время основным показанием к определению ПСА3 в моче является решение вопроса о повторной биопсии после отрицательного результата первоначально проведенного исследования. Экономическая эффективность данной методики требует дополнительной оценки.
Индекс здоровья простаты
Определение индекса PHI успешно используют в клинической практике для оптимизации клинической чувствительности и специфичности при определении вероятности наличия РПЖ в диапазоне общего ПСА (оПСА) от 2 до 10 нг/мл и отрицательном («нормальном») результате ПРИ.
Индекс PHI – расчетный показатель, формула которого объединяет значения трех сывороточных тестов: оПСА, свПСА и -2проПСА. -2проПСА является изоформой свободного ПСА и концентрируется в ткани периферической зоны предстательной железы.
В ходе мультицентрового проспективного исследования было показано, что использование PHI позволяет избежать до 20% так называемых необязательных биопсий. Показана корреляция величины PHI со степенью злокачественности (агрессивности) РПЖ по шкале Глисона.
Включение в формулу индекса PHI значений трех маркеров обусловливает необходимость точного следования требованиям преаналитического этапа исследования для каждого из них. Образцы крови пациентов необходимо центрифугировать, сыворотку отделить от сгустка и исследовать или заморозить не позднее, чем через 3 ч после отбора крови у пациента. В противном случае в сыворотке крови происходят возрастание концентрации -2проПСА и понижение концентрации свПСА, что приведет к получению ложно завышенного значения индекса PHI.
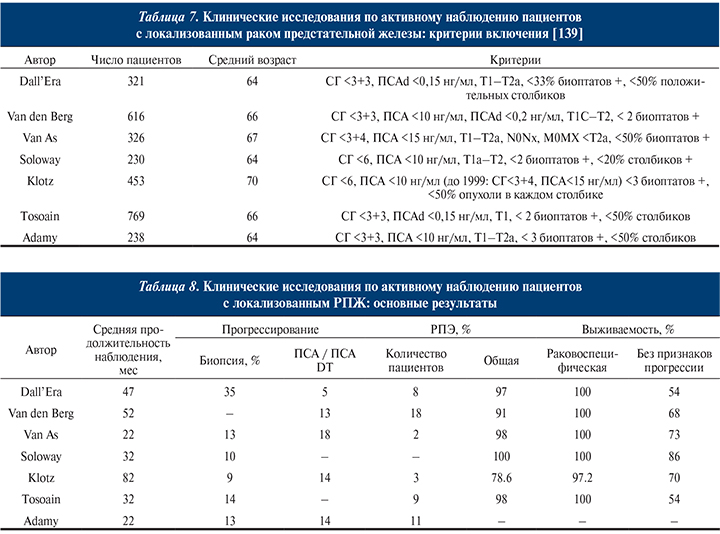
В ходе многоцентрового проспективно-ретроспективного исследования были определены клиническая чувствительность и специфичность PHI с разными пороговыми значениями (табл. 5).
Также показана корреляция индекса PHI с вероятностью наличия РПЖ: чем выше значение PHI, тем выше риск наличия РПЖ (табл. 6).
Индекс PHI в сочетании с другими показателями целесообразно использовать также в номограммах и калькуляторах риска наличия РПЖ. Определение порогового значения того или иного маркера онкологического заболевания является важнейшей задачей для его внедрения в широкую клиническую практику. На основе анализа многоцентровых исследований для индекса здоровья простаты PHI были выведены пороговые значения, указаные в инструкции к реагенту на определение -2проПСА. Так, чувствительности метода, равной 90%, на которую наиболее часто ориентируются при использовании того или иного лабораторного метода, соответствует пороговое значение PHI – 23,82 (калибровка Hybritech). Окончательное решение об оптимальном пороговом значении для российской популяции можно будет принять, основываясь на результатах продолжающегося в настоящее время Российского исследования по диагностической значимости [-2] проПСА и индекса PHI. Предварительные результаты исследования были доложены на прошедшем в Саратове конгрессе Российского общества урологов в 2014 г. Целью исследования являлось определение выявляемости РПЖ на основании собственных результатов с использованием индекса здоровья простаты PHI (Beckman Coulter) и трансректальной биопсии простаты. Для этого в клинике урологии МГСМУ им. А.И. Евдокимова с сентября 2013 по июнь 2014 г. включительно проводился набор биоматериала у 147 пациентов. Определения общего ПСА, свободного ПСА и -2проПСА в сыворотке крови проводились на иммунохимическом анализаторе Beckman Coulter UniCel DxI методами Hybritech PSA, Hybritech free PSA и Hybritech proPSA в Научном Центре «ЭфиС». Индекс PHI рассчитывался автоматически программным обеспечением анализатора. Критерии включения пациентов в исследование были: возраст 45–75 лет, уровень общего ПСА крови 2,5–10 нг/мл, отсутствие изменений простаты по данным пальцевого ректального исследования, отсутствие биопсии простаты в анамнезе. Из всего собранного материала 128 образцов сыворотки были исследованы. Всем пациентам впоследствии была выполнена трансректальная биопсия простаты по стандартной методике из 12 точек, материал исследовался патоморфологами клиники, гистологическое заключение предоставлялось по современной схеме. На основании результатов патогистологических заключений, все пациенты были разделены на 3 группы: группа с верифицированным РПЖ, группа с ДГПЖ, группа с хроническим простатитом (ХП). Средний возраст пациентов составил 58,2 (50–77) года. Средний уровень общего ПСА крови всех групп составил 6,16 (3,63–9,98) нг/мл, в группе РПЖ средний уровень общего ПСА – 6,52 (4,13–9,3) нг/мл, в группе ДГПЖ – 5,71 (3,63–9,98) нг/мл, в группе ХП – 6,22 (3,7–9,8) нг/мл. По данным патогистологического исследования, сумма баллов по Глисону 6 (3+3), 7 (3+4), 7(4+3), 8 (4+4) имела место у 26, 14, 4 и 3 пациентов соответственно.
Среднее значение индекса PHI в группе пациентов с РПЖ составило 42,69 (17,82–115,33), в группе пациентов с ДГПЖ – 30,84 (12,17– 86,14), а в группе с ХП – 30,33 (10,38–50,83). При анализе результатов различных групп пациентов была получена статистически достоверная разница уровня индекса PHI между группами РПЖ и ДГПЖ (р<0,01), РПЖ и ХП (р<0,003). Статистически достоверной разницы индекса РHI между группой ДГПЖ и ХП не получено (р=0,18). Прослеживается выраженный тренд возрастания индекса PHI по мере увеличения суммы баллов по Глисону гистологического материала по системе градации Глисона: медиана Индекса PHI для группы с cуммой баллов по Глисону 6 составила 34,3; по Глисону 7–43,3 и по Глисону 8–49,3.
При этом для общего ПСА и %свПСА статистически достоверной зависимости данных показателей от увеличения суммы баллов по Глисону отмечено не было. Медианы для групп с суммой баллов по Глисону 6, 7 и 8 составили: для оПСА – 6,8; 6,5; 7,5 нг/мл и для %свПСА – 10,8%; 9,9%; 11,0% соответственно. На основании полученных данных можно сделать вывод о целесообразности проведения дальнейших исследований, направленных на уточнение диагностической ценности PHI. Планируются набор статистически значимого количества материала, анализ, формулировка показаний и рекомендаций по применению и использованию индекса PHI в РФ.
Трансректальное ультразвуковое исследование
Эхографическая картина РПЖ неоднородна. Классическая ультразвуковая семиотика РПЖ описывает гипоэхогенные очаговые зоны в периферических отделах предстательной железы [61]. С увеличением размеров опухолевых очагов они могут содержать как гипо-, так и гиперэхогенные участки. 37,6% опухолей предстательной железы, диагностированных при биопсии, представлены изоэхогенными участками при трансректальном УЗИС[33].

Трансректальное УЗИ проводят для решения двух важных задач:
- выявление патологических участков в предстательной железе, подозрительных на РПЖ;
- повышение точности трансректальной биопсии предстательной железы.
В настоящее время изучается целесообразность применения новейших методов ультразвуковой диагностики (соноэластография, УЗИ с контрастным усилением, а также компьютеризированное ультразвуковое исследование – гистосканинг). Рутинное применение данных методов сегодня не оправданно в связи с недостаточностью доказательной базы [78].
Результаты хотя бы одного из трех методов базисной диагностики, указывающие на вероятность РПЖ, – показание к выполнению трансректальной мультифокальной биопсии предстательной железыВ [66].
Мультипараметрическое МРТ (мМРТ)
Проведенные исследования указали на наличие хорошей чувствительности данного метода для диагностики рака простаты с наличием суммы балов по шкале Глисона 7 и более [140]. Имеются данные о способности мМРТ диагностировать опухоли передних отделов простаты не доступных при выполнении стандартной биопсии [144,145].
Биопсия предстательной железы
Стандартная методика выполнения биопсии предстательной железы – трансректальная мультифокальная биопсия под контролем трансректального УЗИВ [49].
Для выполнения трансректального УЗИ чаще всего применяют ректальный датчик с частотой 5,0–8,5 МГц. Стандартная биопсийная игла имеет диметр 18 G и позволяет забирать столбик ткани длиной 15–20 мм.
Стандартная техника биопсии подразумевает забор материала билатерально от апекса к основанию железы. Выполнение секстантной биопсии не является более приемлемым. При объеме предстательной железы 30–40 мл возможно выполнение забора материала из 8 и более участков.
Во всех остальных случаях необходимо выполнять 12-точечную биопсию.
Трансуретральная резекция простаты (ТУРП) не должна применяться в качестве диагностики рака предстательной железы.
Подготовка больного к биопсии:
- очистительная клизмаD [26];
- назначение антибиотиков (ципрофлоксацин 500 мг в течение 3 дней)В [5];
- применение местных анестетиков (введение лидокаина в прямую кишку или перипростатическая блокада лидокаином)В [1, 51].
Выполнение повторной биопсии показано при отрицательных результатах первичной биопсии и сохраняющихся показаниях к проведению исследованияА. Повторная биопсия выявляет РПЖ у 20% мужчин при отсутствии опухоли в первичном гистологическом исследованииВ [57].
Показания к повторной биопсии:
- изменения при пальцевом ректальном исследовании (риск наличия рака – 5–30%);
- наличие атипичной ацинарной пролиферации (т.е. атипичные железы, подозрительные в отношении рака простаты, – риск наличия рака 40%);
- сохраняющийся повышенный уровень или повышение уровня ПСА;
- простатическая интерстициальная неоплазия высокой степени (при наличии множественной [три и более фрагмента] тяжелой неоплазии в биоптатах вероятность выявления инвазивного РПЖ при повторной биопсии 50–100%)А [43, 133].
Наличие простатической интерстициальной неоплазии высокой степени в одном или двух биоптатах не является более показанием к повторной биопсии.
Сатурационная биопсия [139]
Частота РПЖ, выявленного при повторной сатурационной биопсии (>20 столбиков), варьирует от 30 до 43% и зависит от количества столбиков ткани (УД: 2а). В особых случаях сатурационную биопсию можно выполнять трансперинеально. Это позволяет диагностировать РПЖ дополнительно в 38% случаев. Следует отметить, что у 10% больных после этого исследования развивается острая задержка мочеиспускания (УД: 2b).
Биопсия семенных пузырьков
Показания к выполнению биопсии семенных пузырьков определены в настоящее время нечетко. Решение о выполнении следует принимать индивидуально, принимая во внимание, что вероятность инвазии опухоли в семенные пузырьки при значении ПСА более 15 нг/мл составляет 20–25%. Биопсия семенных пузырьков является полезной лишь при наличии влияния на выбор тактики лечения (выбор между лучевой терапией и радикальным оперативным лечением).
ОПРЕДЕЛЕНИЕ РАСПРОСТРАНЕННОСТИ ОПУХОЛЕВОГО ПРОЦЕССА (СТАДИРОВАНИЕ)
Для оценки распространенности первичной опухоли (локализованный или экстракапсулярный процесс) применяют пальцевое ректальное исследование (положительная корреляция со стадией процесса менее чем в 50% случаев), методы лучевой диагностики и прогностические факторы.

Методы лучевой диагностики экстракапсулярной инвазии опухоли предстательной железы
Трансректальное УЗИ. Точность дифференциальной диагностики стадии Т2 и Т3, по данным только трансректального УЗИ, довольно низкая. До 60% экстракапсулярных опухолей не диагностируют до операции [34], в связи с чем трансректальное УЗИ не может быть рекомендовано как для диагностики рака простаты, так и для определения распространенности первичной опухолиС [95].
МРТ. Более чувствительный метод диагностики экстрапростатической инвазии опухоли. А применение динамической магнитно-резонансной простатовезикулографии с контрастным усилением и эндоректальной магнитной катушкой повышает точность стадирования еще на 16% [98].
КТ предстательной железы менее информативна, чем МРТ, для дифференциальной диагностики локализованного и экстрапростатического процесса, но КТ чаще назначают для планирования дистанционной лучевой терапии [86].
При подозрении на инвазию семенных пузырьков выполняют их биопсию под контролем трансректального УЗИ.
Основные прогностические факторы, определяющие стадию опухолевого процесса
- Уровень ПСА.
- Степень дифференцировки опухоли по шкале Глисона.
- Клиническая стадия по данным пальцевого ректального обследования и лучевых методов диагностики.
На основе комбинации данных прогностических факторов разработаны таблицы и номограммы, с высокой точностью предсказывающие вероятность патоморфологической стадии опухолиА. Наибольшую популярность получили таблицы Партина (Partin) и номограммы Каттана (Kattan) [75, 77].
Кроме основных используют дополнительные факторы прогноза:
- периневральную инвазию опухоли;
- число позитивных биоптатов;
- процент рака в биопсийных столбиках;
- длину рака в биопсийных столбиках.
Для определения состояния внутритазовых лимфатических узлов выполняют КТ или МРТ малого таза, но чувствительность этих методов низкая и составляет 0–70%С [50]. Точность лучевых методов диагностики повышает пункционная биопсия лимфатических узлов под контролем КТ или УЗИА [127].
Наиболее точный метод выявления метастазов в регионарные лимфатические узлы (золотой стандарт) – двусторонняя тазовая лимфаденэктомия, которую можно выполнять из надлобкового (открытого) и лапароскопического доступовА [63]. Лимфаденэктомию проводят в тех случаях, когда планируется местное лечение РПЖ.
У больных с уровнем ПСА <10 нг/мл, клинической стадией T1a–T2a и суммой баллов по шкале Глисона <7 вероятность метастатического поражения тазовых лимфатических узлов не превышает 3%, поэтому в этих случаях тазовую лимфаденэктомию можно не выполнятьА [32].

МЕТОДЫ ДИАГНОСТИКИ ОТДАЛЕННЫХ МЕТАСТАЗОВ
- Сцинтиграфия скелета.
- УЗИ, КТ, МРТ органов брюшной полости.
- Рентгенография, КТ органов грудной клетки.
Косвенный признак метастатического поражения скелета – повышение активности щелочной фосфатазы в сыворотке крови, которое выявляют у 70% больных с генерализацией процессаС [126]. Сцинтиграфию костей можно не выполнять больным с суммой по шкале Глисона <10, отсутствием клинической симптоматики поражения скелета и высоко- или умеренно дифференцированными опухолямиА [70, 72].
ВЫВОДЫ И РЕКОМЕНДАЦИИ [139]
- Выявление изменений простаты при проведении ПРИ или повышенный уровень ПСА могут указывать на РПЖ. Точное пороговое значение нормального уровня ПСА до сих пор не установлено, однако для молодых мужчин часто используют уровень:
- <2–3 нг/мл.
- Диагноз РПЖ выставляется на основании патоморфологического исследования.
Несмотря на высокую специфичность в определении экстракапсулярного прорастания и инвазии в семенные пузырьки, применение ТРУЗИ ограничено его низкой чувствительностью и тенденцией к занижению стадии РПЖ. Даже с появлением цветного допплера и контрастного усиления точность ТРУЗИ в определении стадии РПЖ остается недостаточной, и в значительной степени зависит от врача, выполняющего исследование. По сравнению с ПРИ, ТРУЗИ и КТ, МРТ демонстрирует более высокую точность диагностики РПЖ в 1 или 2 долях (T2), экстрапростатического прорастания и инвазии в семенные пузырьки (T3), в окружающие ткани (T4).
В настоящее время только удаление сторожевых ЛУ или расширенная тазовая лимфаденэктомия позволяют с высокой чувствительностью обнаружить метастазы в ЛУ при патоморфологическом исследовании.
ЛЕЧЕНИЕ
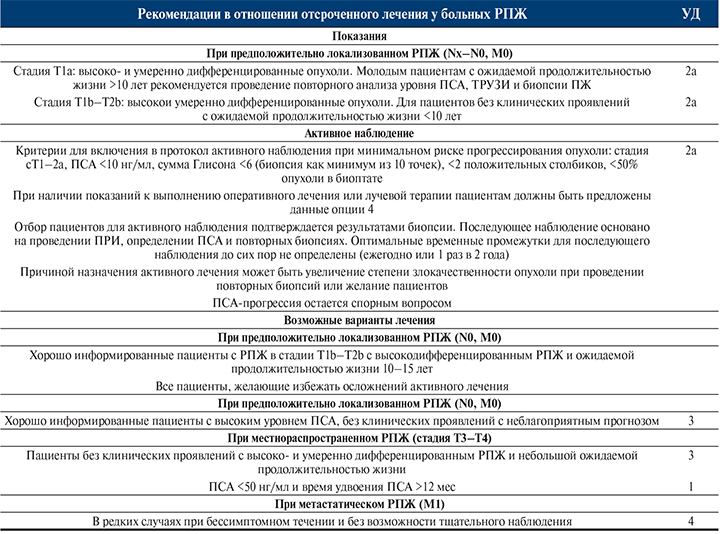
ТЩАТЕЛЬНОЕ НАБЛЮДЕНИЕ (ОТСРОЧЕННОЕ ЛЕЧЕНИЕ)
Тактика тщательного наблюдения (отсроченного лечения) предполагает отказ от немедленного лечения больного при выявлении РПЖ с динамическим наблюдением и проведением терапии при признаках прогрессирования болезни. Такой тактический вариант предлагают пациентам с выраженной интеркуррентной патологией, что позволяет избежать осложнений и побочных реакций радикальных методов лечения.

Показания к проведению тщательного наблюдения:
- локализованный РПЖ (Т1а–Т2сN0M0);
- ожидаемая продолжительность жизни больного менее 10 лет (при TaG1–G2 менее 15 лет);
- высокодифференцированная опухоль;
- тяжелые сопутствующие заболевания.
При анализе результатов тактики отсроченного лечения отмечено, что 10-летняя опухолеспецифическая выживаемость больных с высоко- и умеренно дифференцированными опухолями составляет 87%, а больных с низкодифференцированными опухолями – 34%В [20]. Риск смерти от РПЖ при проведении тщательного наблюдения в различных возрастных группах при дифференцировке опухоли 2–4 балла по шкале Глисона составляет 4–7%, 5 баллов – 6–11%, 6 баллов – 18–30%, 7 баллов – 42–70%, 8–10 баллов – 67–80%С [2].
При появлении признаков прогрессирования процесса или по желанию больного назначают гормональное лечение, однако пациента следует информировать, что немедленное начало гормонотерапии РПЖ приводит к более продолжительной опухолеспецифической выживаемости, чем при отсроченном начале леченияВ [65].
АКТИВНОЕ НАБЛЮДЕНИЕ [139]
Термин «активное наблюдение» известен как «активный мониторинг», отражает консервативное лечение РПЖ. Термин принят в прошлом десятилетии и означает то, что нет необходимости в немедленном назначении лечения пациенту. За пациентом тщательно наблюдают и проводят лечение на заранее установленных этапах прогрессирования, определяемых такими параметрами, как короткое время удвоения ПСА и ухудшение патоморфологических результатов при повторной биопсии. Тактика лечения при этом направлена на полное излечение пациента.
Активное наблюдение было предложено с целью уменьшения процента случаев излишнего лечения пациентов с клинически локализованным РПЖ группы очень низкого риска прогрессирования без отказа от радикального лечения, как при выжидательной тактике. Был проведен ряд дополнительных исследований активного наблюдения при клинически локализованном РПЖ (табл. 7 и 8). Исследованиями подтверждено, что у отобранных по строгим показаниям пациентов с РПЖ группы очень низкого риска наблюдаются очень медленное прогрессирование и низкая смертность от рака и только ограниченному числу пациентов требуется отсроченное радикальное лечение.
Критерии для начала лечения после активного наблюдения определены менее четко, однако для большинства групп использовались следующие:
- время удвоения ПСА с пороговым значением от 2 до 4 лет. Этот критерий ставится под сомнение из-за слабой связи между временем удвоения ПСА и степенью прогрессии опухоли при повторной биопсии;
- повышение суммы Глисона >7 при систематическом проведении последующих биопсий, проведенных с интервалом 1–4 года;
- обеспокоенность пациентов зачастую определяет необходимость лечения. Это является важным фактором и может наблюдаться у 10% пациентов. Недостаточно данных по отношению к активному наблюдению.

ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
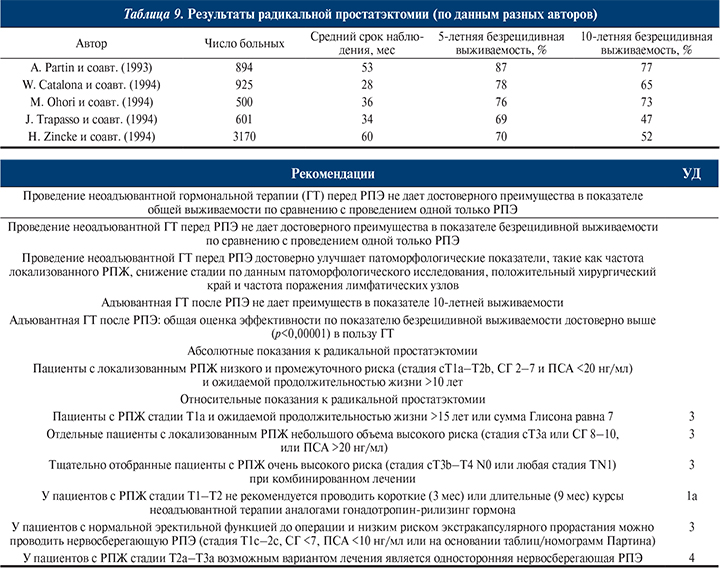
РАДИКАЛЬНАЯ ПРОСТАТЭКТОМИЯ
Оперативное лечение (радикальная простатэктомия) подразумевает удаление предстательной железы с семенными пузырьками и участком мочеиспускательного канала. Цель операции при локализованном и некоторых вариантах местнораспространенного РПЖ – полное излечение больного. Реже радикальную простатэктомию выполняют с паллиативной целью при лечении местнораспространенного РПЖ. В этих случаях задача оперативного вмешательства – удаление основной массы опухоли для повышения эффективности консервативных методов лечения.
Варианты операционного доступа при выполнении радикальной простатэктомии:
- позадилонный;
- промежностный;
- лапароскопический/роботический.
Радикальное хирургическое лечение обычно выполняют у больных
РПЖ с ожидаемой продолжительностью жизни более 10 лет.
Показания к радикальной простатэктомии:
- опухоли T1aG1–G2 при ожидаемой продолжительности жизни более 15 лет;
- опухоли T1aG3;
- опухоли T1b–T2с;
- опухоли Т3а;
- опухоли Т3b;
- ограниченная экстракапсулярная инвазия;
- степень дифференцировки 6–8 баллов по шкале Глисона;
- 9–10 баллов по Гисону – относительное противопоказание;
- уровень ПСА <50 нг/мл.
Противопоказания к радикальной простатэктомии следующие:
- Нет улучшения выживаемости по сравнению с консервативным лечением:
- ожидаемая продолжительность жизни менее 10 лет;
- опухоли T1a при ожидаемой продолжительности жизни менее 15 лет;
- опухоли Т1а при степени дифференцировки <7 баллов по шкале Глисона.
- Низкая вероятность излечения:
- опухоли Т3а с обширной экстракапсулярной экстензией, дифференцировкой ≥8 баллов по Глисону или уровнем ПСА >20 нг/ мл – относительное противопоказание;
- уровень ПСА >50 нг/мл;
- любая Т при N+.
Хирургическое вмешательство – наиболее радикальный метод лечения, и большинство урологов рассматривают его как метод выбора при лечении локализованного РПЖА [118].

Преимущества радикальной простатэктомии перед консервативными методами лечения [58]:
- полное удаление интракапсулярной опухоли;
- точное стадирование опухолевого процесса;
- излечение сопутствующей доброкачественной гиперплазии предстательной железы, имеющей клинические проявления;
- легкий и удобный мониторинг в послеоперационном периоде (снижение уровня ПСА до 0);
- меньшее беспокойство больного в послеоперационном периоде.
Относительные недостатки радикальной простатэктомии [58]:
- большой объем оперативных вмешательств;
- послеоперационная смертность;
- возможные осложнения;
- операция может не являться необходимой для определенной категории больных.
Наиболее распространенный вариант операции – радикальная позадилонная простатэктомия (РПЭ). При этом варианте операционного доступа можно выполнять двустороннюю тазовую лимфаденэктомию. Кроме того, в некоторых исследованиях демонстрируется более высокая частота положительных хирургических краев при выполнении промежностной простатэктомии по сравнению с позадилонным доступомС [10, 124].
Преимущества промежностной простатэктомии [100]:
- меньшая интраоперационная кровопотеря;
- лучшая визуализация пузырно-уретрального анастомоза;
- меньшие сроки госпитализации, быстрая реабилитация больного.
Недостатки промежностной простатэктомии [100]:
- невозможность выполнения тазовой лимфаденэктомии;
- более частая травма прямой кишки;
- затруднения при выполнении нервосберегающей техники.
Для оценки состояния тазовых лимфатических узлов перед промежтазовой лимфаденэктомииА [100].
В последние годы широкое распространение получила лапароскопическая радикальная простатэктомия, которую можно выполнить чрезбрюшинным и внебрюшинным доступами. Онкологические и функциональные результаты лапароскопической простатэктомии не отличаются от таковых позадилонной и промежностной операций, в то же время применение лапароскопической техники приводит к снижению числа осложнений и более быстрой реабилитации больных после операцииА [45, 93].

Один из вариантов лапароскопической операции – робот-ассистированная радикальная простатэктомия [92]. В Guidelines EAU 2015 г. отмечено, что робот-ассистированная радикальная простатэктомия (РАРП) продолжает активно «вытеснять» радикальную позадилонную простатэктомию (РПЭ) в качестве золотого стандарта оперативного лечения локализованного РПЖ по всему миру. При РАРП по сравнению с РПЭ достоверно меньше объем кровопотери и частота гемотрансфузий, а также имеются преимущества при оценке восстановления удержания мочи и эректильной функции [139].
Осложнения радикальной простатэктомии [46, 62, 131]:
- смертность – 0–1,2%;
- травма прямой кишки – 0,6–2,9%;
- повреждение мочеточника – 0,2%;
- тромбоз вен нижних конечностей – 1,1–1,4%;
- тромбоэмболия легочной артерии – 0,6–1,4%;
- острый инфаркт миокарда – 0,4–0,7%;
- полное недержание мочи – 0,8–3%;
- стрессовое недержание мочи – 5,0–19%;
- стриктура анастомоза – 8,6–8,7%;
- массивное лимфоцеле – 0,2%.
Эректильная дисфункция развивается у всех больных после выполнения радикальной простатэктомии без применения нервосберегаюшей техники. Для сохранения эректильной функции разработана техника операции, при которой сохраняют кавернозные нервно-сосудистые пучки [121].
Показания к применению нервосберегающей техники:
- нормальная эректильная функция до операции;
- отсутствие опухоли в области верхушки и в заднебоковых отделах предстательной железы (по данным биопсии);
- уровень ПСА <10 нг/мл.
Результаты радикальной простатэктомии при лечении больных локализованным и местнораспространенным РПЖ представлены в табл. 9 [16, 73, 76,114, 131].
ЛУЧЕВАЯ ТЕРАПИЯ
Как и радикальная простатэктомия, лучевая терапия относится к радикальным методам лечения локализованного РПЖ. При местнораспространенном РПЖ лучевую терапию проводят с целью улучшения выживаемости больных и чаще комбинируют с гормонотерапией.
Цель лучевой терапии – максимально точное достижение терапевтической дозы ионизирующего излучения в ткани предстательной железы при минимальном лучевом воздействии на окружающие органы и ткани [105].
Варианты лучевой терапии
- Дистанционная лучевая терапия:
- фотонная:
- стандартная (конвенциальная);
- 3D-конформная;
- лучевая терапия с модуляцией интенсивности;
- корпускулярная:
- протонная (высокоэнергетические протоны);
- нейтронная (быстрые нейтроны);
- внутритканевая лучевая терапия (брахитерапия):
- временная;
- постоянная.
- Сочетанная лучевая терапия.
ДИСТАНЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ
Наиболее распространенный способ лучевой терапии РПЖ – дистанционное фотонное облучение.
Показания к дистанционной лучевой терапии:
- локализованный РПЖ (T1a–T2сN0M0);
- местнораспространенный РПЖ (T3–T4N0M0) (в сочетании с гормональной терапией).
Противопоказания к дистанционной лучевой терапии:
- абсолютные:
- предшествующее облучение малого таза;
- острый воспалительный процесс прямой кишки;
- постоянный уретральный катетер;
- ожирение IV степени;
- относительные:
- сниженная емкость мочевого пузыря;
- хроническая диарея;
- инфравезикальная обструкция, требующая надлобковой цистостомии;
- язвенный колит в стадии ремиссии.
Преимущества дистанционной лучевой терапии:
- возможно полное излечение;
- нет необходимости в хирургическом лечении;
- лечение можно проводить амбулаторно.
Недостатки дистанционной лучевой терапии:
- длительное лечение (1,5–2 мес);
- трудности в оценке эффективности лечения;
- невозможность точного стадирования опухолевого процесса;
- неизлечиваемость сопутствующей доброкачественной гиперплазии;
- возможные осложнения;
- лучевая терапия может не являться необходимой для определенной категории больных.
При стандартной (конвенциальной) лучевой терапии используются методики планирования, при которых предстательная железа и семенные пузырьки идентифицируются исходя из анатомического строения окружающих органов (костные структуры, контрастированные мочевой пузырь и прямая кишка)A [83].
Облучение проводят, как правило, с четырех полей. Суммарная очаговая доза (СОД) на предстательную железу должна составлять 65–70 Гр, на тазовые лимфатические узлы – 45–50 Гр, ежедневная доза облучения – 1,8–2,0 ГрA [82]. При низком риске метастатического поражения лимфатических узлов облучения регионарных зон не проводят.
Факторы, влияющие на эффективность лучевой терапии локализованного РПЖ:
- уровень ПСА;
- степень дифференцировки опухоли;
- клиническая стадия РПЖ;
- СОД.
Повышение СОД, подводимой к предстательной железе, приводит к улучшению результатов лучевого лечения РПЖ. В четырех рандомизированных исследованиях, включивших 1465 больных локализованным РПЖ, увеличение дозы облучения >66 Гр приводило к снижению смертности от РПЖ на 29% по сравнению с пациентами, получившими дозу <66 ГрВ [117]. В другом исследовании 5-летняя безрецидивная выживаемость больных, получивших дозу ≥72 Гр, составила 87% по сравнению с 55% в группе больных, получивших дозу <72 ГрВ [117].
Повышение СОД при проведении конвенциальной лучевой терапии неизбежно ведет к увеличению побочных реакций и осложнений, связанных с увеличением лучевой нагрузки на окружающие органы и ткани. Для повышения эффективности лучевого лечения с одновременным снижением радиационных осложнений разработана методика 3D-конформной лучевой терапии, при который клинический объем облучения соответствует индивидуальной кривизне границ и форме предстательной железы. Методика 3D-конформного облучения предусматривает проведение ряда мероприятий:
- иммобилизацию больного с помощью специальных устройств;
- топометрию на компьютерном томографе;
- 3D-планирование;
- применение многолепестковых сложных коллиматоров;
- применение компьютерной системы анализа и слежения за распределением доз.
Применение конформной лучевой терапии позволяет существенно уменьшить лучевую нагрузку на мочевой пузырь и прямую кишку. Так, объем прямой кишки, на который попадает доза 66 Гр и выше, составляет 33,7% при конформном облучении и 62,7% при конвенциальном, объем мочевого пузыря – соответственно 22,0 и 50,5%C [82].

Осложнения дистанционной лучевой терапииА [82]:
- недержание мочи – 0–1,4%;
- эректильная дисфункция – 55–67%;
- диарея – 1,4–7,7%;
- стриктуры уретры – 2,6–11,0%;
- гематурия – 2,6–10,8%;
- постоянная гематурия – 1,0–2,7%;
- ректальное кровотечение – 2,6–14,9%;
- постоянное ректальное кровотечение – 0–2,7%.
Результаты дистанционной лучевой терапии при лечении локализованного РПЖ представлены в табл. 10 [35, 60, 87, 130].
Более современными методиками лучевой терапии являются лучевая терапия с модуляцией интенсивности (IMRT) и лучевая терапия, ориентированная на положение простаты в режиме реального времени (IGRT) [139].
Рецидивом РПЖ после проведенной лучевой терапии, по определению ASTRO, принято считать три последовательных повышения уровня ПСА после минимального уровня маркера, достигнутого по окончании лучевой терапии [21].
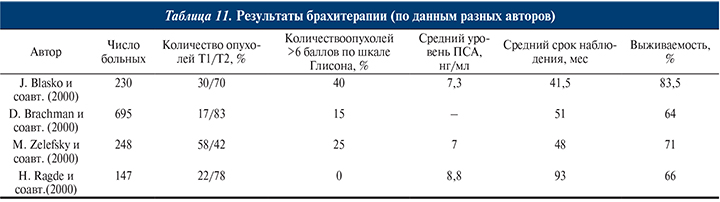
БРАХИТЕРАПИЯ (ВНУТРИТКАНЕВАЯ ЛУЧЕВАЯ ТЕРАПИЯ)
Заключается во введении (имплантации) радиоактивных источников в ткань предстательной железы. Для терапии РПЖ применяют постоянную (низкодозную) и временную (высокодозную) брахитерапию.
Для временного введения применяют изотоп 192Ir, после подведения необходимой дозы к предстательной железе радиоактивные иглы удаляют. Высокодозную брахитерапию используют при местнораспространенном РПЖ (T3N0M0) в сочетании с дистанционным облучением.

При локализованном РПЖ чаще применяют постоянную брахитерапию, при которой в предстательную железу вводят радиоактивные зерна (гранулы) 125I (период полураспада – 60 дней) или 103Pd (период полураспада – 17 дней). Благодаря более гомогенному распределению ионизирующего излучения брахитерапия позволяет подвести более высокую СОД к предстательной железе с меньшим лучевым воздействием на окружающие ткани, чем при проведении дистанционной лучевой терапии. Радиоактивные источники внедряют через промежность под контролем трансректального УЗИ. Доза облучения при имплантации 125I составляет 140–160 Гр, при имплантации 103Pd – 115–120 Гр.
Показания к брахитерапииА [68]:
- опухоли Т1с–Т2b;
- уровень ПСА <10 нг/мл;
- дифференцировка <7 баллов по шкале Глисона;
- объем предстательной железы <50 см3.
Противопоказания к брахитерапии:
- опухоли с плохим прогнозом;
- объем предстательной железы >60 см3;
- предшествующая трансуретральная резекция предстательной железы (относительное противопоказание);
- выраженная дизурия, инфравезикальная обструкция (относительное противопоказание).
Преимущества брахитерапииА [96]:
- однократная амбулаторная процедура;
- онкологические результаты не уступают таковым оперативного лечения больных с хорошим или промежуточным прогнозом;
- низкий риск развития недержания мочи (кроме больных с предшествующей трансуретральной резекцией);
- потенция сохраняется у большинства больных.
Недостатки брахитерапии:
- необходима анестезия;
- нерадикальный метод лечения при экстрапростатической инвазии (необходимо тщательное стадирование);
- необходим отбор больных:
- не показана при объеме предстательной железы >50 см3;
- не показана при выраженных расстройствах мочеиспускания (суммарный балл IPSS >20);
- не определен риск позднего недержания мочи;
- возможна острая задержка мочеиспускания.
Результаты брахитерапии представлены в табл. 11 [8, 11, 91, 129].
У больных с местнораспространенным РПЖ брахитерапию проводят только в комбинации с дистанционным облучением, при этом радиоактивные источники имплантируют через 2 нед после наружной лучевой терапии в дозе 45 Гр. Доза брахитерапии составляет 110 Гр для 125I и 90 Гр для 103Pd.
Минимально инвазивные методы лечения РПЖ [139]
К минимально инвазивным методам лечения РПЖ относятся криоабляция простаты, и абляция предстательной железы с помощью высокоинтенсивного сфокусированного ультразвука (HIFU).
Криоабляция простаты является хорошо изученным альтернативным методом терапии РПЖ, в то время как HIFU продолжает оставаться изучаемым методом.
Фокальная терапия РПЖ с помощью различных методик (криоабляции, ультразвуковой или лазерной абляции и пр.) активно изучается во многих клиниках.
ГОРМОНАЛЬНАЯ ТЕРАПИЯ
Гормонотерапию как самостоятельный вариант лечения РПЖ проводят с паллиативной целью, но гормональные препараты могут быть показаны в сочетании с радикальным оперативным или лучевым лечением как комбинированная противоопухолевая терапия.
В основе механизма действия эндокринного лечения лежит снижение концентрации тестостерона в клетках предстательной железы, которое может быть реализовано двумя механизмами:
- подавлением секреции андрогенов яичками (достигается снижение концентрации сывороточного тестостерона);
- конкурентным взаимодействием с андрогенными рецепторами в ядрах клеток предстательной железы (достигается снижение внутриклеточной концентрации тестостерона, уровень сывороточного тестостерона не снижается).
Методы гормональной терапии
- Двусторонняя орхидэктомия.
- Терапия агонистами ЛГРГ.
- Терапия антагонистами ЛГРГ.
- Эстрогенотерапия.
- Максимальная (комбинированная) андрогенная блокада.
- Монотерапия антиандрогенами.
Двусторонняя орхидэктомия
Это основной способ (золотой стандарт) гормональной терапии РПЖ, с которым сравнивают остальные методы эндокринного леченияВ [67].

Преимущества хирургической кастрации:
- быстрое снижение концентрации тестостерона в сыворотке (концентрация тестостерона снижается на 95% в течение 3–12 ч);
- технически несложная операция;
- относительно низкая стоимость лечения. Двусторонняя орхидэктомия эффективна у 80–85% больных с первично выявленным гормонально чувствительным РПЖ.
Основные побочные эффекты и осложнения хирургической кастрации [27]:
- эректильная дисфункция;
- приливы;
- остеопороз;
- мышечная атрофия;
- нарушения липидного обмена;
- гинекомастия;
- нервно-психические расстройства.
Побочные эффекты двусторонней орхидэктомии существенно ухудшают качество жизни больных РПЖ. Кроме того, хирургическая кастрация не позволяет проводить больному интермиттирующую андрогенную блокаду.
Показания к хирургической кастрации:
- локализованный РПЖ (Т1–2N0M0) – при невозможности проведения радикального лечения;
- местнораспространенный РПЖ (T3–4N0M0) – в качестве самостоятельного лечения или адъювантной терапии после оперативного или лучевого лечения;
- метастатический РПЖ (T1–4N1M0, N1–4N0M1).
Агонисты лютеинизирующего гормона рилизинг-гормона
Это синтетические аналоги нативного гипоталамического ЛГРГ.
В основе механизма действия агонистов ЛГРГ лежит десенсибилизация рецепторов к рилизинг-гормону, ведущая к снижению продукции лютеинизирующего гормона гипофиза и в дальнейшем к снижению выработки тестостерона клетками Лейдига в яичках. После введения агонистов ЛГРГ отмечают кратковременное повышение концентрации тестостерона на 3–5-й день (синдром вспышки) с последующим снижением ее до посткастрационного уровня на 21–28-й день [36, 59]. Для профилактики синдрома вспышки у больных метастатическим РПЖ перед введением агониста ЛГРГ и в течение 1-й недели терапии следует назначать антиандрогены.
Побочные эффекты и осложнения терапии агонистами ЛГРГ такие же, как при хирургической кастрации.
Показания к применению агонистов ЛГРГ:
- локализованный РПЖ (Т1–2N0M0) при невозможности проведения радикального лечения или в качестве неоадъювантной терапии перед радикальным оперативным или лучевым лечением;
- местнораспространенный РПЖ (T3–4N0M0) – в качестве самостоятельного лечения или неоадъювантной и адъювантной терапии в сочетании с оперативным или лучевым лечением;
- метастатический РПЖ (T1–4N1M0, N1–4N0M1).
В настоящее время для лечения РПЖ применяют следующие агонисты ЛГРГ.
- Гозерелин 3,6 мг под кожу передней брюшной стенки 1 раз в 28 дней или 10,8 мг под кожу передней брюшной стенки 1 раз в 3 мес; препарат находится в депонированной форме в шприц-тюбике, готов к употреблению.
- Лейпрорелин 7,5 мг внутримышечно 1 раз в 28 дней, 22,5 мг 1 раз в три месяца, 45 мг 1 раз в шесть месяцев; препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
- Декапептил 3,75 мг внутримышечно 1 раз в 28 дней; препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
- Бусерелин 3,75 мг внутримышечно 1 раз в 28 дней; препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
Лечение агонистами ЛГРГ проводят длительно до развития рефрактерности к гормональному воздействию. Некоторые авторы рекомендуют применение агонистов ЛГРГ в режиме прерывистой (интермиттирующей) терапии, однако эффективность интермиттирующей блокады остается дискутабельнойD [125].

Антагонисты лютеинизирующего гормона рилизинг-гормона [139]
В отличие от агонистов ЛГРГ антагонисты конкурентно связываются с ЛГРГ рецепторами в гипофизе; при этом не возникает эффекта «вспышки». Многие антагонисты ЛГРГ прошлого поколения вызывали развитие тяжелых гистаминопосредованных побочных эффектов. До недавнего времени не существовало депоформ этих препаратов.
Дегареликс – наиболее изученный антагонист ЛГРГ для подкожного введения 1 раз в месяц.
Основываясь на результатах крупного рандомизированного исследования (n=610), стандартная доза дегареликса должна составлять 240 мг в первый месяц с последующим применением инъекций по 80 мг ежемесячно. Основным специфическим побочным эффектом дегареликса была боль в зоне инъекции (средней или легкой степени), выявленная у 40% пациентов преимущественно после первого введения.
Эстрогены
В основе механизма действия эстрогенных препаратов лежит блокирование по механизму обратной связи синтеза лютеинизирующего и фолликулостимулирующего гормонов, что приводит к снижению концентрации тестостерона в сыворотке. Кроме того, эстрогены оказывают прямое ингибирующее действие на яички. Исторически эстрогены являются первой группой гормональных препаратов, которые стали применять для лечения РПЖ. Однако эстрогенные препараты обладают выраженными побочными свойствами, наиболее опасными из которых является кардиотоксичность, которая существенно ограничивает применение эстрогенов в клинической практикеВ [12, 36].
Побочные реакции и осложнения эстрогенотерапии:
- тромбоэмболические осложнения;
- сердечно-сосудистые осложнения;
- отеки;
- эректильная дисфункция;
- снижение либидо;
- гинекомастия и болезненность грудных желез;
- гастроинтестинальные расстройства (боль, тошнота, рвота);
- снижение функции печени.
Показания к применению эстрогенов:
- метастатический РПЖ;
- вторая линия гормонотерапии после прогрессирования опухолевого процесса на фоне хирургической кастрации, лечения агонистами ЛГРГ или антиандрогенами.
Наиболее эффективный препарат из группы эстрогенов – диэтилстильбэстрол. Его назначают в дозе 1 или 3 мг ежедневно внутримышечно. Пероральное применение препарата и доза 5 мг/сут приводят к более высокой кардиоваскулярной токсичностиВ [47]. При сравнении эффективности двусторонней орхидэктомии, терапии агонистами ЛГРГ и эстрогенами в различных рандомизированных исследованиях получены одинаковые показатели выживаемости и длительности ремисииА [81, 102, 123].

Антиандрогены
К антиандрогенам относятся стероидные и нестероидные препараты. В основе механизма действия стероидных антиандрогенов лежит не только блокирование андрогенных рецепторов в клетках предстательной железы, но и центральное прогестиноподобное действие, что приводит к снижению сывороточной концентрации тестостерона, дигидротестостерона и ЛГРГ. К стероидным антиандрогенам относятся ципротерон, мегестрол и хлормадинон. Ципротерон назначают в комбинации с хирургической кастрацией или агонистами ЛГРГ в дозе 100–150 мг перорально ежедневно, в виде монотерапии – 250–300 мг перорально ежедневно.
Побочные эффекты стероидных антиандрогенов:
- сердечно-сосудистые осложнения;
- снижение потенции и либидо;
- гинекомастия и болезненность грудных желез;
- гастроинтестинальные расстройства.
Ципротерон чаще назначают в комбинации с хирургической или медикаментозной кастрацией (в том числе для профилактики синдрома вспышки). В режиме монотерапии ципротерон имеет равную эффективность с диэтилстильбэстролом и флутамидомВ [79, 99].
Механизм действия нестероидных (чистых) антиандрогенов связан с конкурентным взаимодействием с андрогенными рецепторами и их ингибированием. При применении нестероидных антиандрогенов в режиме монотерапии концентрация сывороточного тестостерона возрастает. К нестероидным антиандрогенным препаратам относят бикалутамид, флутамид (флуцином), нилутамид (анандрон).
Показания к назначению антиандрогенов:
- локализованный РПЖ (Т1–2N0M0) – при невозможности проведения радикального лечения;
- местнораспространенный РПЖ (T3–4N0M0) в качестве самостоятельного лечения или адъювантной терапии после оперативного или лучевого лечения;
- метастатический РПЖ (T1–4N1M0, N1–4N0M1).
Флутамид (флуцином) назначают по 250 мг 3 раза в сутки перорально. Препарат применяют в режиме максимальной андрогенной блокады, реже – в режиме монотерапии [9, 18].
Побочные эффекты флуцинома:
- гастроинтестинальные расстройства (диарея, тошнота, рвота);
- гинекомастия;
- нарушения функции печени;
- снижение либидо.
Нилутамид (анандрон) назначают по 150 мг 2 раза в сутки в течение 4 нед, в дальнейшем – в дозе 150 мг/сут. Препарат применяют в комбинации с хирургической или медикаментозной кастрацией.
Побочные эффекты анандрона [28]:
- гастроинтестинальные расстройства (тошнота, рвота, нарушение аппетита);
- нарушения аккомодации;
- интерстициальный легочный синдром;
- анемия;
- нарушения функции печени.
Бикалутамид в режиме максимальной андрогенной блокады назначают в дозе 50 мг перорально ежедневно. В режиме монотерапии препарат назначают в дозе 150 мг/сут. При сравнении монотерапии бикалутамида в дозе 150 мг с хирургической или медикаментозной кастрацией отмечаются одинаковая эффективность данных схем лечения у больных с местнораспространенным РПЖ (М0) и преимущество кастрации в отношении выживаемости у больных с метастатическим РПЖ (М1), при этом качество жизни и сексуальная функция при терапии бикалутамидом в дозе 150 мг достоверно лучше [52, 115].
Побочные эффекты бикалутамида:
- гинекомастия;
- болезненность грудных желез;
- гастроинтестинальные расстройства (редко).
Гормональные препараты других классов
Кетоконазол – противогрибковый препарат, угнетающий синтез андрогенов надпочечников. Применяют в качестве второй линии гормональной терапии метастатического РПЖ на фоне прогрессирования процесса после проведения максимальной андрогенной блокады. Кетоконазол назначают перорально в дозе 400 мг 3 раза в сутки. Лечение необходимо проводить под контролем печеночных проб и в сочетании с гидрокортизоном для профилактики надпочечниковой недостаточностиВ [89, 113].
Аминоглутатемид также ингибирует продукцию андрогенов надпочечниками за счет блокирования цитохрома Р450. Препарат назначают при рефрактерности к основным гормональным препаратам [44].
Показания к проведению гормональной терапии (табл. 12) [139].
Краткие рекомендации по первичному лечению рака предстательной железы (табл. 14) [139].
Противопоказания для различных видов терапии (табл. 13) [139].
КАСТРАЦИОННО-РЕФРАКТЕРНЫЙ РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ (КР РПЖ) [139]
Нарушение нормальной регуляции функции андрогенов занимает центральную роль в патогенезе КР РПЖ. Оно опосредованно двумя основными перекрещивающимися механизмами – независимым и зависимым от андрогеновых рецепторов (АР).
Андрогеннезависимые механизмы
АР-независимые механизмы могут быть связаны с нарушением процесса апоптоза в результате нарушения регуляции онкогенеза. При прогрессировании РПЖ чаще наблюдается высокий уровень экспрессии bcl-2, а предотвращение разрушения микротрубочек может быть тем механизмом, через который bcl-2 индуцирует свое антиапоптозное влияние.
Действительно, большинство препаратов, активных при КР РПЖ, замедляет процесс формирования микротрубочек. При КР РПЖ чаще определяется мутация опухоль-супрессорного гена p53. Было показано, что гиперэкспрессия белков bcl-2 и p53 в тканях после простатэктомии – фактор прогноза агрессивного клинического течения опухоли.
В настоящее время продолжаются клинические исследования, направленные на изучение механизма действия bcl-2, поскольку в процесс могут быть также вовлечены онкоген MDM2 и ген-супрессор PTEN (гомолог фосфатазы и тензина).
Андрогензависимые механизмы
В АР-независимых опухолях большее значение может иметь аутокринная стимуляция, способная поддерживать нерегулируемый рост опухоли. В 1/3 гормонорефрактерных опухолей наблюдается амплификация и гиперэкспрессия АР, которая может привести к гиперчувствительности АР. Мутации АР могут привести к нарушению их функции. Недавно открытое слияние гена TMPRSS2, регулируемого андрогенами, и семейства онкогенов EGR-ETS поднимает вопрос о возможной андрогенной регуляции онкогенов. Даже у пациентов после кастрации в ткани метастазов неоднократно обнаруживали высокий уровень андрогенов, что свидетельствует о высоком уровне интракринного синтеза. Возможно, что высокий интрапростатический уровень холестерина может активировать определенные андрогенные механизмы.
Определение кастрационно-рефрактерного рака предстательной железы
В последние годы стали чаще использовать термин КР РПЖ, чем гормонорефрактерный или андрогенонезависимый РПЖ.
Критерии кастрационно-рефрактерного рака предстательной железы
- Кастрационный уровень тестостерона в крови (<50 нг/дл или <1,7 нмоль/л).
- Три последовательных повышения уровня ПСА, определенных с интервалом не менее 1 нед, в результате чего уровень ПСА увеличился в 2 раза по сравнению с самым низким уровнем (надиром); при этом уровень общего ПСА >2 нг/мл.
- Антиандрогены отменяются как минимум на 4 нед для флутамида и как минимум на 6 нед для бикалутамида1.
- ПСА-прогрессия, несмотря на последующие стандартные гормональные манипуляции2.
Критерии оценки результатов лечения кастрационно-рефрактерного рака предстательной железы
Оценивать результаты лечения необходимо в соответствии с клиническими рекомендациями по оценке ответа на терапию у пациентов с солидными опухолями, недавно опубликованными группой RECIST.
Для оценки метастазов можно использовать МРТ.
Уровень ПСА как маркер ответа
Было показано, что снижение ПСА >50% от исходного уровня связано с достоверным преимуществом в показателе выживаемости. В соответствии с последней оценкой исследований TAX 327 и SWOG 99–16, снижение уровня ПСА >30% связано с достоверным преимуществом в показателе выживаемости.
Другие параметры
В нескольких исследованиях показано, что число циркулирующих опухолевых клеток (ЦОК) имеет достоверную связь с показателем выживаемости, поэтому может стать ее суррогатным маркером. У пациентов с клиническими проявлениями костных метастазов можно использовать снижение интенсивности боли или ее полное купирование в качестве критерия оценки ответа на паллиативное лечение.
Рекомендации по оценке ответа на лечение
В повседневной практике оценка ответа на лечение должна быть основана на уменьшении выраженности симптомов заболевания, увеличении показателя выживаемости и других критериях.
АНТИАНДРОГЕННАЯ ТЕРАПИЯ ПРИ КАСТРАЦИОННО-РЕФРАКТЕРНОМ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Наличие андрогенорезистентного РПЖ говорит о том, что прогрессирование болезни происходит, несмотря на кастрацию. Необходимо определять кастрационный уровень тестостерона и при первом рецидиве на фоне ГТ следует убедиться в том, что уровень тестостерона составляет <50 нг/дл (1,7 нмоль/л).
При отсутствии проспективных исследований даже небольшое потенциальное преимущество продолжения кастрационной терапии перевешивает минимальный риск лечения, поэтому пациентам с КР РПЖ необходимо продолжать андрогенную супрессию до конца жизни.
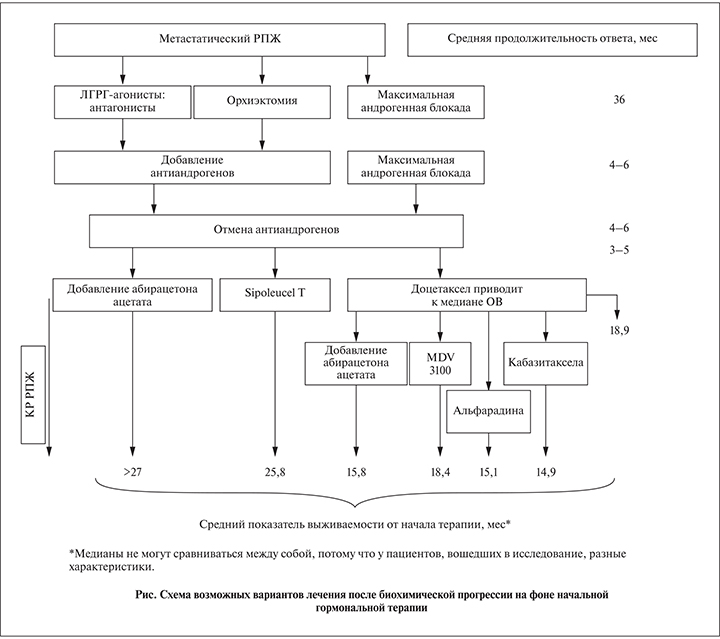
Вторая линия гормональной терапии
Существует много вариантов лечения пациентов с прогрессированием РПЖ на фоне ГТ. На рисунке суммированы варианты лечения и ожидаемый ответ.
Синдром отмены антиандрогенов
Приблизительно у 1/3 пациентов наблюдается улучшение состояния после отмены антиандрогенов, что отражается снижением уровня ПСА >50% с медианой продолжительности эффекта около 4 мес. Ответ на отмену антиандрогенов также описан для бикалутамида и мегестрола ацетата.
Необходимо рассматривать отмену антиандрогенов как терапию первой линии для пациентов с рецидивом РПЖ, даже несмотря на его ограниченную эффективность (УД: 2).
Альтернативные варианты лечения после первичной гормональной терапии
Бикалутамид
Бикалутамид – препарат с дозозависимым ответом, т.е. при более высоких дозах наблюдается большее снижение уровня ПСА. Назначение дополнительного нестероидного антиандрогена на фоне кастрационной терапии при биохимическом рецидиве приводит к снижению уровня ПСА лишь у небольшого числа пациентов.
Переход на альтернативную антиандрогенную терапию
- Недавно появился интерес к другому простому методу, называемому альтернативной антиандрогенной терапией.
- Вторая линия ГТ проводится с применением другого нестероидного препарата (например, первоначальный флутамид заменяется бикалутамидом и наоборот).
- Чем выше уровень ПСА на момент начала 2-й линии терапии, тем короче выживаемость без признаков прогрессии и ниже частота биохимического ответа.
Отмена антиандрогенов с одновременным назначением кетоконазола
Одновременное добавление кетоконазола при отмене антиандрогенов вызывает снижение уровня ПСА у достоверно большего числа пациентов (32 и 11%) и удлиняет время снижения уровня ПСА (8,6 и 5,9 мес) по сравнению с отменой антиандрогенов без терапии кетоконазолом.
Эстрогены
У 24–80% пациентов при терапии ДЭС было получено снижение уровня ПСА с установленным показателем 2-летней общей выживаемости 63%. Однако даже при низких дозах ДЭС примерно у 1/3 пациентов (31%) развивается тромбоз глубоких вен, а у 7% – инфаркт миокарда.
ВЫБОР НАИБОЛЕЕ РАЦИОНАЛЬНОЙ СХЕМЫ ПРОВЕДЕНИЯ ВТОРОЙ ЛИНИИ ТЕРАПИИ ПРИ КАСТРАЦИОННО-РЕФРАКТЕРНОМ РПЖ
Сроки проведения 2-й линии терапии при метастатическом КР РПЖ до сих пор остаются неясными.
Определение показаний к проведению химиотерапии у пациентов с неметастатическим КР РПЖ требует дальнейших клинических исследований.
Спасительная терапия
Поскольку у всех пациентов с КР РПЖ, которые получали химиотерапию на основе доцетаксела, наблюдалось прогрессирование, проводились многочисленные клинические исследования по изучению роли спасительной терапии. Результаты свидетельствуют о том, что наиболее приемлемыми режимами являются терапия кабазитакселом, интермиттирующая химиотерапия доцетакселом и молекулярно-направленная терапия.
Методы паллиативной терапии: терапия, направленная на лечение поражений костной системы при кастрационно-резистентном раке предстательной железы
Мультидисциплинарный подход часто требует совместного участия онкологов, радиологов, урологов, психологов, медицинских сестер и социальных работников.
Метастазы, сопровождающиеся болевым синдромом
У большинства пациентов с КР РПЖ костные метастазы сопровождаются выраженным болевым синдромом. Два радиоизотопа, Sr-89 и Sа-153, могут уменьшить или купировать боль в костях у 70% пациентов, однако не рекомендуется проводить ДЛТ слишком поздно, когда боль становится некупируемой. У пациентов с костными метастазами, сопровождающимися болевым синдромом, применение Rа-233 (альфарадин или «Ксофиго») оказало выраженный паллиативный эффект и положительное влияние на показатель общей выживаемости.
Частые осложнения, вызванные костными метастазами
К наиболее частым осложнениям, вызванным костными метастазами, относятся боль в костях, разрушение позвонков, деформирующие патологические переломы и компрессия спинного мозга. Остеопороз также может быть причиной патологических переломов, поэтому необходимо проводить его профилактику (см. выше).
Применение костного цемента – эффективный метод лечения болезненных переломов, позволяющий существенно уменьшить болевой синдром и повысить качество жизни. При подозрении на компрессию спинного мозга необходимо как можно скорее назначить высокие дозы кортикостероидов и выполнить МРТ.
Бисфосфонаты
Бифосфонаты применяются для ингибирования резорбции костной ткани, опосредованной предшественниками остеокластов у пациентов с КР РПЖ.
При применении золедроновой кислоты отмечалось удлинение времени до первого скелетного осложнения, что улучшало качество жизни пациентов (по данным самого крупного исследования 3-й фазы).
В настоящее время бисфосфонаты показаны пациентам с КР РПЖ с костными метастазами для профилактики скелетных осложнений, хотя пока не известен оптимальный интервал между приемами (сейчас он составляет 3 нед или менее). Всегда нужно помнить о побочных эффектах этих препаратов, особенно аминобисфосфонатов (например, некроз верхней челюсти).
Бисфосфонаты необходимо назначать на раннем этапе лечения КР РПЖ с клиническими проявлениями. При дополнительной системной терапии следует находить способы устранения возможных побочных эффектов, развивающихся при проведении паллиативного лечения, таких как болевой синдром, запор, отсутствие аппетита, тошнота, усталость и депрессия (лечение включает паллиативную ДЛТ, кортизон, анальгетики и противорвотные средства).
Ингибиторы лиганд RANK-рецептора-активатора ядерного фактора
Денозумаб – моноклональное антитело человека, направленное против рецептора-активатора ядерного фактора/В-лиганда, является ключевым медиатором образования остеокластов. У пациентов с КР РПЖ стадии М0 денозумаб привел к увеличению показателя выживаемости без костного метастазирования по сравнению с плацебо. При проведении 3-й фазы лечения было отмечено, что эффективность и безопасность денозумаба сопоставимы с золедроновой кислотой у пациентов с метастатическим КР РПЖ. Денозумаб разрешен к применению Управлением по контролю качества пищевых продуктов и лекарственных средств США для профилактики скелетных осложнений у пациентов с костными метастазами, обусловленными наличием солидных опухолей.
Рекомендации по проведению спасительной терапии после доцетаксела.
Краткие рекомендации по лечению пациентов после гормональной терапии (1-й и 2-й линии).
Цитотоксическая терапия до/после приема доцетаксела и терапия при кастрационно-рефрактерном раке предстательной железы.
Рекомендации по паллиативному лечению кастрационно-рефрактерного рака предстательной железы.
Рекомендации по паллиативному лечению кастрационно-рефрактерного рака предстательной железы.
НАБЛЮДЕНИЕ ЗА ПАЦИЕНТАМИ ПОСЛЕ РАЗЛИЧНЫХ МЕТОДОВ ЛЕЧЕНИЯ РПЖ – ОТДЕЛЬНЫЕ МОМЕНТЫ
- После радикальной простатэктомии определение уровня ПСА рекомендуется каждые 3 мес в течение 1 года, каждые 6 мес в течение 2-го и 3-го года, далее ежегодно.
- Повышение уровня ПСА после радикальной простатэктомии.
- >0,2 нг/мл свидетельствует о рецидиве заболевания.
- Три последовательных повышения уровня ПСА после минимального значения, достигнутого после лучевой терапии (надира), определяют как рецидив заболевания.
- Пальпируемый опухолевый узел и повышение уровня ПСА свидетельствуют о развитии местного рецидива.
- Биопсия рецидивной опухоли под контролем трансректального УЗИ показана при планировании второй линии радикального лечения.
- При боли в костях показана сцинтиграфия скелета (независимо от уровня ПСА).
ПРОГНОЗ
Прогноз определяется стадией, на которой выявлен РПЖ, а также степенью дифференцировки опухоли и уровнем ПСА. Пятилетняя безрецидивная выживаемость больных с I–II стадией после проведения радикального лечения (радикальной простатэктомии и лучевой терапии) составляет 70–90%, общая выживаемость – 85–97%. При выявлении РПЖ на стадии метастатического процесса средний период до прогрессирования процесса на фоне лечения составляет 24–36 мес.


