Введение. Рак предстательной железы (РПЖ) и доброкачественная гиперплазия предстательной железы (ДГПЖ) являются наиболее распространенными урологическими заболеваниями у мужчин в пожилом и старческом возрасте [1–2]. Ожидаемая продолжительность жизни менее 10 лет и выраженная соматическая патология ограничивают использование традиционных хирургических методик. Улучшение качества жизни таких пациентов остается актуальной задачей современной урологии [3].
В последние годы отмечается повышенный интерес врачей различных специальностей к такой отрасли медицины, как интервенционная хирургия, которая позволяет проводить эндоваскулярные вмешательства с минимальной травматичностью, низким операционным риском и отсутствием необходимости в проведении анестезиологического пособия [3].
Впервые эндоваскулярная эмболизация в урологической практике нашла свое применение при купировании опасных для жизни кровотечений из мочевого пузыря и предстательной железы (ПЖ). Эмболизация артерий ПЖ использовалась в течение многих лет для остановки кровотечения в связи с прогрессирующим РПЖ, а также для остановки кровотечения после операций на ПЖ [4].
Впервые эмболизация артерий ПЖ при ДГПЖ выполнена в 2004 г. на базе отделения рентгеноперационных методов диагностики и лечения КГБУЗ «Краевая клиническая больница» г. Барнаула. Результаты нашего исследования впервые были опубликованы в 2009 г. [5]. Нами пролечены 38 больных ДГПЖ с тяжелой сопутствующей патологией, не позволившей выполнить трансуретральную резекцию или аденомэктомию. В результате проведенного лечения удалось снизить объем ПЖ на 45% и улучшить качество мочеиспускания, а 4 больным заживить цистостому. В последующих исследованиях отечественных и зарубежных авторов применение данного метода лечения ДГПЖ позволяет 80–93% пациентов добиваться уменьшения объема ПЖ более чем на 40% [6–11].
Основным источником кровоснабжения ПЖ является нижняя пузырная артерия – ветвь внутренней подвздошной артерии, от которой отходят от 2 и более артерий ПЖ.
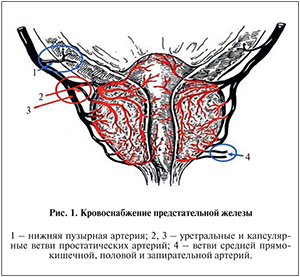 Дополнительным источником являются ветви средней прямокишечной, внутренней половой и запирательной артерий (рис. 1.)
Дополнительным источником являются ветви средней прямокишечной, внутренней половой и запирательной артерий (рис. 1.)
Современное оборудование для рентгенэндоваскулярных вмешательств позволяет проводить суперселективную катетеризацию и проводить различные манипуляции в просвете мелких сосудов.
Возможности суперселективной катетеризации мелких артериальных сосудов позволяют не только проводить эмболизацию, но и вводить лекарственные препараты непосредственно в ткань органа.
Химиоэмболизация (ХЭ) – это инновационный метод лечения злокачественных новообразований различной локализации, сочетающий эмболизацию артерии, питающей опухоль, эмболизирующим материалом, в состав которого введен противоопухолевый препарат.
Эмболизация артериального сосуда, питающего пораженный злокачественной опухолью орган, приводит к некрозу опухоли и замедлению ее роста [12–15]. Суть метода заключается в резком замедлении регионарного кровотока в опухоли путем химиоэмболизации, что обеспечивает пролонгированный контакт опухоли с высокой концентрацией химиопрепарата. Это вызывает усиленную диффузию его в ткань, что позволяет добиваться выраженного противоопухолевого эффекта без увеличения суммарной дозы препарата.
Цель исследования. Оценка эффективности и безопасности суперселективной эмболизации и химиоэмболизации простатических артерий как самостоятельного метода лечения ДГПЖ и РПЖ.
Материалы и методы. Лечение проведено на базе отделения рентгеноперационных методов диагностики и лечения Краевой клинической больницы.
 С 2004 по 2015 г. проведена эмболизация артерий ПЖ у 116 пациентов ДГПЖ, средний возраст которых составил 73,2±5,2 года. Объем ПЖ варьировался от 55 до 296 см3.
С 2004 по 2015 г. проведена эмболизация артерий ПЖ у 116 пациентов ДГПЖ, средний возраст которых составил 73,2±5,2 года. Объем ПЖ варьировался от 55 до 296 см3.
С 2011 по 2015 г. проведено лечение 37 пациентов с РПЖ методом рентгенэндоваскулярной химиоэмболизации. Все пациенты имели верифицированный РПЖ стадии T2а (7 пациентов) и стадии T2с (30 пациентов). Средний возраст пациентов составил 72,3±2,06 года. Уровень простатспецифического антигена (ПСА) колебался от 0,8 до 17 нг/мл, средний показатель – 13,1±3,9 нг/мл. Объем ПЖ составил от 61 до 93 см3 (средний объем – 69,4±9,3). До проведения ХЭ 8 пациентов получали антиандрогенную терапию в монорежиме, четверым была выполнена хирургическая кастрация. Двадцать четыре (66,6%) пациента имели симптомы нижних мочевых путей. У четверых имелись цистостомические дренажи. Срок наблюдения за пациентами с ДГПЖ и РПЖ составил от 8 до 42 месяцев. Все пациенты с ДГПЖ и РПЖ имели сопутствующую патологию, не позволившую проводить радикальные методы лечения.
Результаты лечения оценивались по динамике уровня ПСА в сыворотке крови, по данным трансректального ультразвукового исследования ПЖ, при котором оценивалась степень редукции объема ПЖ, ее эхоструктура и васкуляризация, анкетирования по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), по данным урофлоуметрии. Контрольными точками для оценки эффективности лечения стали 3, 6, 9, 12, 18 и 24 мес. Шестнадцати (43,2%) пациентам с РПЖ выполнена контрольная трансректальная мультифокальная биопсия ПЖ.
Противопоказания к проведению рентгенэндоваскулярных вмешательств:
- Непереносимость рентгенконтрастных веществ;
- Наличие острых инфекционно-воспалительных заболеваний;
- Декомпенсированная патология внутренних органов (сердечно-сосудистой системы, паренхиматозных органов);
- Декомпенсированная патология эндокринной системы;
- Нарушения сердечного ритма независимо от причины;
- Тяжелая форма бронхиальной астмы;
- Состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 мес;
- Наличие флотирующих тромбов в бассейне вен нижних конечностей;
- Анемия тяжелой и средней степеней;
- Окклюзионно-стенотические поражения подвздошных сосудов;
- Аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
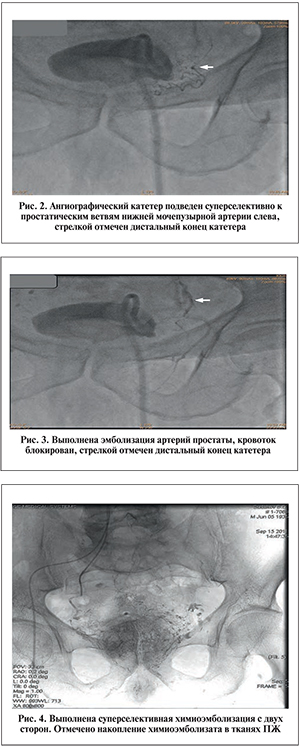
Эмболизация артерий ПЖ проводилась под местной анестезией трансфеморальным доступом по методике Сельдингера. Под рентгеновским контролем выполнена суперселективная катетеризация ветвей внутренней подвздошной артерии (ВПА) (рис. 2). Пациентам с ДГПЖ выполнена эмболизация сосудов, питающих ПЖ, путем применения микрокатетерной техники с введением микросфер EmboGold (Biosphere Medical, Франция) размером 100–300 или 300–500 мкм до полной блокады кровотока (рис. 3). Пациентам с РПЖ проведена суперселективная катетеризация ВПА поочередно с обеих сторон с последующей химиоэмболизацией сосудов, питающих ПЖ, путем введения химиопрепарата и полимерных микросфер (рис. 4). Химиопрепаратом для проведения данной процедуры служил веро-митомицин в дозировке 20 мг. В качестве источника транспортировки химиопрепарата применялись микросферы HepaSphere™ размером микросфер 300–500 мкм – это новейший эмболизационный материал с высокими абсорбционными свойствами.
Данные подвергались статистической обработке посредством программы STATISTICA 10.0 и пакета прикладных программ, встроенного в программную среду Microsoft Exel 2010.
Для оценки типа распределения признаков использованы показатели эксцесса и асимметрии, характеризующие форму кривой распределения. Распределение считалось нормальным при значении данных показателей от 2 до 2.

Значения непрерывных величин представлены в виде M±m, где M – выборочное среднее арифметическое и m – стандартная ошибка среднего.
В случаях нормального распределения, а также равенства выборочных дисперсий для сравнения выборок использован t-критерий Стьюдента. Равенство выборочных дисперсий оценивали по F-критерию Фишера. Для сравнения связанных выборок использован парный t-критерий Стьюдента.
В случае распределений, не соответствовавших нормальному закону, а также при неравенстве дисперсий использованы непараметрические U-критерий Манна–Уитни (для независимых выборок) и T-критерий Вилкоксона (для связанных выборок).
Уровень статистической значимости при проверке нулевой гипотезы принят соответствующий р<0,05. Во всех случаях использованы двусторонние варианты критериев. При сравнении нескольких групп между собой использовали поправку Бонферрони на множественность сравнений.
Результаты. В раннем послеоперационном периоде у 63% больных наблюдались явления так называемого постэмболизационного синдрома, проявлявшегося умеренными болями в области промежности, резями по ходу уретры при мочеиспускании, в небольшом проценте случаев субфебрилитет не более суток. 37% больных, однако, не испытывали никакого дискомфорта в послеоперационном периоде. Данные явления наблюдались у пациентов, перенесших эндоваскулярное вмешательство как при ДГПЖ, так и при РПЖ.
Для предупреждения и уменьшения выраженности болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначались нестероидные противовоспалительные препараты в стандартных дозировках.
Каких-либо серьезных осложнений отмечено не было, за исключением одного больного, у которого в послеоперационном периоде наблюдалась ишемия головки полового члена, купированная консервативной терапией (табл. 1).
Через 3 мес достоверно уменьшилось количество симптомов по шкале I-PSS, увеличилась Qmax. Эта тенденция сохранялась и в течение годового мониторинга, при наблюдении за пациентами в течение 24 мес после эмболизации достигнутый эффект был стабильным. Объем ПЖ и узлового образования в среднем уменьшился на 53 и 47% соответственно, максимальный эффект – уменьшение объема железы на 82%.
Положительный эффект от проведения ХЭ достигнут 31 (83,7%) пациентом. Объективный ответ получен по результатам снижения уровня ПСА, уменьшения объема ПЖ по данным ТРУЗИ и улучшения качества мочеиспускания. Проведенный анализ уровня ПСА до лечения и в процессе динамического наблюдения показал достоверное (р<0,02) снижение данного показателя после проведения ХЭ. Максимальное снижение уровня ПСА отмечено к 6-му мес после проведения химиоэмболизации. Медиана ПСА через 6 мес составила 3,4±0,02 нг/мл (табл. 2).
 У всех больных после проведения ХЭ отмечено значительное снижение объема предстательной железы. Наибольшее снижение объема ПЖ наблюдалось через 6 мес после лечения.
У всех больных после проведения ХЭ отмечено значительное снижение объема предстательной железы. Наибольшее снижение объема ПЖ наблюдалось через 6 мес после лечения.
Через 6 мес после ХЭ определены характерные эхографические признаки ишемии ткани ПЖ: нечеткие, неровные контуры ПЖ, усиление неоднородности эхоструктуры за счет участков неравномерного повышения эхогенности. У всех пациентов, у которых наблюдался положительный эффект от проведения ХЭ, не выявлены участки с гиперваскуляризацией ПЖ.
После проведения химиоэмболизации отмечено улучшение качества мочеиспускания, что подтверждается данными урофлоуметрии и оценкой симптомов нижних мочевых путей по шкале I-PSS (табл. 3).
В отношении всех пациентов, имевших обструктивную симптоматику, отмечено улучшение мочеиспускания. Максимальное улучшение показателей Qmax и баллов I-PSS наблюдалось через 6 мес после ХЭ.
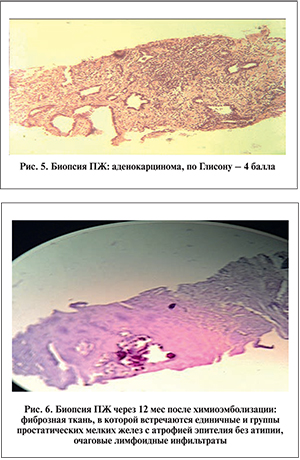
Через 12 мес выполнена контрольная биопсия 16 пациентам. По результатам морфологического исследования в 12 случаях наблюдались фиброз и дистрофия эпителия без признаков атипии, в 2 – лечебный патоморфоз (рис. 5, 6). В двух материалах сохранялась картина мелкоацинарной аденокарциномы без клинического прогрессирования заболевания.
Исследование оценки общей одно- и трехлетней выживаемости произведено по методу Каплана–Майера. Вероятность однолетней онкологической выживаемости в группе ХЭ=100%. Вероятность трехлетней онкологической выживаемости в группе ХЭ=82% рис. 7.
Обсуждение. Проблема выбора метода лечения ДГПЖ и РПЖ для пациентов, которым противопоказано хирургическое лечение, достаточно актуальна. Накопленный нами опыт применения эмболизации артерий ПЖ при ДГПЖ позволяет рекомендовать данный метод как самостоятельный для пациентов, которым противопоказано хирургическое лечение и в качестве предоперационной подготовки перед трансуретральной резекцией для пациентов с объемом ПЖ более 80 см3 [16].
Результаты нашего исследования пациентов с ДГПЖ сопоставимы с опубликованными отечественных и зарубежных ученых [6, 8–10]. В 2014 г. опубликованы результаты исследований китайских ученых, которые сравнили эффективность эндоваскулярной химиоэмболизации (n=57) и трансуретральной резекции (n=57) при доброкачественной гиперплазии предстательной железы. Эффект лечения был достигнут 100% в группе ТУР и 94,7% в группе эмболизации. Функциональные результаты оценивались по таким критериям, как оценка симптомов I-PSS, качество жизни, максимальная скорость мочеиспускания, уровень ПСА, объем ПЖ. Контрольное обследование осуществлено через 1, 3, 6, 12 и 24 мес. Достоверное (р=0,001) улучшение всех показателей по сравнению с предоперационными результатами были достигнуты в обеих группах. В группе эндоваскулярной эмболизации наблюдались следующие побочные реакции: острая мочевая инфекция – 25,9%; постэмболический синдром – 11,1%. Техническая неудача выполнения внутриартериальной эмболизации имела место в 5,3% случаев [11].
В онкологической практике рентгенохирургические вмешательства используют не только в сочетании с хирургическими, лучевыми и химиотерапевтическими методами, но и в качестве самостоятельного вмешательства. Такого рода вмешательства чаще всего применяются с целью паллиативного или симптоматического лечения.
В мировой литературе мало данных о проведении химиоэмболизации при РПЖ. Единственное упоминание о проведении ХЭ и ее эффективности при РПЖ имеется в публикации японских ученых 1990 г., которые демонстрируют редукцию опухоли более чем на 50% у 54% пациентов с РПЖ (n=41) [17].
Эмболизация и химиоэмболизация при таких заболеваниях, как ДГПЖ и РПЖ, являются довольно новым и эффективным методом лечения, расширяющим возможности медицинской помощи группе пациентов, которым ранее отказывали в проведении радикального лечения. Опыт рентгенэндоваскулярных вмешательств в урологии показал эффективность и безопасность лечения.
Возникновение методики химиоэмболизации было бы невозможным без использования всей совокупности научных и клинических исследований, проводившихся учеными на протяжении столетий в области других методик. По сути, химиоэмболизация в ее современном виде возникла на основе опыта внутрисосудистых исследований, интервенционной радиологии, системной химиотерапии и эмболотерапии.
Популярность метода ХЭ обусловливается малой травматичностью, а также низкой частотой осложнений. Однако для получения максимального эффекта от ХЭ необходимо учитывать такие показатели, как тип опухоли, ее происхождение, локализация, чувствительность пораженной ткани к химиопрепаратам, а также тип и количество эмболизирующего носителя препарата.
Исследования последних лет продемонстрировали хороший и стойкий эффект от проведения эмболизации артерий ПЖ при ДГПЖ. Достижения интервенционной хирургии при ДГПЖ позволили разработать новый метод лечения РПЖ, связанный с суперселективной катетеризацией артерий ПЖ и введением в ткань ПЖ химиопрепарата совместно с эмболизирущим материалом, что позволяет непосредственно воздействовать на опухолевые клетки и значительно уменьшать кровоток в ПЖ.
Известно, что при правильном соблюдении выполнения методики химиоэмболизации и использования микрокатетеров для суперселективной катетеризации побочные явления и осложнения возникают редко. Как правило, они связаны с частичным некрозом опухоли и ишемическими изменениями в соседних органах, кровоснабжающихся от артерий, подвергавшихся эмболизации. При этом, чем меньше диаметр частиц, использованных для эмболизации, тем большее число осложнений следует ожидать. Постэмболизационный синдром, включающий боль внизу живота, повышение температуры тела и симптомы интоксикации, продолжается, как правило, не более 2–3 суток. Большинство наших больных в послеоперационном периоде отмечали боль внизу живота и промежности различной степени интенсивности, некоторые – повышение температуры, тошноту и рвоту, которые купировались, как правило, в течение первых суток при соответствующем лечении. Инфекционных осложнений, связанных с проникновением микроорганизмов в очаг некроза, не наблюдалось.
Дальнейшее изучение методов эмболизации и химиоэмболизации при таких значимых заболеваниях, как РПЖ и ДГПЖ, позволит отработать методику, точно определить показания и противопоказания к применению, широко внедрить в практическое здравоохранение.
Заключение. Методика эмболизации артерий ПЖ демонстрирует хорошую эффективность у пациентов с ДГПЖ путем значимого уменьшения объема ПЖ и улучшения качества мочеиспускания и может быть рекомендована в качестве самостоятельного метода лечения пациентов, которым противопоказано хирургическое лечение, или как предоперационная подготовка для пациентов с объемом ПЖ более 80 см3.
На сегодняшний день методика химиоэмболизации получила широкое распространение при лечении опухолей различной локализации. Это объясняется ее эффективностью, т.к. ХЭ сочетает механизмы регионарной химиотерапии и эмболизации питающих опухоль сосудов, ведущей к ишемии и некрозу пораженной ткани.
Разработанный нами метод рентгенэндоваскулярной химиоэмболизации в лечении локализованного рака предстательной железы позволяет достоверно снизить уровень ПСА, значительно уменьшить объем предстательной железы, улучшить функциональные результаты за счет значимого увеличения максимальной скорости мочеиспускания и снижения суммарного балла I-PSS. Онкологическая выживаемость при использовании данного метода составила 100% в течение года и 82% в течение 3 лет.
Изучение безопасности проведения эмболизации и химиоэмболизации не выявило никаких значимых побочных эффектов.


