История лазеров
Сама возможность существования лазера была описана в 1917 г. в статье одного из основоположников современной физики, Альберта Эйнштейна (1879–1955). В одной из своих работ по квантовой теории относительности он описывает феномен «сверхсфокусированных» световых лучей, возникающих при столкновении фотона с атомом в возбужденном состоянии. При подобном взаимодействии атом испускает еще один фотон той же длины волны в направлении движения первого. Этот принцип описан ученым как «вынужденное испускание атомами вещества квантов электромагнитного излучения» [1].
Концепция «вынужденного испускания излучения» будет применена многими учеными. Среди них – советский физик В. А. Фабрикант, занимавшийся изучением возможностей усиления электромагнитного излучения с помощью ультрафиолетового излучения. В те же годы в США физик R. H. Dicke описывает так называемую оптическую бомбу: под воздействием короткого импульса возбуждения начиналось генерирование целой волны спонтанного излучения фотонов [2, 3]. Оба устройства были технически интересны, но не обладали главной особенностью лазера – направленным излучением.
Следующим шагом было создание устройства, работающего по схожему с лазером принципу, – МАЗЕР (MASER – Microwaves Amplifacation by the Stimulated Emission – усиление микроволн путем стимулирования излучения). Технология МАЗЕРа строилась на слегка измененном принципе стимуляции излучения, при котором частицы вещества стимулировались микроволнами, а не светом. Эта технология была параллельно разработана двумя группами ученых: группой во главе с американскими физиками C. H. Townes и A. L. Schawlow в 1954 г. и группой советских физиков во главе с А. М. Прохоровым и Н. Г. Басовым [2]. Эти разработки стали настоящим прорывом, так как открыли путь к созданию осцилляторов и усилителей, работающих на принципах мазера. Вклад американских и советских физиков был оценен по достоинству, и в 1964 г. они все стали лауреатами Нобелевской премии по физике.
 Тем временем в работах C. H. Townes появляются первые идеи создания «оптического мазера» – устройства, работающего на схожих с мазером принципах, но использующего фотоны света, а не микроволны. Эта концепция послужила импульсом к разработке американским физиком G. Gould основных принципов работы лазера. Именно в его работах впервые было использовано сокращение LASER – Light Amplification by Stimulated Emissionof Radiation, что переводится как «усиление света путем стимуляции излучения». Именно G. Gould сумел запатентовать эту технологию, обойдя C. H. Townes [2].
Тем временем в работах C. H. Townes появляются первые идеи создания «оптического мазера» – устройства, работающего на схожих с мазером принципах, но использующего фотоны света, а не микроволны. Эта концепция послужила импульсом к разработке американским физиком G. Gould основных принципов работы лазера. Именно в его работах впервые было использовано сокращение LASER – Light Amplification by Stimulated Emissionof Radiation, что переводится как «усиление света путем стимуляции излучения». Именно G. Gould сумел запатентовать эту технологию, обойдя C. H. Townes [2].
В 1960 г. группой ученых во главе с T. Maiman был создан первый работающий лазер, так называемый рубиновый лазер, в котором средой для формирования излучения служил кристалл рубина. Еще через некоторое время T. Maiman создал лазер с длиной волны 1060 нм. И в этой обновленной модели лазера в качестве активной среды использовались стеклянные стержни, легированные неодимом. Это был первый шаг на пути к созданию твердотельных неодимовых лазеров [2, 4].
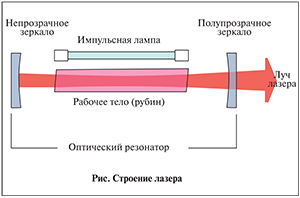
Несмотря на все многообразие существующих на сегодняшний день лазерных систем, устройство их остается практически таким же, как у лазера, созданного T. Maiman: во всех лазерах имеются три основных элемента – это источник энергии, к примеру лампа накачки (см. рисунок), активная среда лазера, в которой формируется излучение, и система зеркал.
Механизм работы любого лазера заключается в следующем: источник накачки подает энергию в систему, вызывая возбуждение атомов активного элемента, которые начинают испускать фотоны. Оптический резонатор (зеркало), окружающий активный элемент лазера, отражает вынужденное излучение, что ведет к возбуждению еще большего числа атомов и таким образом усиливает излучение. Большая часть особенностей лазерного излучения связана с активным центром, так как именно в нем формируется излучение. Для каждого вещества характерна определенная длина волны, которой обладает луч, сформированный на ее основе.
В конце 1961 г. исследователи из компании «Bell» A. Javan, W. Bennett и D. Harriot продемонстрировали первый в мире газовый лазер, в котором активной средой являлись гелий и неон, их изобретение было настолько успешным, что применяется и по сей день [2].
Разработанный в 1964 г. аргоновый ионный лазер с длиной волны 488 нм стал первым лазером, примененным в хирургии, благодаря подходящей длине волны его излучения, которая отлично поглощалась гемоглобином. Мощность аргонового лазера лучше поддавалась контролю, а в качестве активной среды использовался газ. Уже через год после изобретения его начали использовать офтальмологи при операции по восстановлению радужной оболочки глаза [5]. Таким образом, сформировалось новое направление хирургии, а лазеры начали активно завоевывать доверие медицинского сообщества.
Все новое имеет не только плюсы, но и минусы.
И ученые не могли не задумываться о безопасности лазерного излучения. С одной стороны, тепловое излучение, распространяясь по тканям, не только достигало видимых глазом тканей, но и проникало значительно глубже, вызывая коагуляционный некроз тканей в глубине.
А с другой стороны, происходило не всегда желательное разрушение тканей. Однако и это качество заинтересовало исследователей, заставив задуматься о возможности разрушать при необходимости глубокие слои тканей [2]. Понимание основных принципов передачи лазерной энергии позволило хирургам и физикам создавать лазеры с различной длиной волны, а следовательно, с различной глубиной проникновения в ткани и различной мощностью.
Гольмиевая лазерная энуклеация простаты
Из созданных за прошедшие 50 лет лазерных систем какие-то не прошли проверку временем, уступив место более современным, а какие-то, напротив, изменили подход к проведению трансуретральных пособий, как, например, гольмиевый лазер.
Взяв за основу разработки лазеров для литотрипсии, ученые из компании «Coherent Inc.» в 1980-х гг. разработали первый гольмиевый лазер для применения в эндохирургии [6, 7]. А ученые одного из крупнейших научных центров мира – Центра фотомедицины Веллмана при Общеклинической больнице штата Массачусетс (США) – стали одними из первых, кто изучил и описал влияние гольмиевого лазера на ткани [8, 9]. Среди них был доктор S. Dretler, изучавший применение лазеров при контактной литотрипсии [10]. И доктор J. Kabalin из Стэндфордского университета одним из первых провел опыты с целью определения влияния гольмиевого лазера на ткани предстательной железы животных. Благодаря этим работам мы знаем об особенностях воздействия гольмиевого лазера на ткани, а также об основных свойствах луча, формируемого на основе кристалла Ho:YAG [11–14].
Кристаллической матрицей для гольмиевого лазера служит алюмоиттриевый гранат (YAG). Излучение гольмиевого лазера практически полностью поглощается поверхностными тканями в связи с сильным поглощением водой при длине волны около 2140 нм. При этой длине волны излучения глубина проникновения в ткани составляет около 400 мкм. Первопроходцами в применении гольмиевого лазера стали новозеландские ученые P. Gilling и M. Fraundorfer из госпиталя г. Тауранги. В 1995 г. они выполнили первую комбинированную эндоскопическую лазерную абляцию простаты, или CELAP (Combined Endoscopic Laser Ablation of the Prostate). Особенность операции заключалась в том, что гиперплазированную ткань отсекали неодимовым лазером, после чего гольмиевым лазером обрабатывали чувствительные к манипуляциям шейку мочевого пузыря и ложе простаты [15]. Было установлено, что гольмиевый лазер не только безопасен, но и практически не влияет на ткани, лежащие глубже видимой границы воздействия. В связи с этим в дальнейшем было решено проводить операции исключительно с использованием гольмиевого лазера.
Следующим шагом для группы доктора P. Gilling стал метод HoLAP (Holmium Laser Ablation of the Prostate), т.е. гольмиевая лазерная абляция простаты – фактически испарение простатической ткани лазером. Впервые HoLAP была выполнена в 1994 г. с помощью 60-ваттного гольмиевого лазера [15]. В послеоперационном периоде авторы отметили двукратное улучшение балльной оценки по опроснику I-PSS, значительное увеличение максимальной скорости потока мочи (Qmax) [15].
В 1996 г. исследовательской группой под руководством доктора P. Gilling была описана методика HoLRP (Holmium Laser Resection of the Prostate), т.е. гольмиевая лазерная резекция простаты. С помощью лазерного луча ткань аденомы срезалась небольшими частями, что делало методику схожей с трансуретральной резекцией (ТУР) предстательной железы [15, 16]. Сама методика, несмотря на уменьшение частоты кровотечений в послеоперационном периоде, а также на значительное сокращение периода послеоперационной катетеризации, значительно проигрывала ТУР в длительности операции. Так, среднее время резекции при HoLRP было почти вдвое больше, чем при стандартной монополярной резекции, – 42,1 против 25,8 мин (р<0,005) [15].
Функциональные результаты гольмиевой резекции также не уступали стандартной монополярной ТУР, но популярность этого метода лечения значительно снизилась после появления новой технологи – морцелляции. Она впервые была применена в 1996 г. в США и использовалась гинекологами для удаления объемных соединительнотканных образований из брюшной полости. Благодаря возможности удаления значительных объемов ткани трансуретрально исчезла необходимость разрезать аденому или испарять ее. Принимая во внимание этот факт, группа новозеландских ученых во главе с доктором P. Gilling решила попытаться удалить узлы гиперплазии, не измельчая их лазером [17].
Операция HoLEP основана на том же физическом принципе, что и HoLRP. Гольмиевая энуклеация представляет собой эндоскопический эквивалент открытой аденомэктомии, при которой вылущивание железы осуществляется с помощью пальца. Несмотря на схожесть с этой знакомой каждому урологу техникой, энуклеация является наиболее сложной и продвинутой техникой лазерной хирургии предстательной железы. Особенность гольмиевой энуклеации заключена в возможности ее выполнения на крупных железах (объемом более 80 см3), что безусловно выделяет ее на фоне других методик трансуретрального удаления гиперплазии предстательной железы.
С 2013 по 2015 г. на базе НИИ уронефрологии и репродуктивного здоровья Первого МГМУ им. И. М. Сеченова нами было проведено 459 операций гольмиевой энуклеации. Средний возраст пациентов составил 67,4 года, средний объем предстательной железы – 122,4 (50–260) см3.
В своей работе мы использовали резектоскоп № 26 Ch с постоянной ирригацией, обеспечивающей низкое давление ирригационной жидкости (типа Iglesias), рабочий элемент с каналом для проведения лазерного волокна, а также лазерную установку мощностью 100 Вт с длиной волны 2,1 нм и лазерное волокно с концевым свечением Slim LineTM 550 мкм.
Мы имеем опыт использования лазера мощностью 60 Вт, однако снижение мощности существенно сказывается на продолжительности операции. Удаление аденоматозной ткани проводили с помощью ригидного нефроскопа (диаметр рабочего канала – 5 мм) и морцеллятора. В его состав входят вращающиеся ножи-тубусы (два 5-миллиметровых полых вращающихся лезвия) и рабочая часть. Рабочая часть оборудована электродвигателем, подающим энергию во все приспособления и создающим разряжение в тубусе морцеллятора. Благодаря этому разряжению засасывается вся удаленная ткань, а блок управления поддерживает необходимую скорость вращения ножей на протяжении всей операции [18, 19].
Полученные нами данные показали высокую эффективность гольмиевой лазерной энуклеации в устранении симптомов нижних мочевых путей (СНМП), вызванных обструкцией вследствие ДГПЖ. Средняя длительность энуклеации составила 91,2±32,5 мин, морцелляции – 45,4±18,9 мин. Балльная оценка по опроснику I-PSS до операции в среднем составила 19,3±4,4, через 3 мес после операции – 6,1±1,8; индекс качества жизни (QoL) – 4,1±0,5 и 1,8±0,6 соответственно, Qmax – 5,6±1,0 и 20,5±2,8 мл/с, объема остаточной мочи – 69,1±33,5 и 9,1±9,8 мл соответственно.
Продолжительность дренирования мочевого пузыря уретральным катетером составила в среднем 24 ч, длительность пребывания в стационаре – 3 дня.
Послеоперационное кровотечение возникло у пяти пациентов; переливание крови или ее компонентов не было выполнено ни в одном из этих случаев. Трое из этих пациентов находились на терапии антиагрегантами.
Кратковременное (до 3 мес) стрессовое недержание мочи отмечено у 38 (8,2%) пациентов.
Гольмиевый лазер стал незаменимым инструментом для врачей всего мира, а гольмиевая лазерная энуклеация является не только наиболее изученной, но и фактически доминирующей (в Европе) методикой лазерного лечения СНМП, вызванных ДГПЖ [20]. Однако не так давно был представлен новый метод лазерной энуклеации – тулиевая энуклеация, которая уже начинает завоевывать популярность в мире.
Тулиевая энуклеация
Применение в урологии лазеров на основе тулия – наиболее современная лазерная технология. На медицинском рынке представлено два вида тулиевых лазеров: на основе кристалла YAG (иттрийалюминиевого граната) с длиной волны 2010 нм и волоконный лазер (лазер на Tm-активированном волокне) с длиной волны 1940 нм [21]. Эти лазерные устройства идентичны по показателям эффективности [22–24].
В отличие от ламповой накачки гольмиевого лазера в лазере на Tm-активированном волокне используется накачка лазерными диодами [25], что позволяет повышать результативность и надежность системы. Тулиевые волоконные лазеры могут работать как в непрерывном, так и в импульсном режиме, а гольмиевые лазеры – только в импульсном режиме. Кроме того, длина волны лазера на Tm-doped fiber, несмотря на близость к длине волны гольмиевого лазера, составляющей 2100 нм, все же отличается от нее, находясь значительно ближе к локальному пику поглощения воды. Именно длина волны и параметры импульсного излучения обусловливают основные отличия лазера на Tm-активированном волокне от гольмиевого лазера [20].
С августа 2016 г. началось активное применение тулиевой лазерной энуклеации в стенах клиники урологии Первого МГМУ им. И. М. Сеченова благодаря последней разработке компанией НТО ИРЭ-ПОЛЮС первого российского двухволнового аппарата «Уролаз» на основе лазеров на Tm-активированном волокне с длиной волны 1940 нм и мощностью 120 Вт (для абляции мягких тканей и дробления камней) и Er (эрбий)-активированном волокне с длиной волны 1550 нм и мощностью 15 Вт (для гемостаза). Лазерная установка способна работать как в непрерывном, так и в импульсном режиме с максимальной энергией до 8 Дж.
В нашем исследовании мы применили лазерное волокно с диаметром светонесущей жилы 600 мкм. Операции были выполнены при средней мощности лазерного излучения 60 Вт. При работе в зоне сфинктера с целью профилактики недержания мочи в послеоперационном периоде мощность лазера снижалась до 30 Вт. Все операции были выполнены при энергии в импульсе лазерного излучения 1,5 Дж. Остальное оснащение при выполнении операции было идентично вышеописанному оснащению при гольмиевой операции. Использование нами лазера на Tm-активированном волокне (лазер на Tm-doped fiber) обусловлено следующими моментами.
Во-первых, пульсирующий характер излучения гольмиевого лазера ведет к формированию пузырьков испаренной жидкости с каждой вспышкой лазерного луча. Эти пузырьки могут смещать и даже разрывать ткани, что известно как «эффект ретропульсии» (retropulsio; ретро-+лат. pello, pulsum толкать). В то же время постоянно генерируемая волна лазера на Tm-активированном волокне позволяет плавно иссекать ткани и испарять их, что положительно сказывается на гемостатических свойствах лазера [26].
Во-вторых, длина волны, соответствующая пику поглощения воды, обеспечивает меньшую глубину проникновения в ткани (250 мкм), что почти в 1,6 раза меньше по сравнению с гольмиевым лазером (400 мкм) [20, 24]. Это не только гарантирует малую глубину проникновения, но и сопровождается быстрой вапоризацией из-за высокой плотности передаваемой тканям энергии. Более того, становится возможным с большей легкостью корректировать слой энуклеации практически на любом этапе операции, тем самым формируя единое плато вдоль хирургической капсулы [23]. Гольмиевый лазер не позволял нам с подобной легкостью перемещаться между слоями.
В-третьих, эффективность и контролируемость тулиевого лазера в мягких тканях выше, чем у гольмиевого аналога. Это связано как с отсутствием эффекта ретропульсии, так и с меньшей глубиной проникновения излучения в ткани. Эта особенность лазера на Tm-активированном волокне дает возможность проводить более точные и безопасные инцизии [20].
Эволюция хирургических методов лечения предстательной железы с помощью тулиевого лазера практически повторяла последовательность событий в развитии хирургии с помощью гольмиевого лазера. В 2008 г. группой немецких врачей под руководством проф. T. Bach была предложена методика тулиевой вапоэнуклеации [28].
В дальнейшем этот метод был усовершенствован доктором T. R. Herrmann с коллегами [29] и описана методика ThuLEP – тулиевая лазерная энуклеация простаты. Стоит отметить, что данная операция позволяет добиваться значительного улучшения функциональных показателей, сходного с таковым при классической трансуретральной резекции и при HoLEP.
На сегодняшний день нами выполнено 46 тулиевых энуклеаций гиперплазии простаты. Средний возраст пациентов составил 66,8 (54–83) года, средний объем предстательной железы – 87,2±31,9 (60–150) см3. Исходный балл по опроснику I-PSS составил 23,2±2,2, QoL – 4,8±0,8, Qmax – 7,6±2,4 мл/с, объем остаточной мочи – 80,5±30,6 мл.
Продолжительность операции в целом составила 79,6±29,4 мин, при этом этап энуклеации в среднем длился 46,3±14,7 мин, этап морцелляции – 33,6±19,5 мин; средняя масса удаленной ткани составила 73,8±26,4 г. Длительность нахождения катетера в среднем составила 24 ч, послеоперационный койко-день – 3–4 дня. В ближайшем послеоперационном периоде имел место один эпизод кровотечения, не потребовавший переливания крови.
Несмотря на то что пока мы имеем лишь первые данные краткосрочных наблюдений, функциональные результаты через 1 мес после операции показали значительное улучшение. Так, балл по опроснику I-PSS составил 8,8±3,9, по шкале QoL – 1,8±1,1; максимальная скорость потока мочи Qmax выросла до 23,2±10,3 мл/с, а объем остаточной мочи уменьшился до 18,5±27,0 мл. Частота кратковременного недержания мочи составила 13 %, и несмотря на отсутствие данных наблюдения через 3 мес, имеющийся у нас опыт позволяет расценивать данное явление как кратковременное (продолжительностью не более 3 мес).
Полученные нами данные об эффективности тулиевого лазера подтверждаются работами европейских ученых [29–31]. Несмотря на малочисленность исследований, посвященных тулиевому лазеру, в них отмечается, что ThuLEP позволяет добиваться значительного улучшения таких функциональных показателей, как балл по I-PSS, Qmax, а также снижения объема остаточной мочи.
Эндоскопическая энуклеация простаты
Гольмиевая лазерная энуклеация на сегодняшний день является наиболее изученной из лазерных методик.
И именно благодаря высокой эффективности HoLEP эндоскопическая энуклеация предстательной железы стала популярной и широко распространенной техникой удаления ДГПЖ. Методы энуклеации показывают крайне высокую эффективность в лечении СНМП, вызванных обструкцией вследствие ДГПЖ, что было доказано в многочисленных исследованиях. Этот факт позволил Европейской ассоциации урологов (ЕАУ) ввести новый термин: эндоскопическая энуклеация простаты (ЭЭП) [32, 33], который включает все энуклеирующие методики, подходящие под понятие «анатомическая энуклеация». Более того, изменению подверглись рекомендации по удалению гиперплазии предстательной железы объемом более 80 см3. Если раньше гольмиевая энуклеация предстательной железы считалась лишь альтернативой открытой аденомэктомии, то на сегодняшний день ЭЭП признана методом лечения гиперплазии простаты (при объеме предстательной железы более 80 см3) наравне с открытой операцией. Было доказано, что методики энуклеации превосходят открытую операцию по всем показателям – I-PSS, Qmax, длительность катетеризации и госпитализации, количество осложнений, стриктур и кровотечений, объем кровопотери, частота развития острой задержки мочи [26, 33–37].
Методика тулиевой энуклеации, появившаяся относительно недавно, уже сумела доказать свою высокую эффективность. Как и гольмиевая энуклеация, ThuLEP позволяет избегать возникновения такого грозного осложнения, как ТУР-синдром. По данным сравнительного анализа результатов ТУР и тулиевой энуклеации установлено, что ThuLEP сопровождается меньшей кровопотерей. Частота гемотрансфузий после ThuLEP не превысила 2,2%, в то время как после проведения ТУР в переливании крови нуждались 9,5% пациентов, при этом ТУР-синдром возник у 2,1% пациентов [38]. Частота задержки мочеиспускания в связи с обструкцией мочевых путей сгустками варьировалась от 0 до 2,7% [38]. Ряд исследователей отмечает, что тулиевые лазеры могут быть использованы у пациентов, принимающих антикоагулянты, подобно гольмиевому лазеру, который характеризуется менее выраженными коагулирующими свойствами из-за импульсного режима работы [20]; в этих случаях частота обструкции нижних мочевых путей сгустками не превышала 6,8% [31], что практически в два раза меньше, чем у пациентов, перенесших ТУР. Частота возникновения недержания мочи в послеоперационном периоде колебалась от 6,7 до 18%, однако во всех случаях данное осложнение было кратковременным. Через 6 мес ни один пациент не отмечал недержания мочи. Стриктуры шейки мочевого пузыря констатировали с частотой от 0 до 5,6% [31]. Средняя длительность катетеризации составила 2,1–2,4 дня, в то время как срок госпитализации в большинстве исследований не превышала 3 дней [39].
В исследовании, посвященном сравнению эффективности HoLEP и ThuLEP, было установлено, что применение тулиевого лазера сопровождается меньшей кровопотерей (в среднем 130 против 166,6 мл при использовании гольмиевого лазера). При этом длительность периодов госпитализации и катетеризации была одинаковой [38].
Два исследования, проведенных с целью сравнения скорости обучаемости, показали, что для достижения достаточно высокого уровня профессионализма в выполнении гольмиевой энуклеации необходимо сделать не менее 40 операций [40, 41]. Для тулиевой энуклеации эта цифра в среднем была на 10–15 меньше. Это, по мнению авторов, связано с более высокой вапоризирующей способностью тулиевого лазера, позволяющей проводить операцию с большей эффективностью [41].
Также была показана эффективность тулиевой энуклеации для пациентов с объемом предстательной железы более 80 см3, принимающих антикоагулянты [23, 42].
Существенно, что после перенесенной операции случаев вновь возникшей эректильной дисфункции не наблюдалось: в большинстве наблюдений эректильная функция не изменялась, изредка отмечалось ее улучшение, в единичных случаях – незначительное ухудшение [43].
Клиническая эффективность процедуры ThuLEP по сравнению с HoLEP изучалась в нескольких нерандомизированных перспективных исследованиях. По их итогам было отмечено стойкое улучшение клинических симптомов на протяжении 18-месячного периода наблюдений в обеих группах [31, 38]. При этом кровопотеря в группе пациентов, оперированных при помощи тулиевого лазера, была меньше, чем в группе, оперированной по методике HoLEP [38].
Методики лазерной энуклеации являются одними из новейших и наиболее эффективными способами лечения симптомов нижних мочевых путей, вызванных обструкцией вследствие ДГПЖ. Гольмиевая энуклеация простаты заняла лидирующие позиции среди методик лечения гиперплазии простаты, что было подтверждено данными двух крупных мета-анализов [44, 45]. Новейшая разработка – тулиевая энуклеация уже сейчас демонстрирует сопоставимую с гольмиевой энуклеацией эффективность, что нашло отражение в последних рекомендациях ЕАУ [33]. Наша работа подтверждает эти данные и, несмотря на небольшой период наблюдения, позволяет нам называть тулиевую энуклеацию новой важной ступенью в череде эндоскопических лазерных технологий.



