Простатит является широко распространенным заболеванием, с которым на протяжении жизни сталкиваются 35–50% всех мужчин [1]. Несмотря на высокую распространенность, ни у врачей, ни у пациентов нет полного понимания, что представляет данное заболевание. Причина прежде всего в том, что в соответствии с критериями Американского Национального института здравоохранения (NIH, США), которые до сих пор широко используются урологами [2], данное понятие объединяет четыре различных заболевания, зачастую не имеющих даже общих симптомов. Термин «простатит» подразумевает наличие воспаления в предстательной железе, но не у всех пациентов с тем или иным типом простатита наблюдаются воспалительные процессы в предстательной железе. Даже среди пациентов с диагнозом «синдром хронической тазовой боли» (СХТБ) лишь у трети при биопсии обнаруживается воспаление простаты [3]. Часто СХТБ связывают с наличием абактериального простатита категории III, который разделяют на хронический простатит/СХТБ с признаками воспаления (категория IIIa) и хронический простатит/СХТБ без признаков воспаления (категория IIIb), при котором отсутствуют медиаторы воспаления в секрете предстательной железы [4].
Синдром хронической тазовой боли характеризуется постоянной или рецидивирующей болью в тазу, сопровождающейся болями генитального происхождения, болями при эякуляции, абдоминальными болями, симптомами нижних половых путей, эректильной дисфункцией [4], и сложно поддается лечению [5]. Тяжесть симптомов при простатите категорий IIIа, IIIb может отличаться на начальном уровне. Так, пациенты с заболеванием категории IIIа имеют более выраженную клиническую картину. Данные категории хронического простатита могут рассматриваться как стадии одного и того же заболевания, при котором категория IIIb является поздней стадией процесса, хуже отвечающей на лечение [6].
Необходимо отметить, что на СХТБ приходится 90% всех случаев простатита [7]. В целом распространенность СХТБ среди всего мужского населения составляет от 4,5 до 9% и не зависит от возраста (но наибольшее число случаев приходится на возраст 36–50 лет) и демографических особенностей, хотя возможны и некоторые колебания в тяжести симптомов и распространенности СХТБ [8].
Синдром хронической тазовой боли проявляется множеством клинических симптомов, связанных с поражением одного или нескольких органов, но ведущим симптомом при этом остается боль, обусловленная различными причинами и механизмами [9]. Боль может быть ассоциирована с негативными когнитивными, поведенческими, сексуальными или эмоциональными факторами, с симптомами нижних мочевых путей и сексуальными дисфункциями [10]. Клиническая картина СХТБ имеет сходство с таковой инфекционного простатита [11]. Часто также отмечается так называемое перекрывание симптомов [2] в случаях наличия коморбидных заболеваний [12], что препятствует выявлению истинных причин болезни [13].
Этиология и патогенез СХТБ
Исследования последних лет выявили связь развития СХТБ с различными факторами, в том числе с образом жизни, что представляется довольно спорным утверждением, поскольку образ жизни в различных странах различается [14]. На течение заболевания может также влиять то или иное время года. В летнее время наблюдается снижение частоты сильных болевых атак, в то время как в зимнее время выраженность боли значительно возрастает [15].
Течения CХТБ определяется в том числе и характером питания. Так, 43,5% опрошенных пациентов с СХТБ показали, что имеют определенную чувствительность к тем или иным продуктам. Чаще всего при СХТБ ухудшение состояния вызывали прием острой пищи, кофе, чая и особенно алкоголя [16]. Метаболит этанола ацетальдегид вызывает вазодилатацию и усиливает воспаление при СХТБ [17].
Несбалансированное питание может также усугубить течение СХТБ. Так, мясной рацион на фоне недостатка целлюлозы служит причиной развития запоров. Хронические запоры ведут к спазму мускулатуры таза, в результате чего возникают тазовые боли [17]. Мясной рацион также характеризуется высокой калорийностью, что негативно влияет на простату [18].
Отсутствие половой жизни и чрезмерная половая активность считаются фактором риска развития СХТБ. Сидячий образ жизни также провоцирует развитие СХТБ и усиливает болевые ощущения [17], в то время как подвижный образ жизни, напротив, рассматривается в качестве положительного фактора при СХТБ, способствующего ослаблению клинических проявлений заболевания [18].
Симптомы СХТБ исторически и по сей день связывают с наличием инфекционного возбудителя [19], несмотря на то что СХТБ имеет принципиальное отличие от прочих типов простатита, а именно, меньшую степень связи болевого синдрома с наличием бактерий в предстательной железе [4]. Кроме того, у пациентов с СХТБ отсутствует связь между выраженностью воспаления в предстательной железе и интенсивностью симптомов заболевания [3].
Несмотря на то что наличие инфекционного процесса и не является обязательным при СХТБ, у пациентов данной группы часто диагностируют уретриты, которые могут стать причиной дальнейшего воспаления и привести к развитию СХТБ [5]. Бактериологический анализ биоматериала пациентов с СХТБ и пациентов без симптомов нижних мочевых путей выявил практически одинаковое содержание бактерий в моче и соке предстательной железы. Восемь процентов мужчин имели уропатогенные микроорганизмы, и примерно 70% обследованных имели различные формы бактерий в каждой группе, что позволило заключить, что присутствие инфекционного агента не всегда связано с развитием заболевания и определенной симптоматикой [20]. Показано, что бактерии, приводящие к развитию СХТБ, имеют фенотипические различия с таковыми, присутствующими в органе и не вызывающими развития данного заболевания [21]. У больных СХТБ в простате обнаруживали кишечную палочку, клебсиеллу, энтеробактерии, энтерококки, стафилококки, стрептококки, хламидии, микоплазмы [20]. В последнее время у большинства пациентов в СХТБ выявляют Burkholderia cenocepacia [22]. Интересным является факт, что у 76% больных СХТБ в крови найдены антитела к H. pylori [23]. Нанобактерии также рассматриваются в качестве возможных источников инфекции при СХТБ [24]. Подтверждено, что наличие микрофлоры в ряде случаев утяжеляет течение СХТБ [12]. Так, у больных СХТБ с диагностированным хламидиозом отмечается повышение числа лейкоцитов и усиление болевых ощущений по сравнению с пациентами, страдающими только СХТБ [25]. Кроме того, из секрета простаты пациентов с СХТБ был выделен ряд вирусов, например цитомегаловирус, вирус папилломы человека и вирус герпеса 2-го типа. Отмечена связь между наличием вируса папилломы человека и выраженностью воспаления простаты [26].
Масса исследований подтверждает роль адаптивного иммунного ответа и аутоиммунной реакции в развитии СХТБ.
У пациентов с СХТБ в спермальной плазме наблюдается повышение содержания ряда интерлейкинов (IL): IL-1, IL-1β, IL-6, IL-8 и ФНО-α, но не IL-17 [27], что указывает на воспалительный процесс в простате и семенных протоках [28]. Необходимо отметить, что состав цитокинов при СХТБ категорий IIIa и IIIb в секрете предстательной железы различается. Повышение уровня IL-1β, IL-8 и ФНО-α обнаружено при категории IIIa, но не при IIIb [28]. При СХТБ имеет место повышение содержания триптаз тучных клеток и Т-клеточного ответа в спермальной плазме по сравнению с контролем. Кроме того, у пациентов с СХТБ наблюдается увеличение лимфопролиферативного ответа на антигены простаты [29].
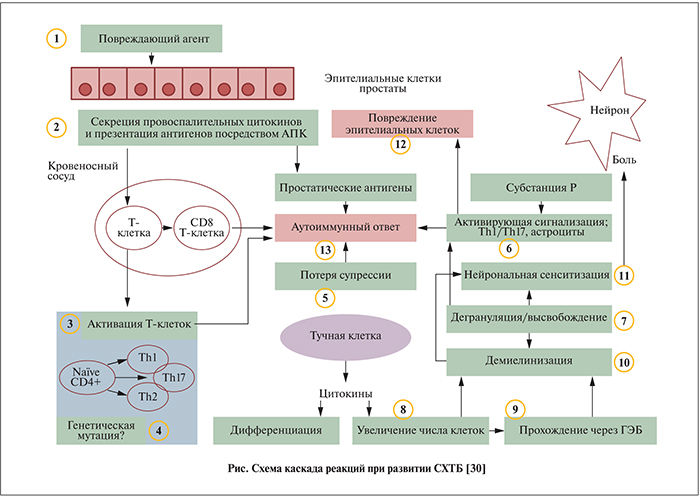
Схематически развитие СХТБ [30] может быть представлено следующим образом (см. рисунок). Травма или бактериальная инфекция повреждает эпителиальные клетки простаты (1), что приводит к секреции и активации провоспалительных цитокинов, хемокинов и презентации антигенов посредством антигенпрезентирующих клеток (АПК) (2). В результате каскада сигнальных реакций происходит активация CD4+-Т-клеток, а именно Th1, продуцирующих интерферон γ. На более поздних стадиях наблюдается активация Th17 (3), которой предшествует снижение количества регуляторных супрессорных Т-клеток, секретирующих IL-10, и сдвиг в сторону Th1/17-ответов (4). Прекращение подавления тучных клеток вследствие активации Т-клеток запускает механизм обратной положительной связи в тучной клетке (5, 6), в результате чего происходит дегрануляция и высвобождение протеаз (например, триптаз и химаз), медиаторов аллергических реакций (например, гистамин [7]) и секреция цитокинов (IL-6, ФНО-α); в итоге увеличивается число клеток воспаления (8), возрастает проницаемость гематоэнцефалического барьера (9) и наблюдается демиелинизация нейронов (10). Все указанные процессы приводят к нейрональной активации и сенситизации (11). Тучные клетки выступают посредником в данном процессе, а обратная положительная связь усиливает каскад реакций. Повреждение эпителиальных клеток является следствием повышенной активности тучных клеток (12). Антигены простаты в присутствии активированных CD4+-Т-клеток, на фоне дегрануляции тучных клеток и повышения числа CD8+-T-клеток могут быть причиной аутоиммунного ответа (13).
В последнее время в научной литературе все большее внимание уделяется неврологическим аспектам и роли патологии нервной системы в развитии СХТБ. В качестве одного из маркеров развития СХТБ рассматривается фактор роста нервов (NGF) – нейропептид, участвующий в ноцицепции. Было отмечено, что уровень NGF понижен у мужчин с СХТБ, отвечающих на лечение [31]. Имеются данные, согласно которым введение антител к NGF приводит к некоторому уменьшению болевых ощущений [32].
У пациентов с СХТБ выявлены изменения в вегетативной нервной системе, а именно снижение симпатической активности, что выражается в снижении показателя вариабельности сердечного ритма [33]. Кроме того, у пациентов с СХТБ в 6 раз чаще наблюдается сердечно-сосудистая патология, особенно гипертония [5]. У таких пациентов отмечаются изменение артериальной ригидности, снижение индекса реактивной гиперемии и кардиоваскулярная дисфункция [34], что может быть опосредовано как дисфункцией автономной нервной системы, так и эндотелиальной дисфункцией. При этом сама гипертония не приводит к развитию СХТБ: показано отсутствие связи между риском возникновения СХТБ и наличием у больных гипертонии и ожирения [18].
К неврологической патологии также относят нарушение функции мышц тазового дна – повышение тонуса мышц в покое и снижение амплитуды сокращения [35]. Предполагается, что хроническая невоспалительная тазовая боль может быть связана с псевдодиссинергией внутреннего сфинктера, тонической миалгией тазового дна, пудендопатией.
При СХТБ отмечены также некоторые изменения в мозговой анатомии и функциях мозга. Тазовая боль характеризуется функциональной активацией правой передней островковой зоны, причем степень активации соотносится с интенсивностью боли. Объем серого вещества у больных СХТБ не изменяется, однако плотность серого вещества, ответственных за боль в областях (передней островковой и передней поясной), положительно коррелирует с интенсивностью боли и длительностью ее персистенции. Кроме того, у больных СХТБ нарушено нормальное соотношение между анизотропией белого вещества и объемом серого вещества неокортекса [36].
Гипотеза центральной сенситизации объясняет ряд симптомов, наблюдающихся при СХТБ. Теория функционирования нервной системы говорит о том, что реакция ЦНС определяется длительностью, интенсивностью и местоположением стимула. Однако имеются данные, согласно которым сенситизация нервных волокон может наблюдаться даже после прекращения действия стимула, продолжительная нервная активность может иметь место в отсутствие стимула как такового. Одним из признаков центральной сенситизации является распространение боли на непораженные ткани. Именно это наблюдается у пациентов с СХТБ, у которых боль в одной области вызывает болевые ощущения в близлежащих органах [37].
В конце 1980-х гг. для обозначения СХТБ использовали термин «простатит стресса», тем самым подчеркивая связь симптомов СХТБ и психологического стресса. Сейчас доказана связь между развитием СХТБ и психологическими (катастрофизация боли, стресс и особенности личности), социальными аспектами [38]. Отмечено, что длительное пребывание в условиях стресса (в течение 6 мес) приводит к усилению интенсивности боли у больных СХТБ [39]. Негативный личный опыт, например насилие сексуального, физического или эмоционального характера, способствует развитию СХТБ [40]. Страх пациента заразиться инфекциями, передающимися половым путем, сопровождается усилением боли [41].
Мужчины с СХТБ часто имеют в анамнезе другие хронические заболевания с болевым синдромом, такие как синдром раздраженной толстой кишки, фибромиалгия, синдром хронической усталости [13]. Общим звеном в развитии заболеваний, характеризующихся хроническими болями, является изменение лимбико-гипоталамо-питуитарно-адреналовой оси [42], что отмечается и при СХТБ.
У больных СХТБ уровень адренокортикотропного гормона в покое был низким, но в условиях стресса отмечался его резкий рост, превышающий таковой у мужчин без болевого синдрома.
При анализе зависимости простатитподобных симптомов у пациентов с СХТБ от уровня тестостерона было отмечено, что при низком уровне тестостерона в сыворотке крови отмечается усиление симптомов заболевания [43].
Изменение уровня простатспецифического антигена (ПСА) при СХТБ не является показательным параметром. Тем не менее анализ уровня ПСА у больных СХТБ выявил некоторое повышение данного показателя [44], что может являться доказательством аутоиммунной природы заболевания. Кроме того, у пациентов отмечается усиление пролиферативного ответа CD4+-Т-лимфоцитов на ПСА [45].
Как уже было сказано выше, СХТБ характеризуется изменениями сердечно-сосудистой системы – повышением артериальной ригидности и эндотелиальной дисфункцией сосудов [34]. Оценка некоторых показателей протеолитической системы крови пациентов с СХТБ категории IIIb выявила зависимость активности протеолитической системы крови от степени повреждения эндотелия сосудов. Установлено, что нарушение эндотелий-зависимой вазодилатации сопровождается дисбалансом про- и антипротеолитических систем крови [46].
Лечение СХТБ
Поскольку до сих пор отсутствует четкое понимание этиопатогенетических механизмов развития СХТБ и показано, что помимо развития инфекционного процесса имеют место различные нарушения, затрагивающие сердечно-сосудистую, нервную, опорно-двигательную, эндокринную, иммунную системы, лечение данного синдрома служит поводом к разочарованию и врачей, и пациентов [47]. Лечение СХТБ традиционно было основано на концепте терапии «простатита», при котором акцент делали на борьбу с инфекцией и воспалением в простате. Не удивительно, что в большинстве случаев придерживались общепринятых подходов к лечению заболеваний предстательной железы, например доброкачественной гиперплазии предстательной железы (ДГПЖ). При этом в лечении использовали α-адреноблокаторы, ингибиторы 5α-редуктазы, фитопрепараты и прибегали к операционному вмешательству. Для борьбы с болью использовали НПВС, анальгетики (в том числе и наркотические), антидепрессанты. Стоит отметить, что использование ряда препаратов было клинически неоправданным и, следовательно, неэффективным. В настоящее время для лечения СХТБ также используют различные группы препаратов – антибиотики, противовоспалительные средства, нейромодуляторы, α-адреноблокаторы, причем наиболее эффективным считается комбинированное лечение [6]. Помимо фармакотерапевтического подхода прибегают к физиотерапии, массажу предстательной железы и нетрадиционным методам лечения (акупунктура) [48]. Лечение успешно сочетают с когнитивной терапией и коррекцией образа жизни [49]. Распределение по частоте использования различных видов лечения в клинической практике выглядит следующим образом: в 80,7% случаев назначается психологическая терапия, в 80,4% – медикаментозное лечение, причем α-адреноблокаторы используют 68,9% пациентов, антибиотики – 61%, образ жизни советуют скорректировать в 79,6% наблюдений [50].
Изменение пищевых привычек (отказ от продуктов и напитков, усиливающих болевые ощущения), оздоровительные тренировочные программы (за исключением упражнений высокой интенсивности или травматических для данного заболевания видов физической активности, например велосипедного спорта), местная гипертермия (грелка-подушка на промежность) положительно влияют на общее состояние больных с СХТБ [51]. Имеются данные, подтверждающие, что физическая активность снижает риск развития СХТБ у мужчин среднего возраста и старше, а спортивные тренировки облегчают болевые ощущения при СХТБ [18].
При подборе терапии СХТБ большинство врачей прибегают к назначению антибиотиков, несмотря на недостаточность клинических данных об эффективности их применения при данной патологии [20, 24]. В описанных в научной литературе исследованиях показана эффективность тетрациклина, левофлоксацина, ципрофлоксацина. В работах последних лет представлен положительный опыт использования рокситромицина в лечении хронического простатита категории IIIb, причем его эффект был сопоставим с таковым ципрофлоксацина и ацеклофенака [52]. Исследование in vitro выявило, что на фоне введения ципрофлоксацина в эндотелиальных клетках человека отмечается снижение содержания IL-6 и IL-8 [53]. Для левофлоксацина также была доказана способность снижать пролиферативную активность мононуклеарных клеток крови [54]. Возможно, именно этим объясняется эффективность антибиотиков для пациентов, у которых не было выявлено инфекционных возбудителей [55].
Блокаторы α-адреноблокаторов (альфузозин, доксазозин, тамсулозин, теразозин) широко используются для лечения симптомов нижних мочевых путей у пациентов с ДГПЖ и СХТБ [49]. Альфа-адреноблокаторы расслабляют гладкие мышцы предстательной железы, уретры, шейки мочевого пузыря, в результате чего уменьшается выраженность обструкции и отмечается усиление тока мочи. Эффект α-адренергической блокады при симптомах нижних мочевых путей также может быть связан с ингибированием нейрогенного воспалительного ответа. Механизм, благодаря которому α-адреноблокаторы способствуют уменьшению болевых ощущений у пациентов с СХТБ, не известен. Очевидно, это обусловлено улучшением функции мочеиспускания, т.е. опорожнением мочевого пузыря, при блокировании α-адренорецепторов в периферической и центральной нервной системе [56].
Хотя при приеме препаратов данной группы и отмечается снижение болевого синдрома и улучшение качества жизни больных СХТБ, эффект от α-адреноблокаторов достаточно умеренный. Препараты данной группы не рекомендуют назначать пациентам в отсутствие проблем с мочеиспусканием [57]. Крайне важно учитывать побочные действия α-адреноблокаторов при назначении пациентам молодого возраста, особенно их влияние на эякуляцию (возможно развитие ретроградной эякуляции). У альфузозина данное побочное действие выражено меньше, чем у тамсулозина [58].
Нестероидные противовоспалительные средства уменьшают местное воспаление в предстательной железе. Однако обезболивающая активность препаратов данной группы является относительно невысокой, этим и объясняется умеренное снижение балла по шкале NIH-CPSI. По той же причине их комбинируют с антибиотиками и α-адреноблокаторами [59].
На фоне приема ингибиторов циклооксигеназы (ЦОГ) отмечается увеличение продукции простагландинов, что способствует ослаблению боли. Была показана умеренная эффективность рофекоксиба, селективного блокатора ЦОГ2, в лечении СХТБ. Несмотря на умеренную эффективность, на фоне приема препарата больные отмечали значительное улучшение качества жизни [20]. Прием другого селективного ингибитора ЦОГ2, целекоксиба, приводил к уменьшению выраженности симптомов хронического простатита, но при отмене препарата эффект исчезал [60]. Даже при пероральном приеме преднизолона у больных СХТБ не наблюдалось заметного улучшения состояния [61].
В научной литературе описан опыт применения ряда антидепрессантов (амитриптилин, сертралин, дулоксетин, циталопрам) в лечении урологических хронических болевых синдромов. Данные препараты характеризуются хорошей переносимостью и умеренным эффектом. На фоне приема сертралина, циталопрама отмечалась лишь тенденция к уменьшению выраженности боли. Данные препараты могут быть рекомендованы для лечения нетяжелых форм заболевания [62]. Включение дулоксетина в схему лечения СХТБ тамсулозином и экстрактом Serenoa repens способствовало усилению эффекта от терапии, а именно к улучшению показателей по шкале NIH-CPSI, по сравнению с группой, которой дулоксетин не назначался [63]. Флуоксетин продемонстрировал хороший клинический результат у пациентов с тяжелой формой СХТБ, не поддающейся лечению стандартными препаратами, и характеризовался высоким профилем безопасности [64].
Применение ингибитора 5α-редуктазы финастерида в лечении больных СХТБ основано на его способности снижать инфравезикальную обструкцию и внутрипростатический рефлюкс за счет уменьшения размеров простаты.
В ряде исследований показана эффективность финастерида в лечении СХТБ, превосходящая таковую Serenoa repens [65]. На фоне приема финастерида больными СХТБ категории IIIa отмечается заметное улучшение их состояния и снижение выраженности основных симптомов заболевания. Несмотря на полученные данные, препарат не может быть рекомендован в качестве монотерапии для лечения СХТБ, за исключением пациентов, имеющих также в анамнезе ДГПЖ [66].
На фоне приема полусинтетического мукополисахарида пентосана полисульфата пациентами с СХТБ была отмечена тенденция к улучшению основных показателей, характеризующих заболевание (балл NIH-CPSI). Считается, что эффект пентосана полисульфата обусловлен его противовоспалительной активностью [67].
В настоящее время для лечения СХТБ используют фитопрепараты, например экстракт пыльцы растений (цернилтон), кверцетин, экстракт Serenoa repens [68]. В клинических исследованиях была доказана эффективность цернилтона в лечении СХТБ, причем она была сопоставимой с таковой эвипростата, фитотерапевтического препарата, широко используемого в лечении ДГПЖ [69]. Биофлаваноиды рассматриваются в качестве альтернативных антибиотикам в случае отсутствия инфекции в предстательной железе [70]. Имеются данные о том, что в основе действия указанных препаратов лежит способность подавлять иммунологические реакции в тканях предстательной железы, семенной жидкости и плазме крови пациентов с СХТБ [71].
Имеются также результаты клинических исследований, подтверждающих эффективность такого микроэлемента, как цинк, в лечении хронического простатита [72]. Необходимо отметить, что при данном заболевании отмечается снижение концентрации цинка в предстательной железе [73], который на клеточном уровне вовлечен в процессы пролиферации, дифференцировки и апоптоза [74]. Цинк обладает противовоспалительной и антиоксидантной активностью [75]. Ионы цинка обусловливают ферментативную активность ПСА, направленную на поддержание вязкости секрета простаты и регуляцию факторов роста в тканях железы [76]. Указанный факторы делают цинк незаменимым микроэлементом в функционировании предстательной железы.
Использование токсина ботулизма при СХТБ является новым подходом к лечению данного заболевания. Терапевтический эффект токсина обусловлен расслабляющим действием на мышцы и анальгетическим эффектом в условиях хронического воспаления. Механизм анальгетического действия заключается в уменьшении числа ваниллоидных TRPV1 и пуринергических Р2Х3-рецепторов, стимулирование которых вызывает гипералгезию [77].
В клинических исследованиях была подтверждена эффективность токсина ботулизма в лечении заболеваний таза, сопровождающихся болью [78].
Исторически сложилось, что основным методом физиотерапии больных простатитом, включая СХТБ, является массаж простаты. Однако до сих пор не существует объективных данных, доказывающих его эффективность. Согласно данным литературы, эффективность этого метода не очень высока и он рекомендован как дополнительный способ лечения ограниченного числа пациентов [79].
В терапии СХТБ прибегают также к использованию гипертермии предстательной железы, физиотерапевтическому массажу, инъекциям анестетиков, акупунктуре, электронейрональной модуляции, расслабляющим упражнениям (например, йога), гипнозу. Эффективность всех указанных методов требует доказательств и дальнейших исследований [80].
В последние годы в клинической практике используются препараты нового класса, содержащие релиз-активные антитела, которые оказывают значимый терапевтический эффект и характеризуются практически полным отсутствием нежелательных лекарственных явлений [81]. Препараты данного класса давно используются в урологической практике и уже хорошо себя зарекомендовали. Так, препарат импаза, содержащий аффинно очищенные антитела к эндотелиальной NO-синтазе (АТ к eNOS), в релиз-активной форме применяется для лечения эректильной дисфункции. Препарат афала, содержащий аффинно очищенные антитела к простатспецифическому антигену (АТ к ПСА) в релиз-активной форме, используется в лечении ДГПЖ и хронического простатита [82].
Поскольку эректильная дисфункция часто развивается на фоне заболеваний предстательной железы, в том числе CХТБ [83], и терапия данных заболеваний в большинстве случаев предполагает комплексный подход, был разработан комбинированный препарат афалаза, содержащий и АТ к eNOS, и АТ к ПСА, воздействующих на различные биохимические механизмы. Так, АТ к eNOS влияют на eNOS, под действием которой образуется оксид азота (NO) – один из важнейших медиаторов внутриклеточного и межклеточного взаимодействия в организме. Нарушение продукции NO является главным звеном патогенеза не только эректильной дисфункции, но и эндотелиальной дисфункции в целом [84]. Антитела к ПСА обладают антипролиферативной и противовоспалительной активностью в условиях ДГПЖ и хронического простатита, причем противовоспалительный эффект препарата обусловлен также повышением концентрации ионов цинка в предстательной железе [82]. РА АТ eNOS за счет эндотелийпротективного действия и усиления кровотока повышают антипролиферативную и противовоспалительную активность РА АТ ПСА (РА – релизактивность; АТ – антитела).
В клинических исследованиях была доказана эффективность данной комбинации в лечении пациентов с ДГПЖ и эректильной дисфункцией. При этом отмечалось уменьшение выраженности симптомов заболевания, повышение качества жизни больных, уменьшение объема остаточной мочи, улучшение эректильной функции и мочеиспускания [85], появление кровотока в ранее «немых» зонах в предстательной железе [86], что подтверждает восстановление секреторной функции органа.
При лечении СХТБ прием комбинации АТ к eNOS и АТ к ПСА на фоне стандартной терапии приводит к значимому снижению болевой и дизурической симптоматики, улучшению эректильной функции [87]. Причем препарат характеризуется высоким профилем безопасности.
Таким образом, отсутствие на сегодняшний день четких представлений об этиологии и патогенезе СХТБ обусловливает проведение лечения, направленного на устранение клинической симптоматики, и подчеркивает необходимость комплексного подхода к терапии данного заболевания. Именно комплексная терапия позволяет задействовать различные патогенетические механизмы развития СХТБ и тем самым добиваться наилучшего результата.
Крайне важно учитывать соотношение польза/риск от использования того или иного препарата, поскольку эффективность ряда лекарственных средств в условиях СХТБ не доказана и требует дальнейших исследований, а возникающие побочные эффекты от приема препаратов ставят под сомнение целесообразность терапии в целом. Все вышесказанное обусловливает важность разработки и внедрения в клиническую практику новых лекарственных средств на основе как новых фармацевтических субстанций, так и уже зарегистрированных препаратов, к которым и относится афалаза – комбинированный препарат нового класса, содержащий аффинно очищенные антитела к еNOS и ПСА в релиз-активной форме. Препарат характеризуется высокой эффективность и безопасностью и обладает патогенетическим действием, что особенно важно при такой мало изученной патологии, как СХТБ. Использование афалазы в урологической практике в целом и при СХТБ в частности представляется перспективным.


