Введение. Осложненные инфекции верхних мочевыводящих путей (ОИВМП) являются частым и проблемным состоянием в практике уролога [1–3]. При этом оценка состояния ВМП, направленная на определение их проходимости, приобретает краеугольное значение для лечения [4, 5]. Выявление обструкции диктует необходимость дренирования мочевых путей проксимальнее уровня обструкции [6, 7]. Представляется очевидным проводить бактериологическое исследование мочи, получаемой из лоханки при стентировании или путем чрескожной пункционной нефростомии (ЧПНС), с тем чтобы распознать уропатоген, послуживший этиологическим фактором острого воспалительного повреждения почки [8]. Однако логика такого рассуждения упирается в общепризнанный порядок диагностики, предусматривающий бактериологическое исследование не лоханочной, а пузырной мочи, полученной уретральным катетером, или средней порции мочи, выпущенной пациентом самостоятельно [9, 10]. В этом порядке важно и то, что забор пузырной мочи следует производить до дренирования верхних мочевыводящих путей [11, 12]. В связи с этим напрашивается вопрос о сравнимости микробиоты пузырной и лоханочной мочи при остром обструктивном пиелонефрите (ООП) и, соответственно, о надежности культурального исследования пузырной мочи в плане выявления каузативного уропатогена в каждом отдельном случае ООП [13, 14].
Целью исследования стало сравнение микробиоты пузырной и лоханочной мочи при ООП.
Материалы и методы. После получения одобрения локального независимого этического комитета университета (№ 20/12 от 20.12.2012) и добровольного согласия пациентов в 2012–2015 гг. было проведено обследование 72 последовательно отобранных пациентов с ООП (12 мужчин и 60 женщин), возникшим в связи с камнями мочеточника. В прошлом пациенты не имели мочекаменной болезни и ИВМП.
Согласно протоколу обследования, всем пациентам выполнено бактериологическое исследование пузырной мочи, полученной уретральным катетером, и лоханочной мочи – после ликвидации калькулезной обструкции мочеточника в ближайшие 3–6 ч после госпитализации. Деривацию мочи 64 больным осуществляли j-j стентом, 8 – путем ЧПНС под рентгеновским или ультразвуковым контролем с локальной анестезией. Антибиотик с профилактической целью назначался рутинно. Бактериологическое исследование мочи проводили с использованием расширенного набора (9–10) питательных сред для идентификации широкого спектра аэробных и неклостридиальных анаэробных бактерий (НАБ). Эмпирическую антибиотикотерапию начинали исключительно после восстановления оттока мочи из почки и продолжали в течение 5–6 сут до получения результатов бактериологического исследования мочи.
Статистические расчеты выполняли в R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria). Различия анализировали на основе оценок частот встречаемости и концентраций. Для анализа сходства использовали метод Варда (расстояние Брея-Кёртиса) [15]. Сравнение зависимых групп по средним значениям проводили с помощью критерия Вилкоксона для связанных выборок, по частотам – с помощью критерия Мак-Немара. При сравнении несвязанных групп использовали критерий Манна–Уитни и точный тест Фишера для средних и частота соответственно.
Результаты. Демографические данные о когорте обследованных пациентов представлены в табл. 1.

Средний возраст больных составил 53,7±0,5 года, мужчин – 58,6±0,5, женщин – 52,8±0,5 года. Через 1–2 сут от появления клинической картины ООП были госпитализированы 35 (48,6%) человек, на 3–4-е сутки – 28 (38,9%), на 5-е сутки и позднее – 9 (12,5%). Предпочтение при дренировании верхних мочевыводящих путей отдавали стентированию мочеточника и только при невозможности его осуществить производили ЧПНС (см. табл. 1). У 4 пациентов при дренировании возникла лоханочная макрогематурия, в связи с чем бактериологическое исследование лоханочной мочи у них не проводили.
Во всех 72 случаях ООП как в пузырной, так и в лоханочной моче выделены культуры микроорганизмов, т.е. стерильной мочи при ООП не выявлено ни в одном наблюдении (табл. 2).
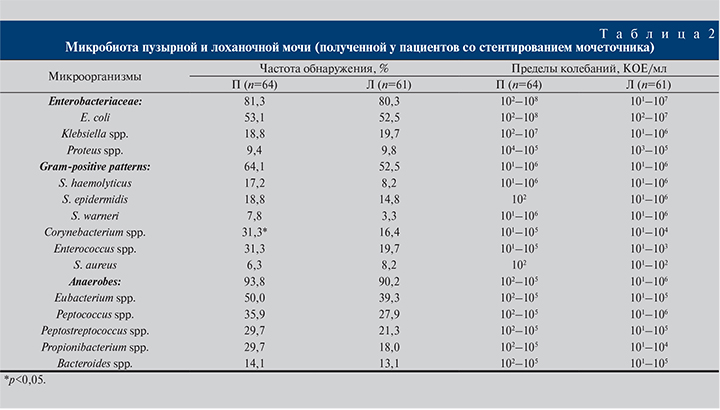
Уропатогены семейства Enterobacteriaceae в пузырной и лоханочной моче обнаружены с равной частотой – в 81,3 и 80,3% случаев соответственно (р>0,05). Также не зафиксировано различий (р>0,05) в выявляемости каждого из представителей этого семейства. Спектр грампозитивных микроорганизмов также оказался практически одинаковым в двух образцах мочи (р>0,05). Та же закономерность отмечена и для доминирующих в моче анаэробов (р>0,05). Единственное статистически значимое различие коснулось Corynebacterium spp., которые чаще (р<0,05) выявлялись в пузырной моче.
Анализ уровней бактериурии энтеробактерий, грампозитивной флоры и НАБ в двух образцах мочи демонстрировал их сопоставимость (р>0,05). Вместе с тем следует отметить широкие диапазоны бактериурии от 101 до 106 КОЕ/мл для большинства микроорганизмов, за исключением Proteus spp., S. aureus. В связи с этим представилось важным определить частоту различных уровней бактериурии уропатогенов при ООП (табл. 3).

В пузырной моче бактериурия ≥104 КОЕ/мл для E. coli, Klebsiella spp. и Proteus spp. определялась с частотой 90,9, 72,7 и 100% соответственно, а для остальных таксонов доминирующими оказались уровни бактериурии ≤103 КОЕ/мл.
В лоханочной моче ситуация с уровнями бактериурии несколько иная (см. табл. 3). Так, бактериурия ≥104 КОЕ/мл для E. coli, Klebsiella spp. и Proteus spp. определена в 71,8, 40 и 66,7% случаев соответственно. Другие же уропатогены обнаружены в лоханочной моче преимущественно в концентрации ≤103 КОЕ/мл, только титр Corynebacterium spp. в лоханочной моче статистически значимо (p=0,023) отличался от такового пузырной мочи.
Ранняя госпитализация (в течение первых суток) больных ООП остается редкой клинической ситуацией (менее 11% случаев), преобладают случаи с более поздней госпитализацией (более 2 сут – 51,4% наблюдений). В связи с этим проведен анализ взаимосвязи длительности течения нелеченого ООП и микробиоты пузырной и лоханочной мочи (табл. 4).
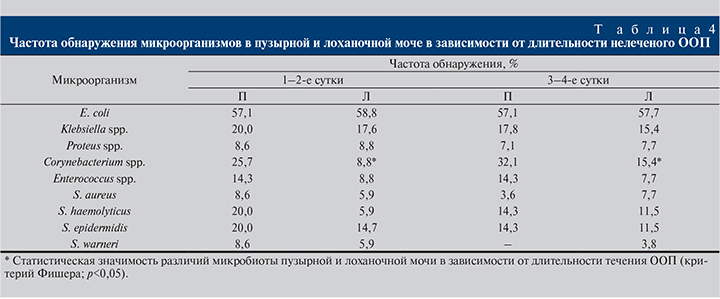
Статистически значимых различий между микробиотой пузырной и лоханочной мочи при длительности течения нелеченого ООП 1–2 и 3–4 сут нами не выявлено, за исключением более высокой частоты присутствия в пузырной моче Corynebacterium spp. Также не выявлено различий между микробиотой пузырной мочи на 1–2-е и 3–4-е сутки и микробиотой лоханочной мочи на тех же сроках.
Обсуждение. Лечение ОИВМП в настоящее время требует эффективной антибиотикотерапии с целью профилактики сепсиса и септического шока [16]. Выбор эмпирического антибиотика должен базироваться на данных локального госпитального протокола по антибиотикотерапии [17], который строится с учетом этиологической структуры ОИВМП и резистентности микроорганизмов, поэтому так важна бактериологическая оценка мочи после ее забора при экстренной госпитализации больных. Общепринято считать, что бактериологическому исследованию при острой окклюзии мочеточника камнем должна подвергаться пузырная моча, полученная либо катетером, либо средняя порция мочи, выпущенная самостоятельно [18]. Вместе с тем хорошо известно, что стандартное культуральное исследование пузырной мочи при ОИВМП только в 60% случаев выявляет канонические уропатогены [19–21]. А каковы этиологические факторы ОИВМП при получении стерильных результатов стандартных посевов мочи? В ответ на эту потребность наша исследовательская группа разработала методологию расширенного количественного посева мочи [22, 23] и в дальнейшем показала, что пузырная моча во всех случаях не стерильна при мочеточниковой калькулезной обструкции и остром пиелонефрите как у женщин, так и у мужчин [23]. Понятно, что просто присутствие бактерий в моче не должно отождествляться с инфекцией, тем не менее при явных клинических симптомах ОИВМП трудно не поддаться соблазну утвердить найденных в моче бактерий в качестве патогенных.
Так как острая окклюзия мочеточника камнем, приведшая к острому пиелонефриту, служит показанием к немедленному дренированию мочевыводящих путей выше уровня окклюзии, естественно, возник вопрос об уринарной микробиоте лоханки. Сравнение микробиоты мочи, полученной уретральным катетером и путем ЧПНС при ОИВМП, ранее показало их различие в 37–52% случаев, но это сравнение было проведено по результатам стандартного бактериологического исследования мочи [24]. Сопоставление бактериальных спектров пузырной и лоханочной мочи, идентифицированных с использованием расширенного набора питательных сред, было проведено впервые и в настоящем исследовании оно показало практическое сходство микробиоты и уровней бактериурии основных уропатогенов. Причем пузырные и лоханочные образцы мочи оказались неизменными на протяжении первых четырех суток острого калькулезного пиелонефрита. Также практически подобными оказались образцы мочи из мочевого пузыря и лоханки в течение исследования.
Итак, при ООП микробиота лоханочной и пузырной мочи идентична. В связи с этим следует признать абсолютно адекватным бактериологическое исследование пузырной мочи при односторонней окклюзии мочеточника камнем и развитии острого пиелонефрита. Однако признание этого факта базируется на расширенном культуральном исследовании мочи, т.е. нам представляется важным понимать клиническую обоснованность такого подхода к забору мочи и ее бактериологическому исследованию. Естественно, нет необходимости в определении микробиоты лоханки в практической работе. С другой стороны, возникает вопрос: а почему микробиота лоханки и пузыря идентична при односторонней окклюзии мочеточника? Можно представить частичное протекание мочи мимо камня, и это теоретически возможно. Но ведь гораздо чаще приходится сталкиваться с полной окклюзией мочеточника камнем. Как тогда найти объяснение? Еще в 2010–2011 гг. нами были проведены экспериментальные исследования [25] на модели острого обструктивного пиелонефрита, вызванного E. coli, в ходе которых было показано, что уже в течение первых суток контралатеральная почка колонизируется уропатогенами и в ней также развивается острая воспалительная реакция, только она никогда не достигает тяжести поражения окклюзированной почки.
Мы полагаем, что при развитии острого одностороннего обструктивного пиелонефрита, сопровождающегося бактериемией, происходит поражение контралатеральной почки и инфицирование мочи в контралатеральных верхних мочевыводящих путей, что и обусловливает доказанное подобие пузырной и лоханочной мочи по бактериальному профилю. Принимая во внимание, что пузырная моча здорового человека и больного ОИВМП содержит ассоциации аэробов и анаэробов, патогенную роль в развитии острого пиелонефрита может сыграть либо один микроорганизм, либо ассоциация бактерий.
В связи с этим необходимы новые исследования по этиологии и патофизиологии ОИВМП.
Заключение. Микробиота лоханочной мочи при ООП вследствие камня мочеточника идентична микробиоте пузырной мочи как по спектру, так и по уровням бактериурии различных таксонов микроорганизмов. Микробиота пузырной и лоханочной мочи практически не изменяется за первые четверо суток ООП. В связи с этим бактериологическое исследование пузырной мочи, производимое на расширенном наборе питательных сред, абсолютно соответствует клинической задаче по определению этиологического фактора воспаления. В моче при ООП среди канонических патогенов доминируют представители семейства Enterobacteriaceae (E. coli, Klebsiella spp). Более чем в 90% случаев им сопутствуют неклостридиальные анаэробы. В значительной части случаев уропатогены обнаруживают в лоханочной моче при ООП в концентрациях ≤103 КОЕ/мл. Данный факт требует переоценки понятия клинически значимой бактериурии при ОИВМП. Требуют дальнейшего изучения и патофизиологические механизмы инфицирования органов мочевыводящих путей при односторонней окклюзии верхних мочевыводящих путей.


