Гиперплазия предстательной железы (ГПЖ) – самое распространенное заболевание среди мужчин пожилого и старческого возраста. На его долю приходится более 40% от числа всех заболеваний у мужчин старше 50 лет, а вопросы стратегий лечения этой группы пациентов остаются весьма актуальными и по сей день [1, 2]. По данным зарубежных эпидемиологических исследований, клинические признаки ГПЖ обнаруживаются у 14% мужчин в возрасте 40–49 лет, а к 80 годам этот показатель достигает 80–90% [3–5]. Гистологические признаки ГПЖ при аутопсии обнаруживаются у 40% мужчин в возрасте 50 лет и у 90% мужчин старше 80 лет [6]. Несмотря на существующие рекомендации относительно ведения таких пациентов, остается много нерешенных вопросов, среди которых: каков оптимальный момент времени для начала медикаментозной терапии, как долго проводить терапию, как правильно выбрать лечебную стратегию для того или иного пациента?
Европейская ассоциация урологов рекомендует консервативный подход для мужчин с легкой симптоматикой. В то же время было показано, что раннее назначение медикаментозной терапии может быть подходящим вариантом для некоторых групп пациентов [7]. Активно внедряемые в клиническую практику риск-ориентированные подходы к лечению пациентов актуализировали использование тактики активного наблюдения, включающую рекомендации по изменению образа жизни. К таким рекомендациям относятся сокращение потребления жидкости, отказ или умеренное употребление кофеина и алкоголя, техники отвлечения внимания, массаж уретры, использование приемов двойного и расслабленного мочеиспускания, повторная тренировка мочевого пузыря, анализ принимаемых лекарственных препаратов, лечение запоров.
В Европейских и Российских клинических рекомендациях прописана возможность применения тактики активного наблюдения в качестве моноподхода к пациентам с легкой симптоматикой [8]. Важным вопросом стало определение эффективности данной стратегии у пациентов и с более выраженной симптоматикой, с высоким риском прогрессирования заболевания.
С 2010 по 2013 г. было проведено исследование CONDUCT по изучению эффективности и безопасности комбинации дутастерида и тамсулозина в фиксированной дозировке (Дуодарт®) по сравнению с активным наблюдением и рекомендациями по изменению образа жизни с возможным последующим назначением тамсулозина в случае ухудшения симптоматики или отсутствия динамики при соблюдении всех рекомендаций [9, 10].
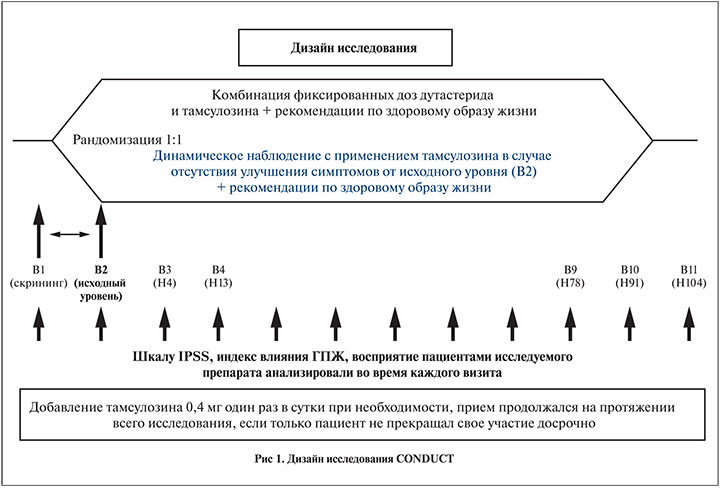
Это было открытое рандомизированное мультицентровое международное исследование IV фазы, в котором приняли участие 742 пациента из 8 стран Европы. Результаты данного исследования были опубликованы в 2015 г. Больные были рандомизированы на две группы: группа комбинированной терапии (фиксированная комбинация, n=369); группа активного наблюдения с возможным последующим назначением тамсулозина (n=373).
Пациенты посещали клинику 4 нед после рандомизации и далее 1 раз в 3 мес в течение 24 мес. Пациенты сообщали о симптомах, качестве жизни, которые оценивались с помощью шкалы IPSS, удовлетворенности лечением. Кроме того, во время каждого визита пациента оценивали BPH impact index (BII) – степень влияния симптоматики на повседневную жизнь. BII – это шкала, состоящая из 4 вопросов, баллы варьируются от 0 (нет влияния симптомов на повседневную жизнь) до 13 (значительное влияние симптомов на повседневную жизнь). Дополнительно оценивали восприятие пациентами лечения с помощью опросника PPST. Данный опросник состоит из двух вопросов: насколько Вы удовлетворены лечением и будете ли Вы просить врача о данном лечении в будущем? Первый вопрос оценивался по 7-балльной шкале от «очень доволен» до «очень недоволен», второй – по 3-балльной шкале «да», «нет» или «не уверен».
Через 12 и 24 мес пациентам проведено пальцевое ректальное исследование, выявлено наличие гинекомастии, выполнен клинический и биохимический анализ крови, общий анализ мочи, определен уровень простатического специфического антигена (ПСА).
В исследование были включены мужчины старше 50 лет с подтвержденным диагнозом ГПЖ, симптоматикой средней степени выраженности (IPSS – 8–19 баллов), объемом предстательной железы по данным трансректального УЗИ (ТРУЗИ) более 30 см3 и с уровнем ПСА более 1,5 нг/мл. Критерии исключения: уровень ПСА более 10 нг/мл, подозрение на наличие рака предстательной железы, полученное ранее лечение по поводу ГПЖ (рис. 1).
Первичной конечной точкой исследования была оценка изменения субъективной симптоматики по шкале IPSS с момента начала исследования и до его окончания через 24 мес. Вторичными конечными точками были показатели улучшения симптоматики на 2 или 3 балла и более или на 25%, число пациентов с клиническим прогрессированием ГПЖ (ухудшение симптоматики на 3 и более баллов по шкале IPSS), а также частота возникновения острой задержки мочи (ОЗМ), инфекций мочевыводящих путей и почечной недостаточности.
Полностью завершили исследование 292 (79%) пациента, получавших Дуодарт, и 300 (80%) – из группы активного наблюдения с возможным назначением тамсулозина. Всего 229 (61%) пациентов к концу исследования стали получать α-адреноблокатор. Основные причины перехода на этот вариант лечения в группе активного наблюдения: ухудшение симптоматики по шкале IPSS – 158 (69%) мужчин, отсутствие эффекта от лечения – 57 (25%), неудовлетворенность лечением и ошибочное суждение о своем состоянии, несмотря на улучшение, согласно данным шкалы IPSS – 14 (6%).

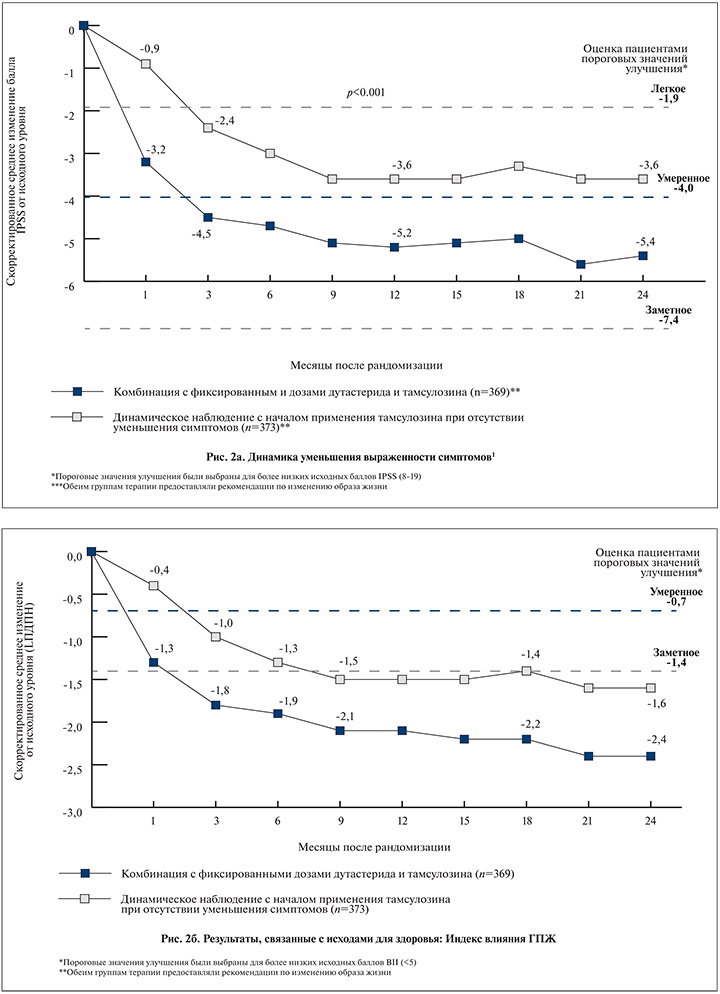
Через 24 мес среднее изменение балла по шкале IPSS составило 5,4 в группе комбинированной терапии и 3,6 в группе активного наблюдения с возможным добавлением тамсулозина (p<0,001, 95% доверительный интервал [ДИ] – 2,5; 1,2). В группе Дуодарта к 9-му месяцу наблюдения все пациенты имели легкие симптомы – менее 8 баллов по шкале IPSS, тогда как в группе активного наблюдения симптомы оставались умеренными (8–19) на протяжении всего исследования (рис. 2 а). Базовые характеристики мужчин в возрасте 65 лет и старше или моложе 65 лет были в целом сопоставимыми. Несмотря на то что мужчины моложе 65 лет были более обеспокоены своим мочеиспусканием, чем мужчины 65 лет и старше (оценка BII 5,1 против 4,3), это не привело к разнице в исходных значениях баллов по шкале IPSS. Наиболее значимые изменения симптоматики по шкале IPSS (≥3 баллов или ≥25% от исходного балла) наблюдались к 24-му месяцу лечения у пациентов в группе Дуодарта по сравнению с группой наблюдения: 77 против 64% и 73 против 60% пациентов соответственно (р<0,001). Кроме того, у мужчин моложе 65 и 65 лет и старше данный показатель улучшился на 6,6 и 4,8 балла для пациентов, принимавших фиксированную комбинацию дутастерида и тамсулозина, 5,5 и 4,8 балла для пациентов в подгруппе активного наблюдения без лечения и 2,9 и 2,6 балла в подгруппе пациентов, дополнительно принимающих тамсулозин.
К 24-му месяцу лечения 29% мужчин в группе динамического наблюдения с добавлением терапии тамсулозином имели признаки клинического прогрессирования по сравнению с 18% мужчин, получавших Дуодарт. Комбинированная терапия тамсулозином и дутастеридом снизила относительный риск клинического прогрессирования заболевания на 43,1% (95% ДИ – 22,5; 58,2) по сравнению с группой сравнения (p<0,001), а абсолютный риск прогрессирования снизился на 11,3%.
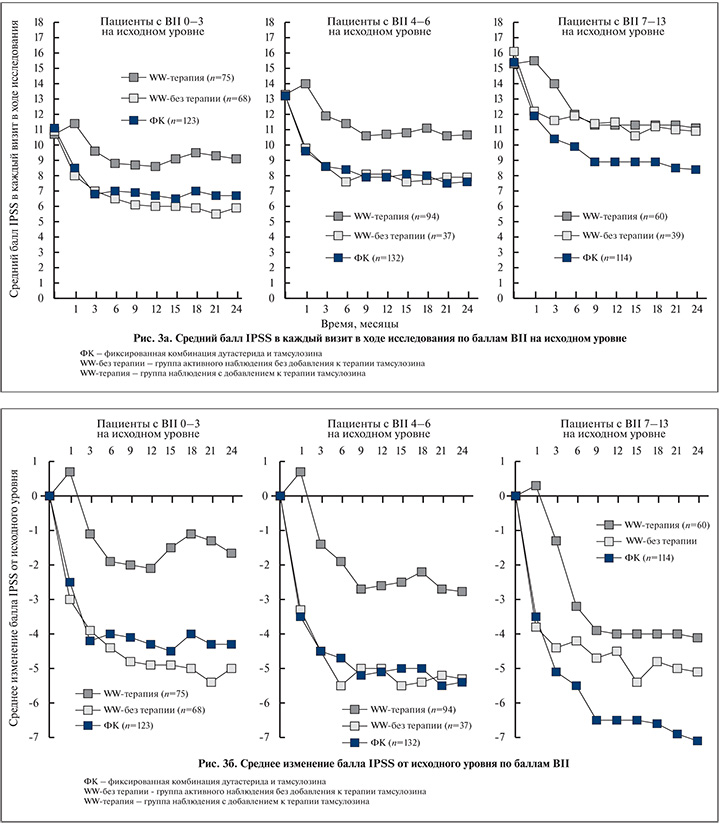
При оценке качества жизни с помощью опросников BII (BPH Impact Index) и IPSS-QoL (International prostatic symptom score – Quality of Life) на каждом визите в течение 24 мес значения данных показателей были значительно выше в группе пациентов, получавших фиксированную комбинацию дутастерида и тамсулозина. На 24-м месяце среднее изменение по опроснику BII составляло -2,4 балла в группе комбинированной терапии против -1,6 балла в группе наблюдения (p<0,001, 95% ДИ –1,2; –0,5;) (рис. 2б). Соответствующие изменения были и по шкале IPSS-QoL – -1,5 против -1,1 соответственно (p<0,001, 95 % ДИ –0,6; –0,2), что говорит о том, что пациенты, принимающие Дуодарт, были готовы провести остаток своей жизни с симптомами, которые у них имелись на момент окончания исследования (рис. 3а).
Симптоматическое улучшение у пациентов группы динамического наблюдения без добавления тамсулозина оказалось похожим на таковое в группе мужчин, получавших фиксированную комбинацию дутастерида и тамсулозина, и лучше, чем в подгруппе наблюдения с добавлением к лечению тамсулозина, но лишь при условии исходно низкой обеспокоенности симптомами нарушенного мочеиспускания (BII-индекс). Существует ряд возможных объяснений этого. Мужчины, которые получали тамсулозин, как правило, старше и имеют более беспокоящие симптомы на начальном уровне. Возможно, молодые люди лучше переносят свои симптомы. В результате степень беспокойства не приводит к изменениям в оценке по шкале IPSS и лечения тамсулозином не требуется. Напротив, разница между степеню обеспокоенности и изменения симптоматики по шкале IPSS могут быть выше у пожилых мужчин, т.е. влияние симптомов на их качество жизни обусловливает необходимость медикаментозной терапии (рис. 3б).
К 24-му месяцу доля пациентов, удовлетворенных лечением или готовых просить врача о проведении лечении в будущем, – вопросы 1 и 2 из анкеты PPST (Patient Perception of Study Treatment) соответственно, была сопоставимой в группе пациентов, получавших фиксированную комбинацию дутастерида и тамсулозина, и в группе динамического наблюдения (вопрос 1: 87 и 86% соответственно; вопрос 2: 68 и 65% соответственно). По обоим вопросам процент пациентов с положительным ответом к концу 1-го месяца был значительно выше в группе пациентов, получавших Дуодарт, чем в группе наблюдения (p<0,001); статистически значимые различия (p<0,05) в пользу группы Дуодарта также наблюдались к концу 3-го и 6-го месяцев для первого вопроса анкеты PPST и 3-го месяца для второго вопроса.
Нежелательные явления оценивались у всех пациентов, получавших фиксированную комбинацию дутастерида и тамсулозина (n=369), и у пациентов, которые начали лечение тамсулозином (n=229). Наиболее частыми нежелательными явлениями в группе принимавших Дуодарт были эректильная дисфункция, которая наблюдалась у 8% пациентов, и ретроградная эякуляция – у 5%. В группе пациентов, принимавших тамсулозин, ретроградная эякуляция наблюдалась в 4% наблюдений. Нежелательные явления со стороны сердечно-сосудистой системы встречались примерно в равных пропорциях в обеих группах. Сердечно-сосудистые нарушения наблюдались у 7 пациентов в группе Дуодарта (1,9%) и у 3 (0,8%) мужчин, принимавших тамсулозин. Сердечная недостаточность констатирована у 6 (2,6%) пациентов, принимавших комбинацию тамсулозина и дутастерида, и у 1 (0,4%) пациента, получавшего тамсулозин (см. таблицу). Кроме того, наблюдалось снижение содержания общего ПСА относительно исходного уровня в группе пациентов, получавших фиксированную комбинацию дутастерида и тамсулозина, и увеличение данного параметра среди пациентов, которые начали прием тамсулозина: к 6-му месяцу (-45,2 против -1,8%) и к 24-му месяцу (-48,5 против 20,1% соответственно). Рак предстательной железы обнаружен у 1 пациента в группе тамсулозина. Три пациента той же группы умерли по причинам, не связанным с терапией.
Подводя итог, следует отметить, что CONDUCT было первым рандомизированным исследованием эффективности применения фиксированной комбинации 0,5 мг дутастерида и 0,4 мг тамсулозина мужчинами с умеренными симптомами и высоким риском прогрессирования ГПЖ. Пациенты с умеренной симптоматикой (8–19 баллов по шкале IPSS), включенные в исследование, отражают основную массу мужчин, обычно встречающихся в урологической практике. Таким образом, результаты, полученные в ходе данного исследования, могут помочь принять верное решение относительно тактики ведения пациентов с умеренными симптомами и риском прогрессирования заболевания.
Действительно Российские клинические рекомендации декларируют необходимость назначения комбинированной терапии больным с умеренными и тяжелыми симптомами нарушенного мочеиспускания (СНМ), увеличенным объемом предстательной железы (40 см3 и более) и сниженным значением максимальной скорости мочеиспускания (Qmax) (высокий риск прогрессирования заболевания). Хорошо известно, что ингибиторы 5α-редуктазы – единственная группа препаратов, уменьшающая объем предстательной железы, в то время как α-адреноблокаторы устраняют динамический компонент инфравезикальной обструкции [8]. Комбинированное назначение препаратов этих групп позволяет воздействовать на сложные механизмы патогенеза СНМ и способствовать существенному улучшению качества жизни больных ГПЖ.
На сегодняшний день достаточно подробно изучена стратегия комбинированной терапии α-адреноблокаторами и ингибиторами 5α-редуктазы пациентов с СНМ, обусловленными ГПЖ, по сравнению с монотерапией данными группами препаратов. Одним из наиболее значимых исследований по эффективности комбинированной терапии является исследование CombAT [11–14]. Долгосрочная комбинированная терапия с помощью дутастерида и тамсулозина привела к более значительному снижению выраженности симптоматики, риска клинического прогрессирования и улучшению качества жизни по сравнению с монотерапией тамсулозином. В исследование CombAT вошли мужчины с более тяжелыми симптомами ГПЖ, чем в исследовании CONDUCT (IPSS от 12 до 35). Следовательно, почти 50% мужчин, включенных в CONDUCT, не могли бы быть включенными в исследование CombAT. В данное исследование вошли мужчины в возрасте старше 50 лет с клиническим диагнозом ГПЖ, баллом по шкале IPSS ≥12, объемом предстательной железы ≥30 см3 (по данным ТРУЗИ), уровнем ПСА ≥1,5 нг/мл, 5 мл/с<Qmax и ≤15 мл/с, с объемом мочеиспускания ≥125 мл. Основными критериями исключения были уровень ПСА >10,0 нг/мл в сыворотке крови, подозрение на наличие рака предстательной железы, операция на предстательной железе в анамнезе, ОЗМ в течение 3 мес до входа в исследование, использование ингибиторов 5α-редуктазы в течение 6 мес (или дутастерида в течение 12 мес) или α-адреноблокатора или фитотерапии в течение 2 нед.
Первичной конечной точкой исследования через 4 года было время возникновения ОЗМ или оперативного лечения, связанного с ГПЖ, определяемое как количество дней с момента приема первой дозы исследуемого препарата до даты возникновения этих ситуаций.
Из 4844 мужчин, рандомизированных на лечение, 3195 (66%) завершили исследование. В группе тамсулозина наблюдалась более высокая частота (39%) прекращения приема препарата по сравнению с комбинацией дутастерида и тамсулозина (31%) или дутастеридом (33%), и больше пациентов в группе тамсулозина выходили из исследования из-за отсутствия эффекта. В ходе исследования при каждом визите оценивали возникновение ОЗМ, а также необходимость оперативного вмешательства, рецидивы инфекции мочевыводящих путей и появление первого эпизода недержания мочи. Каждые 3 мес оценивали симптоматику по шкале IPSS (включая вопрос о качестве жизни), каждые 6 мес – Qmax.
Срок до возникновения первой ОЗМ или появления необходимости в хирургическом вмешательстве был значительно меньше среди пациентов, получавших комбинированную терапии, чем у мужчин, получавших монотерапию тамсулозином (р<0,001); между группами комбинированной терапии и дутастеридам существенной разницы не наблюдали (p=0,18).
Комбинированная терапия снизила относительный риск ОЗМ или связанной с ГПЖ операцией на 65,8% по сравнению с тамсулозином и на 19,6% по сравнению с дутастеридом. Если рассматривать эти ситуации отдельно, то по сравнению с тамсулозином комбинированная терапия уменьшала относительный риск ОЗМ на 67,6% и необходимость операции, связанную с ГПЖ, на 70,6%. По сравнению с дутастеридом снижение относительного риска при комбинированной терапии составило 18,3% для ОЗМ и 31,1% для операции и разница во времени между событиями в этих группах лечения была незначительной (p=0,37 и p=0,074 соответственно).
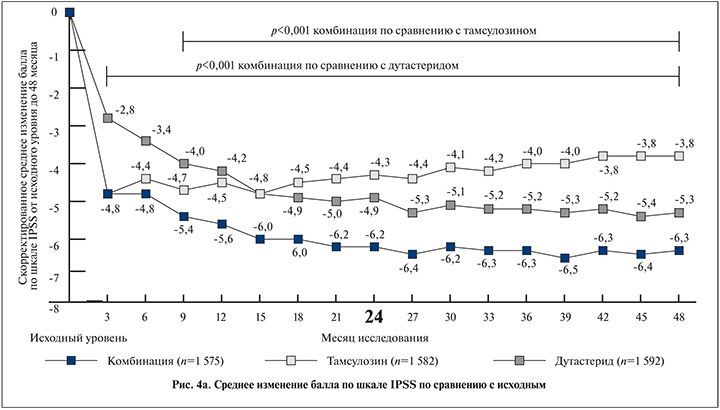
Комбинированная терапия уменьшила относительный риск ухудшения симптомов (IPSS≥4 баллов от исходного уровня) на 41,3% по сравнению с тамсулозином и на 35,2% по сравнению с дутастеридом. Превосходство комбинированной терапии по сравнению с тамсулозином наблюдалось с 9-го месяца и по сравнению с дутастеридом с 3-го месяца лечения (р<0,001 для всех сравнений; рис. 4, а).
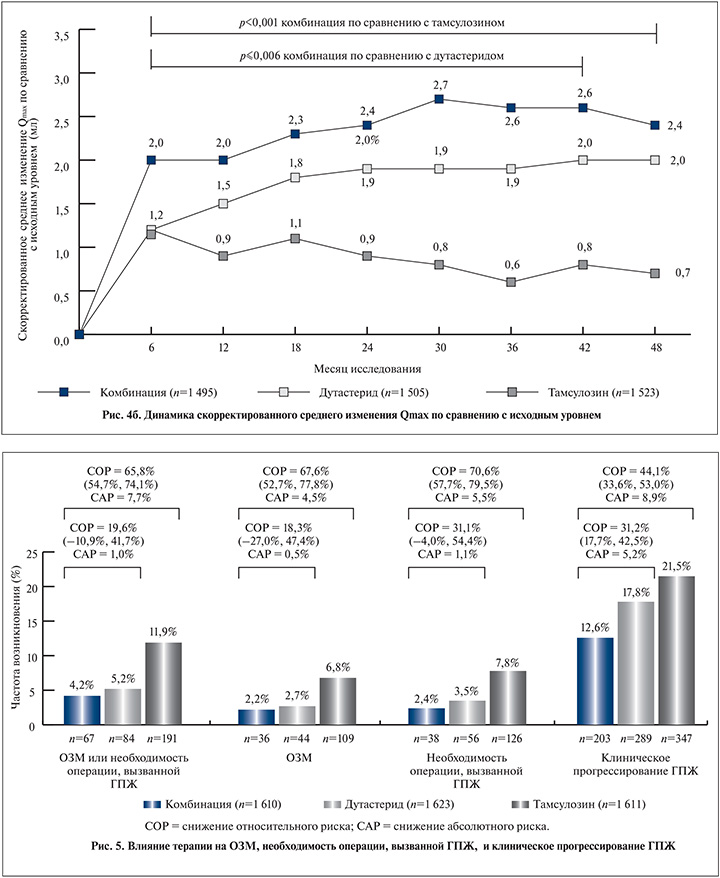
На 48-м месяце среднее увеличение Qmax по сравнению с исходным уровнем составило 2,4 мл/с для комбинированной терапии против 0,7 мл/с (p<0,001) для тамсулозина и 2 мл/с (p=0,05) для дутастерида. К концу лечения среднее изменение объема простаты составило -27,3% для комбинированной терапии +4,6% (р<0,001) для тамсулозина и -28% (p=0,42) для дутастерида (рис. 4, б).
У мужчин с СНМ от умеренной до тяжелой степеней из-за ГПЖ комбинированная терапия дутастеридом и тамсулозином значительно уменьшила относительный риск ОЗМ или связанной с ГПЖ операцией в течение 4 лет на 66% по сравнению с монотерапией тамсулозином (рис. 5). Не наблюдалось существенной разницы по данному показателю между комбинированной терапией и дутастеридом. Кроме того, комбинированная терапия значительно снижала относительный риск клинической прогрессирования ГПЖ и в большей степени снижала выраженность симптоматики (IPSS≥4 баллов) по сравнению с монотерапией. Эти данные подтверждают целесообразность использования комбинированной терапии дутастеридом и тамсулозином в качестве варианта лечения мужчин с СНМ из-за ГПЖ и увеличения предстательной железы при высоком риске прогрессирования для обеспечения быстрого и долговременного эффекта [15–18].
Резюмируя данные двух исследований, следует отметить, что оба этих исследования предусматривают важное понимание врачами долгосрочного использования комбинированной терапии для достижения наилучших результатов в снижении симптомов, риска прогрессирования и улучшения качества жизни. Российские клинические рекомендации регламентируют длительный или пожизненный прием ингибиторов 5α-редуктазы, а лечение препаратами этой группы не оправданно. Эффект препаратов данной группы отсрочен во времени и проявляется не ранее чем через 6 мес при приеме дутастерида и 12 мес при приеме финастерида, что, по-видимому, обусловлено более эффективным снижением уровня дигидротестостерона, являющегося основой развития ГПЖ.
Стратегия активного наблюдения, с успехом используемая пациентами в европейских странах, не всегда может быть использована в Российской Федерации. Низкая комплаентность пациентов, поздняя обращаемость за медицинской помощью не всегда позволяют использовать такие подходы к лечению рассматриваемой группы пациентов. Кроме того, смена образа жизни является скорее симптоматической стратегией, не воздействующей на патогенетические механизмы развития ГПЖ. В этом случае весьма затруднительно воздействовать на факторы прогрессирования заболевания, а значит, и на риски развития ОЗМ и прочие осложнения ГПЖ. Подобный терапевтический подход должен быть использован в качестве дополнительного к основному медикаментозному, но не в качестве самостоятельного для пациентов с риском прогрессирования заболевания.



