Анализируя подходы к хирургическому лечению больных раком простаты высокого и очень высокого риска, легко убедиться, что за последние 20–25 лет в данном вопросе произошли значительные перемены. В истории изучения проблемы рака простаты стоит отметить две основные вехи. Во-первых, это разработка Papsidero теста для серологического определения уровня простатспецифического антигена (ПСА) в крови в 1980 г. и широкое внедрение его как скрининга с 1990-х гг. [1], а также мониторирование уровня ПСА для оценки эффективности лечения. Во-вторых, разработка D’Amico в 1998 г. первой классификации с учетом одновременно уровня ПСА, клинической стадии (cT) и суммы баллов по Глисону на основании изучения отдаленных результатов лечения [2]. Создание этой классификации стало итогом большой практической работы по изучению течения заболевания у разных групп пациентов. В ней и была впервые выделена категория больных раком простаты высокого риска, соответственно, начиная с этого времени стал возможен ее анализ.
Хирургическое лечение (радикальная простатэктомия – РПЭ), гормональная и лучевая терапия, применяемые в отдельности для лечения таких пациентов, дают недостаточно хорошие результаты. Так, при РПЭ независимо от вида доступа (позадилонный, лапароскопический, роботический) положительный хирургический край наблюдается в 41–53% случаев [3]. Для достижения лучших результатов необходимо комбинировать методы лечения, но однозначный подход не выработан. Например, известно назначение лучевой терапии, в том числе в качестве сальважной, при локальном рецидиве после РПЭ. Однако существует и противоположный подход – выполнение плановой РПЭ после лучевой терапии, а также сальважной РПЭ в случае рецидива [4]. Андрогенная блокада также успешно сочетается с лучевой терапией и хирургическим лечением, но стандарты или алгоритм выбора последовательности этих методов, а также длительности и режима гормональной терапии не выработаны [5].
Таким образом, актуальны вопросы определения:
- последовательности применения существующих методов лечения;
- времени между их назначением;
- режимов лучевой и гормональной терапии (интермиттирующая или постоянная, немедленная или отсроченная);
- одномоментного или пошагового назначения лечения.
Далее постараемся определить основные причины возникающих трудностей при ведении этих пациентов и выделить современные тенденции в лечении.
Проведен анализ публикаций, индексированных в системах Pubmed и Web of science. Поиск печатных работ осуществлялся по точному соответствию фразам «high risk prostate cancer», «locally advanced prostate cancer» или «metastatic prostate cancer» в сочетании с запросами «radical prostatectomy» и «surgical treatment», «surgery». Рассматривались публикации начиная с 2013 г.
Особенности диагностики рака простаты высокого риска. Согласно современным представлениям, в группу высокого риска попадают пациенты при наличии хотя бы одного из следующих критериев: стадия cT2c, или сумма баллов по Глисону 8 и выше, или уровень ПСА не менее 20 нг/мл. Если задуматься над каждым из этих критериев, становится ясно, что все они до определенной степени условны. Так, общеизвестно, что ПСА – это основной маркер рака простаты, но его специфичность невысока. Попытки связать концентрацию ПСА и стадию TNM не увенчались успехом. Конечно, у пациента с запредельно высоким значением ПСА скорее всего будут выявлены отдаленные метастазы. Однако от пациентов с умеренным повышением содержания ПСА и впервые выявленной аденокарциномой простаты убедительной корреляции со стадией получено не было [6]. Уровень ПСА выше 20 нг/мл в исследовании J. A. Spencer и соавт. был одинаково подозрительным в отношении поражения лимфоузлов и отдаленных метастазов. У многих пациентов с метастазами в лимфоузлы и без них был одинаковый уровень ПСА.
Наиболее информативным методом для стадирования опухоли признана МРТ, некоторые авторы пытаются заменить КТ и остеосцинтиграфию одномоментной МРТ всего тела [7]. Исследование показало, что чувствительность и специфичность МРТ в определении костных метастазов составили 100%!
В то же время для остеосцинтиграфии данные показатели оказались равными 89 и 90% соответственно. При сравнении МРТ и КТ для идентификации метастазов в лимфоузлы специфичность обоих методов была 100%. В плане чувствительности МРТ вновь показала большую точность – 100 против 82%.
К сожалению, такие фантастически высокие цифры, отражающие информативность метода, справедливы только для костных метастазов и оценки состояния регионарных лимфоузлов. В отношении экстракапсулярного распространения рака, которое серьезно влияет на стадию и прогноз, эти цифры более скромные. В исследование [8], проведенное в США, вошли 116 пациентов, которым выполнялась мультипараметрическая МРТ, затем биопсия простаты под контролем МРТ и РПЭ. Среди больных без экстракапсулярного роста, по данным МРТ, при гистологическом исследовании после операции он был выявлен в 23% случаев. Таким образом, чувствительность, специфичность, прогностическая ценность положительного и отрицательного результатов мультипараметрической МРТ для экстракапсулярной инвазии в этом исследовании составили 48,7; 73,9; 35,9 и 82,8% соответственно.
И урологи, и специалисты по лучевой диагностике знают об этих ограничениях метода. Возможно, из-за этого минимальный участок, подозрительный в отношении инвазии, при описании снимков может трактоваться как экстракапсулярный рост. При послеоперационном гистологическом исследовании нередко оказывается, что инвазии на самом деле не было. То есть речь идет о дооперационном, или клиническом, завышении стадии (вместо T2c устанавливается T3a), которое, по данным разных авторов, имеет место от 9% [9] до внушительных 27% [10].
Не лучше ситуация и с диагностикой вовлечения семенных пузырьков. Специфичность на современных аппаратах в зависимости от используемой обработки изображений достигает 93–97%, но чувствительность остается низкой – от 59 до 70% [11]. Как результат приходится видеть дооперационное завышение стадии уже до T3b. Нередко имеет место и обратное явление – дооперационное занижение стадии. Например, при изучении отдаленных результатов лечения местнораспространенного рака простаты [12] было отмечено, что по результатам патоморфологического исследования у 16,3% пациентов наблюдалось дооперационное завышение стадии с T2 до T3 и у 39,1% имело место занижение стадии.
Итак, использование всех современных методов дооперационного обследования не позволяет однозначно отнести достаточно большое количество пациентов к той или иной группе онкологического риска. Иными словами, в группе высокого риска есть существенный процент пациентов, РПЭ у которых даст информацию, что на самом деле они относились к более благоприятной группе. И у них РПЭ в части случаев приведет к полному излечению! Например, M. Abern и соавт. [13] анализировали гистологические характеристики материала после РПЭ у пациентов высокого риска. У 39% мужчин после операции не было выявлено гистологических критериев высокого риска (сумма баллов по Глисону <8, отсутствовали экстракапсулярный опухолевый рост и поражение лимфоузлов). Авторы отнесли заболевание этой группы к «благоприятному» – «favorable pathology». Они отметили, что шанс иметь такой благоприятный вариант заболевания выше у пациентов, имевших до операции только 1 критерий высокого риска. Формально та часть пациентов, у которых до операции уровень ПСА был выше 20 нг/мл, остались в группе высокого риска. Другие пациенты по результатам гистологии перешли в группу среднего риска. Наблюдение проводилось в течение 82 мес, и за это время 70% пациентов с благоприятным прогнозом не потребовалось никакого дополнительного лечения. Только в 17% наблюдений была назначена гормональная терапия по причине биохимического рецидива. В группе же неблагоприятного прогноза только в отношении 37% пациентов удалось ограничиться РПЭ.
У больных раком простаты высокого и очень высокого риска велик риск смерти именно от этого рака в отсутствие лечения. Даже у пациентов старше 70 лет при условии неотягощенного соматического статуса и рака простаты высокого риска прогноз для жизни будет определяться в первую очередь раком [14]. Таким образом, они нуждаются в наиболее активном лечении.
Особенности лечения рака простаты высокого риска. При рассмотрении РПЭ как метода лечения рака высокого риска встает вопрос о ее нерадикальности. Крупные исследования убедительно демонстрируют, что каждый из критериев высокого риска независимо статистически значимо увеличивает риск положительного хирургического края: стадия T3–T4 по сравнению с T1–T2 (HR – 2,68; 95% CI – 2,00–3,59; p<0,001), уровень ПСА>20 нг/мл по сравнению с ПСА<10 нг/мл (HR – 1,80; 95% CI – 1,06–3,05; p=0,029), сумма баллов по Глисону 8–10 сравнительно с баллами 2–6 (HR – 2,25; 95% – 1,39–3,63; p=0,001) [15]. В заключение авторы сообщают, что, по их данным, положительный хирургический край статистически значимо уменьшил безрецидивную выживаемость, но не оказал влияния на раковоспецифическую смертность.
По другим данным, инвазия рака на протяжении 1 мм хирургического края снижает 3-летнюю безрецидивную выживаемость на 17%! [16]. Авторы следующего исследования пошли дальше и предположили, что наличие злокачественных клеток на расстоянии 0,1 мм от хирургического края тоже может влиять на показатели выживаемости. Помимо групп положительного и отрицательного хирургического края они выделили группу «близкого» («close») хирургического края. И действительно, по безрецидивной выживаемости различий между близким и положительным хирургическими краями не оказалось! В то же время отличия от группы с отрицательным хирургическим краем были статистически значимыми (HR – 1,72; 95% CI – 1,15–2,57) [17]. Резюмируя вышеизложенное, приходится признать, что в таких условиях с большой вероятностью РПЭ заведомо не приведет к полной ликвидации аденокарциномы.
И все же, несмотря на успешное применение других методов, РПЭ в большинстве случаев остается методом первой линии, так как, с одной стороны, сама по себе обусловливает хорошие показатели безрецидивной выживаемости, с другой – обеспечивает точное патоморфологическое стадирование [18]. Это в свою очередь дает возможность более обоснованно подходить к дальнейшим ступеням лечения или даже воздержаться от них, если имело место дооперационное завышение стадии.
Стоит отметить, что в последнее время появляются публикации о выполнении РПЭ пациентам с отдаленными метастазами. Например, в работу [19] вошли 23 пациента только с костными метастазами, продемонстрировавшие хороший ответ на неоадъювантную гормональную терапию. Предварительные результаты обнадеживают: раковоспецифическая выживаемость 95,6% в группе РПЭ против 84,2% в других группах. Впрочем, срок и количество наблюдений пока недостаточны, чтобы уверенно говорить о целесообразности такого подхода, а различий в показателях общей выживаемости не получено. Кроме того, не стоит забывать о качестве жизни. Практически у всех больных раком простаты имеется и ее гиперплазия. В группе пациентов, которым не выполнялась РПЭ, в последующем 29% больных потребовалась паллиативная трансуретральная резекция предстательной железы в связи с обструктивной симптоматикой на фоне локального прогрессирования рака, а при назначении лучевой терапии стоит ожидать увеличения доли пациентов с затруднением мочеиспускания. В группе РПЭ в паллиативном местном лечении необходимости не было.
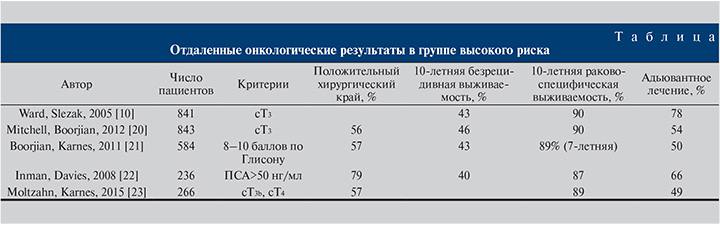
В таблице для наглядности суммированы результаты некоторых работ по хирургическому лечению рака простаты, отвечающего части или всем критериям высокого риска.
Актуален и вопрос объема лимфаденэктомии, а также выбора тактики при наличии метастазов в лимфоузлы. Сравнительно недавно при морфологически подтвержденных метастазах в лимфоузлы (при биопсии или лимфаденэктомии) хирурги не выполняли РПЭ по причине высокой опасности иметь отдаленные латентные метастазы и назначали гормональную терапию ГТ [24]. Однако в последнее время на смену этой тактике пришло понимание необходимости РПЭ и расширенной тазовой лимфаденэктомии при раке высокого риска независимо от подозрения на метастазы в лимфоузлах при лучевых методах диагностики или их гистологического подтверждения [25]. К. Нюшко и соавт. [22] подчеркивают, что пациенты с микрометастазами и при поражении менее 15% лимфоузлов имеют хороший прогноз даже без проведения адъювантной гормональной терапии. У пациентов с биохимическим рецидивом после РПЭ сальважная лимфаденэктомия также демонстрирует хорошие результаты. В частности, по данным [23], полная ремиссия (отсутствие биохимического рецидива) наблюдается в 28,4% наблюдений. По другим данным, биохимический рецидив происходит практически у всех пациентов, но он не влияет на раковоспецифическую выживаемость [26].
При расширенной лимфаденэктомии может быть пропущено до 13% лимфоузлов, содержащих метастазы [27]. Выполнение всем пациентам сверхрасширенной ЛАЭ потенциально может приводить к большему количеству осложнений без существенного улучшения выживаемости. Один из путей решения этой проблемы – маркировка путей лимфооттока от простаты и подозрительных лимфоузлов. Для этого предложено два метода: сравнительно давно известное радиоизотопное картирование путей лимфооттока и новый для урологии метод – флуоресцентная визуализация с индоцианином зеленым [28]. Диагностическая ценность этих методов сопоставима, однако флуоресцентное картирование удобнее для практического использования, так как не требует радиационной защиты и занимает меньше времени. Оба метода обладают приемлемой специфичностью и очень высокой чувствительностью. То есть наличие маркировки лимфоузла при использовании указанных методов означает, что в нем может и не быть метастаза, но риск существует. Отсутствие маркировки означает, что в лимфоузле точно нет метастаза, так как он анатомически не связан с простатой, и удалять его бессмысленно.
S. Hruby и соавт. [27] не исключают, что даже при раке простаты высокого и очень высокого риска метод рационально применять, чтобы избежать ненужного удаления лимфоузлов.
Современные тенденции
Рассматривая пути решения сформулированных выше проблем, мы можем отметить следующие тенденции, которые, по нашему мнению, будут определять дальнейшее направление лечения рака простаты в обозримом будущем.
Мультимодальность. Здесь мы подразумеваем не только возможность последовательного, «пошагового» применения различных методов лечения. Это и рациональное комбинирование методов, и возможность использования одних методов в разных последовательностях. Так, с успехом используется назначение адъювантной лучевой терапии, особенно в случае биохимического рецидива после РПЭ. Однако не стоит забывать и об обратной возможности – применения неоадъювантной лучевой терапии с последующей плановой РПЭ [4]. Альтернативный вариант комбинирования данных методов – сальважная лучевая терапия при местном рецидиве после РПЭ или, соответственно, сальважная РПЭ. Несмотря на то что сейчас неоадъювантная лучевая терапия проводится только в рамках исследований и не имеет убедительной доказательной базы, возможно, в скором времени она займет свою нишу среди методов лечения больных раком очень высокого риска или при наличии обширного экстракапсулярного компонента. Конечно, оперативное вмешательство после облучения связано с определенными техническими трудностями и осложнено замедленным заживлением тканей, но зато предложенный метод позволяет уменьшить площадь и дозу облучения по сравнению с таковыми при использовании лучевой терапии в качестве монотерапии.
Циторедуктивность. Этот термин, хорошо известный, например, из принципов лечения рака почки, до сих пор крайне редко используется применительно к раку простаты. По-видимому, это объясняется его слишком широким смыслом. Ведь к циторедуктивным операциям для местнораспространенного и метастатического рака простаты можно отнести не только РПЭ, но теоретически и все виды фокальной терапии, и даже трансуретральную резекцию простаты. С другой стороны, негласное правило «местное заболевание–местное лечение, системное заболевание–системное лечение» уже не принимается как аксиома. Доказательная база для определения рациональности РПЭ при наличии отдаленных метастазов крайне мала. Так, в исследовании целесообразности локальной терапии на основании базы данных SEER-Medicare из 4069 пациентов РПЭ была выполнена в 47 случаях! А 3827 пациентов остались без местного лечения [29]. Впервые термин «циторедуктивная РПЭ» был озвучен в работе [19], куда вошли пациенты с единичными костными метастазами.
Малоинвазивность. Стремление к увеличению радикальности лечения вовсе не означает необходимости увеличения инвазивности и как следствие – побочных эффектов там, где это не обосновано.
В вопросе хирургического лечения традиционно считалось, что позадилонная РПЭ предпочтительна на поздней стадии, так как обеспечивает хирургу максимум возможностей по преодолению возникающих технических трудностей и позволяет выполнить наиболее полную лимфаденэктомию. Однако к текущему моменту получена обширная доказательная база, свидетельствующая о том, что лапароскопические и роботические операции при должном опыте хирурга дают такие же онкологические результаты, что и открытая РПЭ [30]. При этом частота осложнений ниже, чем при открытой РПЭ [31]. Таким образом, нам видится, что в дальнейшем процент выполняемых лапароскопических и роботических РПЭ будет продолжать расти, а позадилонная РПЭ будет выполняться только при наличии веских противопоказаний к менее инвазивным операциям или в отсутствие технических возможностей в конкретном учреждении.
Весьма спорным оказывается вопрос о преимуществах функциональных результатов роботических и лапароскопических операций. По-видимому, большинство из этих достижений реализуется посредством более тщательного и аккуратного сохранения сосудисто-нервных пучков, но при раке высокого риска их сохранение по современным воззрениям недопустимо. Тем не менее не исключаем, что в свете ранее озвученного принципа циторедуктивности отдельным строго отобранным категориям больных раком простаты высокого риска будут выполняться нервосберегающие операции. В работах по этому вопросу не получено значительных различий в частоте положительного хирургического края и выживаемости в зависимости от нервосбережения [32]. В отдельных центрах выполняется экспресс-исследование замороженных срезов для уверенности в отрицательном хирургическом крае. При выявлении опухоли выполняется удаление сосудисто-нервного пучка с этой стороны [33]. Логичным видится выполнение таких пособий как минимум пациентам с изолированным повышением уровня ПСА более 20 нг/мл без других факторов высокого риска при тщательном обследовании.
Селективность лимфаденэктомии. Вопрос о необходимости лимфаденэктомии при РПЭ по поводу рака высокого онкологического риска не стоит. Зато относительно объема лимфаденэктомии любое решение – это баланс между потенциальной радикальностью и травматичностью операции. При полностью выполненной расширенной лимфаденэктомии нет уверенности, что удалены все лимфоузлы с метастазами, но нет и уверенности, что не были удалены лимфоузлы, не связанные с простатой. Ведь если бы удалялись только лимфоузлы, в которые происходит отток из простаты, после РПЭ с лимфаденэктомией не было бы такого известного осложнения, как лимфоцеле.
Потенциальным выходом из этого тупика может стать селективное удаление только тех лимфоузлов, в которые происходит отток из предстательной железы. Для их идентификации возможно использовать радиоизотопную и флуоресцентную диагностику. Оба метода показывают приемлемые результаты, но ввиду недостаточной доказательной базы пока не рекомендованы как стандартные.
Современная медицина может предложить массу достаточно эффективных методов лечения для больных раком простаты высокого и очень высокого онкологического риска. Их основная цель – не излечение, но длительный контроль заболевания. По нашему мнению, задача, достижение которой объединяет вышеизложенные тенденции, – это сохранение радикальности лечения при уменьшении его побочных эффектов и рациональное последовательное или параллельное применение разных методов.


