Введение. В течение многих лет простатит является одним из наиболее значимых и обсуждаемых урологических заболеваний [1–3]. По данным Национального института здоровья, более 25% мужчин с урологическими заболеваниями имеют симптомы простатита, что составляет около 9% мужской популяции [4].
Хронический бактериальный простатит (ХБП) характеризуется присутствием бактерий в секрете простаты [5]. Однако данный диагноз при использовании стандартных методов диагностики подтверждается лишь у 5–10% пациентов. Чаще выявляют простатит, имеющий абактериальный характер. При этом воспаление может возникать вследствие аутоиммунных процессов, химических воздействий, например при рефлюксе мочи, кроме того, возможно вторично-инфекционное происхождение заболевания, при котором инфекционный агент не определяется в секрете простаты/эякуляте вследствие механической обструкции протоков воспалительным отеком и фиброзом, сдавливающих их снаружи, и наличия фибринозных «пробок» внутри [6].
А. Г. Горбачев и соавт. в ходе клинико-экспериментального исследования продемонстрировали, что воспаление предстательной железы (ПЖ) первоначально развивается как асептическое [7]. При инициации простатита может произойти «сбой» в системе специфической и неспецифической защиты организма. В результате возникают условия для инфицирования простаты. Чем дольше и активнее протекает болезнь, тем больше вероятность перехода неинфекционного хронического простатита в инфекционный [8].
В отношении больных хроническим абактериальным простатитом (ХАП), согласно рекомендациям Европейской ассоциации урологов (European Association of Urology, EAU), может применяться антибактериальная терапия в течение 4–6 нед., α-адреноблокаторы, нестероидные противовоспалительные средства, ингибиторы 5-α-редуктазы, фитотерапия [2].
Важное значение в развитии хронического простатита (ХП) имеют иммунные защитные механизмы – как системные, так и локальные. Ряд авторов считают, что при данном заболевании снижается функциональная активность моноцитов/макрофагов, нейтрофилов, а также происходит нарушение баланса прои противовоспалительных цитокинов [9–11].
Открытие системы цитокинов и определение их биологической роли в развитии и функционировании иммунной системы и в патогенезе большого спектра заболеваний человека привели к развитию нового направления в иммунотерапии – цитокинотерапии [12].
В основе многих воспалительных заболеваний, в том числе ХП, лежит нарушение баланса между синтезом прои противовоспалительных цитокинов [9]. Вне зависимости от характера патологического фактора, запускающего воспалительный процесс в предстательной железе, важную роль в его развитии играет сам каскад иммунологических реакций [10, 11]. Особенно актуальны изменения иммунологических регуляторных механизмов при ХАП. Воспаление в этом случае может быть вторичным, иммунологически опосредованным, вызванным неизвестным антигеном или связанным с аутоиммунным процессом.
Одним из препаратов для проведения локальной цитокинотерапии является отечественный препарат Суперлимф®, разработанный на кафедре иммунологии Российского государственного медицинского университета (РГМУ) в 2001 г. Иммунотропный препарат Суперлимф® представляет собой естественный комплекс природных цитокинов, в котором определена активность фактора, угнетающего миграцию макрофагов, интерлейкина-1 (ИЛ-1), -6 (ИЛ-6), фактора некроза опухоли-α (ФНО-α, TNF-α (tumor necrosis factor alpha), трансформирующего фактора роста TGF-β (transforming growth factor β). Суперлимф® обладает выраженным противовирусным и противомикробным действиями (угнетает рост Staphylococcus aureus и Escherichia coli, его субстанция эффективнее пенициллина и оказывает прямое бактерицидное действие на резистентный к эритромицину штамм Streptocossus pyogenes). Препарат стимулирует функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов) и фагоцитоз, регулирует синтез цитокинов (ИЛ-1, -6, ФНО-α), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных микроорганизмов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров [13].
Многочисленные экспериментальные данные показали, что основные биологические эффекты препарата связаны с активацией клеток фагоцитарного ряда, фибробластов и усилением взаимодействий между этими клеточными элементами. Применение Суперлимфа® в гинекологии, хирургии, оториноларингологии, офтальмологии продемонстрировало быструю ликвидацию воспаления, активацию репаративных процессов, предупреждение грубого рубцевания, стимуляцию локальных клеточных и гуморальных механизмов [14–17]. В связи с этим, несмотря на арсенал имеющихся лекарственных средств, считаем патогенетически целесообразным включение цитокинов, в частности препарата Суперлимф®, в комплексную терапию ХАП.
В настоящее время существует несколько схем применения препарата: Суперлимф® 25 ЕД по 1 суппозиторию ректально 1 раз в сутки или Суперлимф® 10 ЕД по 1 суппозиторию ректально 2 раза в сутки утром и вечером. Длительность курса от 10 до 20 дней. Длительность курса может составлять до 20 дней [13]. Однако в описанных в литературе исследованиях по применению препарата в лечении ХБП и ХАП не проведена оценка клинической эффективности различных схем терапии препаратом.
Цель исследования: оценить эффективность различных схем применения иммуномодулирующего препарата Суперлимф® в составе комплексной терапии мужчин с ХАП.
Материалы и методы. В исследование включены 90 пациентов с ХБП категории IIIа, согласно классификации Национального института здоровья США (National Institutes of Health, NIH, 1995), в стадии обострения [5].
Диагноз всем пациентам установлен в ходе скринингового визита на основании анамнеза, результатов пальцевого ректального исследования простаты (ПРИ), трансректального ультразвукового исследования (ТРУЗИ), урофлоуметрии, анализа крови на простатоспецифический антиген (ПСА), микроскопии и бактериологического исследования секрета ПЖ.
Пациенты были включены в исследование согласно следующим критериям: суммарный балл по шкале Международной системы суммарной оценки заболеваний предстательной железы в баллах (International Prostate Symptom Score, IPSS) от 8 до 19, Индекс шкалы симптомов ХП (National Institute Of Health Chronic Prostatitis Symptom Index, NIH-CPSI) более 10 баллов, объем остаточной мочи (Vом) менее 50 мл, уровень ПСА в крови не более 4 нг/мл, абактериальный характер воспаления, отсутствие сопутствующей медикаментозной терапии, подписанное информированное согласие на участие в исследовании.
Критериями невключения служили конкременты мочевого пузыря и мочеточников, гематурия, подозрение на рак простаты или мочевого пузыря, отягощенный аллергический анамнез, оперативные пособия на органах малого таза, инфекции мочевыводящих путей, нейрогенная дисфункция мочевого пузыря, врожденные аномалии развития, онкологические и тяжелые сердечно-сосудистые заболевания, сахарный диабет.
На визите 1 была произведена оценка исходного состояния пациентов, соответствия их критериям включения и невключения, после чего методом случайной выборки они были распределены на 3 группы по 30 человек.
В группе сравнения (ГС) больным проводилась базовая комплексная терапия ХАП, которая включила поведенческую терапию, прием α1-адреноблокатора (тамсулозин 0,4 мг 1 раз в день), антибактериального препарата группы фторхинолонов (левофлоксацин 500 мг 1 раз в день) в течение 28 дней.
В основной группе 1 (ОГ1) пациентам проводилась базовая комплексная терапия в сочетании с препаратом Суперлимф® 25 ЕД по 1 суппозиторию ректально 1 раз в сутки в течение 20 дней.
В основной группе 2 (ОГ2) пациентам проводилась базовая комплексная терапия в сочетании с препаратом Суперлимф® 10 ЕД по 1 суппозиторию ректально 2 раза в сутки в течение 20 дней.
Оценка эффективности лечения проводилась через 14±2 дня (визит 2) и через 28±2 дня (визит 3) от начала лечения. Оценивали частоту мочеиспусканий в дневное и ночное время (ноктурия), средний балл по шкалам IPSS, оценки качества жизни (Quality of Life, QoL) и NIH-CPSI, максимальную скорость потока мочи (Qmax), объем предстательной железы (Vпж), объем мочеиспускания (Vмп), результаты микроскопического и бактериологического исследования секрета простаты.
Статистическую обработку результатов проводили с помощью программы MSExel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Cтьюдента) статистики. При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты. Пациенты обеих групп полностью соответствовали критериям включения в исследование, критериев невключения ни у кого выявлено не было. Результаты клинико-лабораторных и инструментальных исследований, полученных в трех исследуемых группах в течение 4 нед. терапии представлены в таблице.
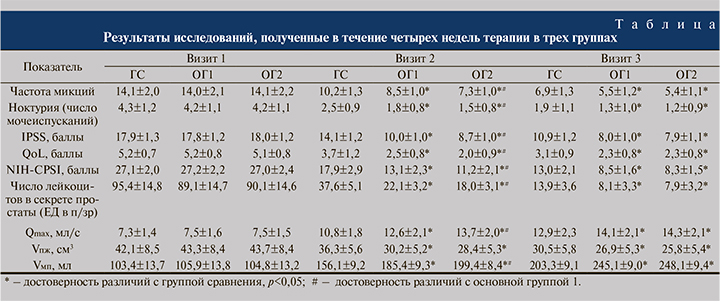
Исследуемые группы были однородными, результаты обследований, полученные до лечения, статистически значимо не различались (р>0,05). В течение периода лечения комплаентность пациентов составила 100%, все пациенты соблюдали назначения врача, случаев отказа от терапии не было. Кроме того, не было отмечено случаев нежелательных явлений, связанных с приемом препарата Суперлимф®. По данным шкалы NIH-CPSI, исходно у пациентов трех групп зарегистрированы выраженные симптомы ХП. Однако уже к визиту 2 через 14 дней терапии средний балл в ГС снизился на 33,9%, в ОГ1 на 51,8%, в ОГ2 на 58,5% от исходного значения (рис. 1).
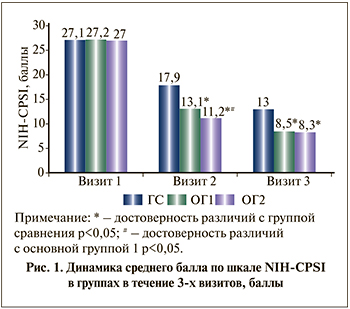
В группах, в которых пациентам был назначен Суперлимф®, результат по шкале NIH-CPSI был статистически значимо лучше, чем в ГС (p<0,001). Однако между основными группами также были выявлены статистически значимые различия (p=0,014). Через 28 дней терапии в ГС средний балл по шкале NIH-CPSI был статистически значимо выше (p<0,001), чем в ОГ1 и ОГ2, и составил 13±2,1.
Согласно данным, полученным по результатам заполнения шкалы IPSS к визиту 2, (день 14±2) средний балл в ГС уменьшился на 3,8 (21,2% от исходного значения). В ОГ1 данный показатель уменьшился на 7,8 балла (43,8% от исходного значения), в ОГ2 – на 9,3 балла (51,7% от исходного значения). Различия между показателями во всех трех группах были статистически значимыми (p<0,01) (рис. 2).
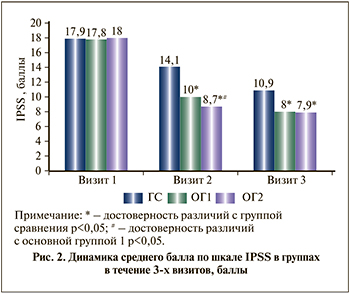
Результаты, полученные в ОГ1 и ОГ2 через 28 дней терапии, соответствовали легкой симптоматике по шкале IPSS, тогда как в ГС средний балл составил 10,9±1,2 и был статистически значимо выше, чем в обеих основных группах (p<0,001).
При оценке качества жизни по шкале, согласно опроснику QoL, исходно субъективная оценка пациентов варьировалась от неудовлетворительной до очень плохой. На фоне проведенной терапии на визите 2 в ОГ1 и ОГ2 значение данного показателя уменьшилось на 2,7 (51,9% от исходного значения) и 3,1 (60,8% от исходного значения) балла соответственно, тогда как в ГС средний балл был меньше на 1,5 (28,8% от исходного значения). Различия между тремя группами были статистически значимыми (p<0,001).
К визиту 3 сохранялись статистически значимые различия между ГС и основными группами (p<0,001). Результаты по шкале QoL в ОГ1 и ОГ2 были сходными и составили в среднем 2,3±0,8 балла.
Согласно полученным данным, через 14 дней терапии во всех трех группах зарегистрировано снижение количества дневных и ночных мочеиспусканий. В группах пациентов, принимавших Суперлимф®, число мочеиспусканий как в дневное, так и в ночное время было меньше, чем в ГС, различия были статистически значимыми (р<0,05). При этом в ОГ2 по сравнению с ОГ1 число дневных и ночных мочеиспусканий было меньше на 14,1 и 16,7% соответственно. Различия были статистически значимыми (р=0,001).
Через 28 дней терапии на визите 3 число дневных мочеиспусканий в ОГ1 и ОГ2 снизилось и составило 5,5±1,2 и 5,4±1,1 соответственно, тогда как в ГС значение данного показателя было выше и составило 6,9±1,3, что также послужило статистически значимым различием (р=0,011). Среднее число ночных мочеиспусканий в трех группах не превысило 2 раз за ночь. Однако необходимо отметить, что между показателями основных групп и группы сравнения сохранялись статистически значимые различия (p<0,01).
При анализе секрета ПЖ у всех пациентов выявлено повышенное число лейкоцитов. Через 14 дней терапии у пациентов ГС данный показатель снизился на 60,6% от исходного значения, в ОГ1 на 75,2%, в ОГ2 на 80%. Различия между тремя группами были статистически значимыми (p<0,001).
Через 4 нед. терапии число лейкоцитов в секрете простаты пациентов основных групп было в пределах нормальных значений, статистически значимых различий между ОГ1 и ОГ2 не было (p=0,128). В ГС данный показатель был статистически значимо выше (p<0,01) и составил 13,9±2,1 ЕД в поле зрения (п/зр).
Следует также отметить, что через 14 дней терапии в ГС у 7 (23,3%) пациентов, в ОГ1 у 4 (13,3%) и в ОГ2 у 3 (10%) пациентов в секрете простаты были выявлены бактерии (E. сoli) числом 102–103 КОЭ, чувствительные к фторхинолонам. С учетом незначимого (ниже порогового) количества бактерий принято решение не исключать пациентов из исследования.
За 28 дней терапии Vпж в ГС, ОГ1 и ОГ2 уменьшился на 27,6%, 37,9 и 40,9% от исходного значения соответственно. Значения показателя на визитах 2 и 3 в основных группах были статистически значимо меньше, чем в ГС (p<0,01).
В основных группах в ходе обследования на визитах 2 и 3 Vмп был статистически значимо больше, чем в ГС (p<0,01). При этом на визите 2 объем мочеиспускания в ОГ2 был больше, чем в двух других группах, и различия были статистически значимыми (p<0,01).
Среднее значение Qmax в группах исходно было снижено и варьировалось от 7,3 до 7,5 мл/с. Через 14 дней терапии скорость потока мочи у пациентов трех групп увеличилась. Наиболее значимое улучшение отмечено в ОГ2, где показатель вырос на 45% от исходного значения до 13,7±2,0, что статистически значимо отличалось от результатов других групп (p<0,05). Через 28 нед. терапии сохранялись статистически значимые различия между результатами в ГС и в основных группах.
Обсуждение. Лечение ХБП с установленным возбудителем, как правило, особых сложностей не вызывает [18–21]. Наиболее проблемным остается ХАП [6–10].
Некоторые авторы рекомендуют начинать лечение простатита категории IIIа с антибактериальной терапии продолжительностью 4–6 нед., которая почти в половине случаев позволяет снижать число лейкоцитов в секрете ПЖ. С другой стороны, подобные результаты могут говорить о том, что кажущийся абактериальным ХП на самом деле вызван микроорганизмами, не выявляемыми стандартными методами диагностики [22, 23].
Проведенный А. Thakkinstian et al. мета-анализ применения α-адреноблокаторов, антибиотиков и/или НПВС (19 исследований, n=1669) показал значительное снижение симптомов ХП по сравнению с плацебо со средними различиями общего NIH-CPSI от -10,8 (95% доверительный интервал [ДИ] от -13,2 до -8,3; р<0,001), -9,7 (95% ДИ от -14,2 до -5,3; р<0,001) и -1,7 (95% ДИ от -3,2 до -0,2; р=0,032) соответственно, при этом применение α-адреноблокаторов одновременно с антибиотиками привело к наибольшей разности NIH-CPSI (-13,6; 95% ДИ от -16,7 до -10,6; р<0,001) [22]. Авторы сделали вывод, согласно которому α-адреноблокаторы и антибиотики полезны для некоторых пациентов с ХП категории III и комбинированная терапия предпочтительна.
В проведенном нами исследовании все пациенты получали базовую комбинированную терапию антибактериальным препаратом и α-адреноблокатором. Согласно полученным результатам, проведенная в течение 4 нед. терапия позволила не только уменьшить число лейкоцитов в секрете простаты в ГС на 85,4% от исходного значения, но и уменьшить выраженность симптомов нижних мочевыводящих путей, таких как поллакиурия (на 51,1%) и ноктурия (на 55,8%), что в свою очередь привело к уменьшению среднего балла по шкале IPSS на 39,1%, а по шкале NIH-CPSI на 52%. Кроме того, по результатам проведенной 28-дневной терапии в ГС зафиксировано уменьшение Vпж на 27,6%, увеличение Vмп в 1,5 и Qmax в 1,8 раза.
Тем не менее показатели в ГС, полученные на визите 3, через 4 нед. после начала терапии не достигли нормальных значений, что в целом подтверждает мнение некоторых авторов о недостаточной эффективности стандартных методов терапии ХАП [24].
В настоящее время мультифакторный патогенез ХП продолжает активно изучаться [25].
L. Chen et al. в своем исследовании 2021 г. выявили существенное повышение иммунных медиаторов ИЛ-1, -6, ФНО-α и иммуноглобулинов в секрете ПЖ и семенной жидкости мужчин с ХП. Кроме того, авторы зафиксировали одновременное повышение уровня Т-клеток памяти и наличие аутореактивных Т-клеток, специфических к антигенам ПЖ в периферической крови этих пациентов. Подобные изменения, по мнению авторов, подтверждают аутоиммунный характер генеза хронического простатита [26].
L .J. Miller et al. (2002) в своем исследовании продемонстрировали, что уровни ИФН-γ, ИЛ-2 и -10 в спермоплазме пациентов с ХП значительно выше нормы, а уровень ИЛ-10 достоверно коррелирует с показателями качества жизни и тяжестью симптоматики ХП по шкале NIH-CPSI [27].
Новым трендом современной фармакотерапии инфекционно-воспалительных заболеваний является цитокинотерапия, основанная на применении природных цитокинов [12]. Их универсальные механизмы действия в отношении различных возбудителей, способность модулировать иммунный ответ, а также неспособность микроорганизмов формировать факторы резистентности по отношению к ним создают перспективу использования цитокиновых препаратов в составе комплексной терапии инфекционновоспалительных заболеваний.
Согласно результатам одного из первых российских исследований эффективности комплекса Суперлимф® при воспалительных заболеваниях предстательной железы, применение данного препарата совместно с фторхинолонами больными ХАП/синдромом хронической тазовой боли воспалительного характера оказалось эффективным в 72% наблюдений [14, 15].
Полученные в ходе исследования результаты в целом соответствуют данным литературы. В основных группах пациенты в сочетании с базовой стандартной терапией принимали препарат Суперлимф®. Уже на визите 2 через 14 дней после начала терапии выявлены статистически значимые различия между результатами основных групп и ГС по всем изучаемым показателям. Так, число дневных мочеиспусканий было меньше в ОГ1 и ОГ2 по сравнению с ГС на 16,7 и 28,4% соответственно, число ночных мочеиспусканий на 28 и 40%, средний балл по шкале IPSS на 29,1 и 38,3%, средний балл по шкале QoL на 32,4 и 45,9%, средний балл по шкале NIH-CPSI на 26,8 и 37,4%, число лейкоцитов в секрете простаты на 41,2 и 52,1%, Vпж на 16,8 и 21,8%, Vмп на 15,8 и 21,7%, Qmax на 14,3 и 21,2% соответственно. Сходные статистически значимые различия между основными группами и ГС были выявлены и на визите 3, при этом показатели в ОГ1 и ОГ2 через 28 дней терапии достигли нормальных значений.
Известно, что при различных обстоятельствах, таких как нарушение дренажа ПЖ, обтурация протоков ацинусов, снижение объема секрета, выделенного после массажа простаты, в отсутствие увеличения в нем числа лейкоцитов некоторые формы простатита симулируют ХП категории IIIb. Восстановление оттока секрета в результате лечения и различных манипуляций позволяет устанавливать воспалительную природу ХП (категории IIIА), а применение адекватных методов выявления инфекций (не только посева, но и других методов) – диагностировать бактериальный ХП (категории II) [8]. Некоторые авторы рекомендуют назначение α-адреноблокаторов пациентам c целью более эффективного дренирования ацинусов, в некоторых случаях это приводит к выявлению бактерий в секрете простаты в процессе лечения больных ХАП [23]. Данные механизмы могут служить одним из объяснений выявления бактерий в секрете простаты на визите 2 через 2 нед. терапии у 7 (23,3%) пациентов в ГС, у 4 (13,3%) в ОГ1 и у 3 (10%) в ОГ2. С одной стороны, с учетом данных литературы, согласно которым почти в половине случаев простатит категории IIIа имеет инфекционное происхождение, полученные результаты говорят об эффективности проведенной антибактериальной терапии. С другой стороны, меньшее количество пациентов с выявленными бактериями в секрете простаты может быть обусловлено антимикробным действием Суперлимфа® [13–15].
В данном исследовании был впервые проведен сравнительный анализ двух различных режимов терапии препаратом Суперлимф®. В ОГ1 пациентам были назначены ректальные свечи в дозе 25 ЕД 1 раз в день, в ОГ2 доза препарата была разделена на два приема по 10 ЕД 2 раза в день. Полученные результаты говорят о сопоставимой эффективности обоих режимов дозировки через 4 нед. терапии. Однако в ОГ2 через 2 нед. отмечено статистически значимо более выраженная положительная динамика всех показателей по сравнению с ОГ1, включая уменьшение выраженности симптомов нижних мочевыводящих путей, уменьшение среднего балла по шкалам IPSS и NIH-CPSI, повышение качества жизни по шкале QoL, уменьшение количества лейкоцитов в секрете простаты, увеличение эффективной емкости мочевого пузыря. Таким образом, применение Суперлимфа® в дозе 10 ЕД 2 раза в день позволяет уменьшать выраженность воспалительного процесса в более короткие сроки.
Склеротический продуктивный процесс в соединительной ткани чаще всего сужит следствием иммунного воспаления по типу реакции гиперчувствительности замедленного типа. Одним из ключевых звеньев в формировании продуктивного процесса воспаления в соединительной ткани является стимуляция функции фибробластов макрофагальными цитокинами. Согласно результатам недавнего мета-анализа, основанного на поиске в базах PubMed, Web of Science, Cochrane library и EMBASE до 10.04.2020 и включившего 24 клинических рандомизированных и 10 экспериментальных исследований, иммунные цитокин-опосредованные реакции играют важную роль в патогенезе ХП, способствуя персистенции внутрипростатического воспаления [28]. Исследование J. Ma и соавт. продемонстрировало более высокое содержание коллагена в ткани ПЖ при ее воспалении по сравнению с данными гистологического исследования здоровой ПЖ [29]. Соединительнотканные очаги на фоне воспалительного процесса, сопровождающегося отеком и нарушением микроциркуляции, самостоятельно способствуют усилению застойного синдрома в ПЖ, тем самым замыкая «порочный круг» и интенсифицируя течение заболевания. Таким образом, исходя из вышесказанного, следует, что, чем длительнее продолжительность воспалительного процесса в тканях, тем больше вероятность развития склеротических изменений в ткани ПЖ, которые в свою очередь приведут к усилению воспалительного процесса и рецидивам заболевания. В связи с этим результаты, полученные в основных группах, особенно в ОГ2, могут говорить о том, что применение Суперлимфа® в дозе 10 ЕД 2 раза в день позволит продлить безрецидивный период пациентов ХП. Однако, несмотря на патогенетическое обоснование и результаты 4-недельного исследования, преждевременно утверждать о наличии у препарата подобного эффекта. Целесообразно проведение более продолжительных исследований с оценкой отдаленных результатов терапии. Наблюдение за пациентами и выбор оптимальных схем лечения продолжается, отдаленные результаты будут опубликованы позже.
Заключение. Таким образом, применение препарата Суперлимф® пациентами с ХАП способствует уменьшению выраженности клинических симптомов заболевания в более короткие сроки, положительно влияет на динамику воспалительного процесса, что приводит к улучшению качества жизни больных данной категории. Наиболее эффективной схемой применения препарата пациентами с ХАП по результатам проведенного исследования является базовая комплексная терапия в сочетании с препаратом Суперлимф® 10 ЕД по 1 суппозиторию ректально 2 раза в сутки в течение 10 дней. На наш взгляд, препарат Суперлимф® может эффективно использоваться в составе комплексной терапии мужчин с ХАП. Кроме того, целесообразно проведение более продолжительных исследований с анализом отдаленных результатов терапии для оценки эффективности применения Суперлимфа® в профилактике рецидивов ХАП.


