Введение. Инфекции мочевыводящих путей (ИМП) являются одними из наиболее распространенных бактериальных инфекций. По меньшей мере 150 млн человек ежегодно страдают от ИМП [1–2]. Наиболее подвержены циститам женщины: приблизительно 60% женщин перенесли инфекцию мочевыводящих путей хотя бы раз в жизни [1], причем у каждой четвертой пациентки заболевание рецидивирует через несколько месяцев после, очевидно, успешного антимикробного лечения [3–4]. Пока неясно, почему рецидивирующие ИМП столь устойчивы. Причинами упорно рецидивирующего течения ИМП называли резистентность уропатогена к антибактериальным препаратам [5], внутриклеточную персистенцию возбудителя [6–7], бактериальную филаментацию и образование L-форм [1], Считается, что филаментация, по крайней мере частично, функционирует как врожденный защитный механизм против иммунной системы человека. В результате накопления дополнительной массы тела нити могут иметь повышенную способность адгезии к клеткам-хозяевам и улучшенную способность противостоять силам сдвига жидкости в мочевом пузыре.
Исследования с применением стерильных процедур сбора (надлобковая аспирация или трансуретральная катетеризация) показали, что у 50% женщин имеются бактерии в мочевом пузыре [8], многие авторы вообще отрицают стерильность мочи [9], при этом какие-либо симптомы могут отсутствовать. Но даже при наличии дизурии не всегда ясна ее причина. Развитие цистита может зависеть не только от присутствующих бактериальных таксонов, но и от бактериальной нагрузки, экспрессии факторов вирулентности и реакции иммунной системы хозяина [8]. Эпидемиологические исследования показывают, что доминирование лактобацилл (за исключением L. iners) защищает женщин от бактериального вагиноза (БВ) и от ИМП [4, 10]. Лактобациллы метаболизируют вагинальный гликоген в молочную кислоту, что приводит к низкому pH влагалища, что в свою очередь сдерживает многие другие урогенитальные микроорганизмы [10].
По запросу «цистит» в системе РИНЦ (e.library) на 08.10.2023 обнаружено 12 067 публикаций и 16 332 статьи учтены в системе Pubmed. Это является свидетельством того, что проблема цистита далека от своего разрешения.
Материалы и методы. Дизайн исследования: двухэтапное – открытое ретроспективное и проспективное многоцентровое рандомизированное сравнительное контролируемое. Всего в исследование были включены 425 пациенток с бактериальным вагинозом и 77 женщин, больных хроническим рецидивирующим циститом. У всех пациенток оценивали состояние вагинального биоценоза посредством молекулярно-генетического анализа соскоба со слизистой заднебоковых сводов влагалища. Материал помещали в пластиковые пробирки типа «эппендорф» объемом 1,5 мл, содержащие 300 мкл стерильного физиологического раствора. Выделение ДНК из биоматериала производили при помощи набора реагентов «Фемофлор Скрин» (ООО «НПО ДНК-Технология», Россия), затем запускалась программа амплификации с детекцией флуоресцентных сигналов в режиме реального времени. После этого автоматически рассчитывалось общее количество бактериальной массы, лактобацилл, каждого из условно-патогенных и патогенных микроорганизмов и по их соотношению определялось состояние влагалищного биоценоза. Фемофлор позволяет количественно определять нормофлору (Lactobacillus spp.), факультативно-анаэробные микроорганизмы, куда входят сем. Enterobacteriaceae, Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis+Prevotella bivia+Porphyromonas spp., Eubacterium spp., Sneathia spp.+Leptotrichia spp.+Fusobacterium spp., Megasphaera spp.+Veillonella spp.+Dialister spp., Lachnobacterium spp.+Clostridium spp., Mobiluncus spp.+Corynebacterium spp., Peptostreptococcus spp. и Atopobium vaginae; дрожжеподобные грибы в виде Candida spp., микоплазмы (Mycoplasma hominis и Ureaplasma (urealyticum+parvum), а также патогенные микроорганизмы – Mycoplasma genitalium.
Биоценоз влагалища определяли как нормоценоз при содержании лактобацилл в количестве не менее 80% от общей бактериальной массы (ОБМ). Выделяли абсолютный нормоценоз – при доминировании лактобацилл (доля более 80% от ОБМ); ассоцианты микробиоценоза (Ureaplasma spp., Mycoplasma hominis, Candida spp.) отсутствуют или определяются в количестве менее 104 ГЭ/мл, и условный нормоценоз – вариант микробиоценоза влагалища, характеризующийся преобладанием лактобацилл (доля более 80% от ОБМ), но также присутствуют Ureaplasma spp., и/или M. hominis в количестве более 104 ГЭ/мл. Условный нормоценоз смешанной этиологии допускал наряду с преобладанием лактобацилл (доля более 80% от ОБМ) присутствие Candida spp. и условно-патогенных микоплазм (Ureaplasma spp., M. hominis) в количестве более 104 ГЭ/мл.
Анаэробный дисбиоз определяли как вариант микробиоценоза влагалища, характеризующийся доминированием облигатно-анаэробных бактерий с одновременным снижением доли Lactobacillus spp. При умеренном анаэробном дисбиозе доля Lactobacillus spp. и доля анаэробных бактерий колебались в диапазоне от 20 до 80% от ОБМ. При выраженном анаэробном дисбиозе доля Lactobacillus spp. была ниже 20%, а доля анаэробных бактерий превышала 80% от ОБМ.
Аэробный дисбиоз определяли как вариант микробиоценоза влагалища, характеризующийся преобладанием факультативно-анаэробных бактерий (аэробов) при соответствующем снижении доли Lactobacillus spp. В зависимости от степени выраженности выделяли умеренный аэробный дисбиоз, когда доля Lactobacillus spp. и доля факультативно-анаэробных бактерий колебались в диапазоне от 20 до 80% от ОБМ, и выраженный аэробный дисбиоз, когда доля Lactobacillus spp. была ниже 20%, а доля факультативно-аэробных бактерий превышала 80% от ОБМ [11].
Обследование больных циститом включало самостоятельное заполнение русскоязычной версии шкалы симптомов острого цистита Acute Cystitis Symptom Score (ACSS), общий анализ мочи, посев мочи на микрофлору. Для микробиологического исследования использовали времяпролетную масс-спектрометрию на масс-спектометре Microflex (Германия Bruker). Для части культур видовая идентификация и определение антибиотикорезистентности проводились на комбинированных панелях BD PhoenixTM для грамотрицательных, грамположительных микроорганизмов и стрептококков с применением автоматической системы идентификации микроорганизмов и определения чувствительности к антибактериальным препаратам Phoenix 100, США; Becton Dickinson. Для стандартизированного диско-диффузионного метода использовали диски, импрегнированные антибиотиками, агар Мюллера–Хинтона и диспенсеры для нанесения дисков Bio-Rad, США.
Больным циститом проводили измерение локальной микроциркуляции посредством лазерной допплерфлоуметрии (ЛДФ) в области наружного отверстия уретры и на уровне середины уретры со стороны влагалища при помощи прибора ЛАКК-02 (НПП «Лазма», Россия); определяли динамику индекса микроциркуляции (ИМ) и изменение в процессе лечения коэффициента вариации Kv.
После этого пациентке назначали базовую терапию и методом случайных чисел распределяли в одну из групп:
- контрольная группа сравнения (ГС) – 17 человек (получали только базовую терапию: фосфомицин 3,0 однократно на ночь+фурагин 100 мг после еды 3 раза в день в течение 5 дней);
- 1-я основная группа (ОГ-1) – 29 человек, которые получали базовую терапию плюс суппозитории Суперлимф® 10 ЕД 2 раза в день вагинально в течение 10 дней;
- 2-я основная группа (ОГ-2) – 31 человек, которые получали базовую терапию плюс суппозитории Суперлимф® 10 ЕД (утром ректально) и Ацилакт Дуо (вечером вагинально) в течение10 дней.
Суперлимф® представляет собой естественный комплекс природных антимикробных пептидов и цитокинов – универсальных стимуляторов иммунной системы, секретируемых лейкоцитами периферической крови свиней. Суперлимф® обладает противовирусным, противомикробным и фунгицидным действями, а также является иммуномодулятором [12–14].
Ацилакт Дуо – комбинированное средство, содержащее наряду с цитокинами ацидофильные бактерии (Lactobacillus acidophilus 107).
Контрольное обследование проводили по завершении курса лечения.
Статистический анализ. Результаты исследования были обработаны с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office, 2007. Все количественные данные описывались как среднее (М)±стандартное отклонение (SD). При описании качественных данных использовали абсолютные значения (n) и проценты (%). Гипотеза об отсутствии статистически значимого влияния фактора отвергалась при р>0,05.
Результаты. Среди 425 пациенток с бактериальным вагинозом 78 (18,3%) предъявляли жалобы на различные нарушения мочеиспускания, но лишь у 21 пациентки (4,9% от всех больных с дисбиозом влагалища и 26,9% от имеющих дизурию) был установлен диагноз цистит. Во всех случаях это было обострение хронического заболевания. Возраст пациенток с бактериальным вагинозом (БВ) колебался от 21 года до 48 лет, в среднем 36,4±5,9 года. Средний возраст больных БВ, коморбидных с хроническим циститом, составил 48,5±6,4 года, различие статистически значимо. Среди коморбидных пациенток был установлен умеренный анаэробный дисбиоз у 8 (38,1%), выраженный анаэробный дисбиозу 9 (42,9%) женщин, и у 4 (19,0%) пациенток диагностировали умеренный аэробный дисбиоз.
Среди 77 больных хроническим циститом заболевание было верифицировано микробиологически у всех, спектр уропатогенов представлен в табл. 1.
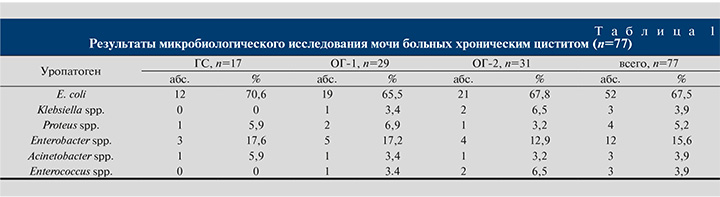
Как следует из табл. 1, ведущим уропатогеном была E. coli, частота которой колебалась в группах от 65,5 до 70,6%. На втором месте по частоте был Enterobacter spp. Ни один изолят не имел полной чувствительности к антибактериальным препаратам, преобладала резистентность к фторхинолонам (46,7%) и амоксиклаву (44,1%). К препаратам базовой терапии чувствительность микрофлоры была сохранена.
По шкале симптомов цистита ACSS у всех пациенток во всех группах сумма баллов превышала пороговый уровень; статистически значимые различия между группами отсутствовали, что демонстрирует рис. 1.
При исследовании биоценоза влагалища установлено, что среди 77 больных хроническим циститом исходно нормоциноз присутствовал у 32 (41,6%) пациенток, умеренный анаэробный дисбиоз выявлен у 27 (35,1%) женщин, выраженный анаэробный дисбиоз обнаружен у 14 (18,1%) и у 4 (5,2%) диагностирован умеренный аэробный дисбиоз. Таким образом, 45 (58,4%) больных хроническим циститом имели нарушение микробиоценоза влагалища.
По завершении терапии положительные результаты отмечены во всех группах больных. Эрадикация возбудителя в полном объеме наступила у 15 (88,2%) пациенток, получавших только базовую терапию, у остальных двух по-прежнему высевался Enterobacter spp., но в предельно низкой концентрации – 102 КОЕ/мл. В ОГ-1 и ОГ-2 роста микрофлоры не обнаружено соответственно у 27 (93,1%) и 28 (90,3%) пациенток, в остальных пяти наблюдениях выявлен клинически незначимый (102 КОЕ/мл) рост уропатогенов: по одному наблюдению Klebsiella spp., Proteus spp., Enterococcus spp., Enterobacter spp. и E. coli.
Таким образом, комбинированная этиотропная терапия показала отличные непосредственные результаты. Однако при анализе динамики симптомов по шкале ACSS установлены статистически значимые различия между группами (рис. 2).
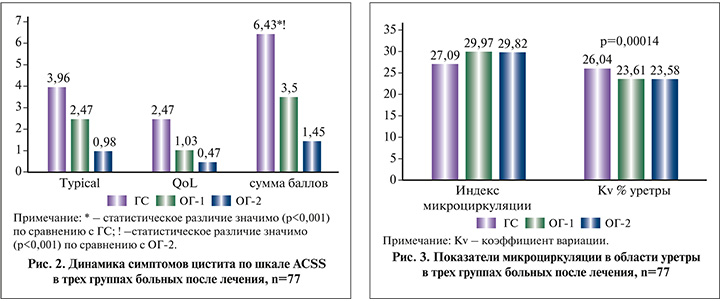
Сопоставление показателей микроциркуляции в области уретры по завершении терапии также убедительно показало превосходство основных групп по сравнению с контрольной, хотя и не выявило статистически значимого различия между основными группами, получавшими ректальные и вагинальные суппозитории Суперлимф®. Результаты показаны на рис. 3.
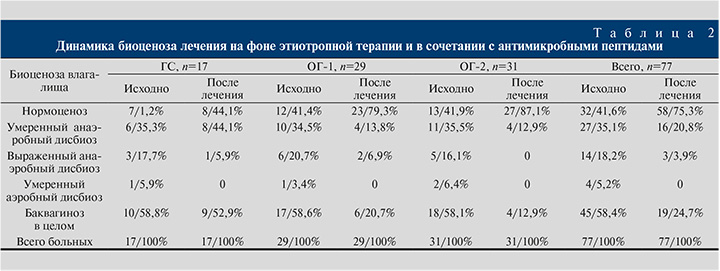
Динамика биоценоза влагалища показана в табл. 2. Наилучшие результаты (нормоценоз в 87,1% наблюдений) продемонстрировала ОГ-2, пациентки которой наряду с ректальными суппозиториями Суперлимф® получали Ацилакт Дуо вагинально. В ГС доля больных нормоцинозом практически не изменилась – исходно 7/41,2%, после лечения – 8/47,1%. В ОГ-1, пациентки которой получали только Суперлимф® вагинально, доля больных нормоцинозом увеличилась почти вдвое: с 12/41,4% до 23/79,3%.
Обсуждение. Рост резистентности уропатогенов, эволюция E. coli, приведшая к кардинальному изменению ее свойств (высокая способность к адгезии к уротелию, внутриклеточная персистенция, формирование дормантных форм), все более затрудняет подбор антибактериальных препаратов для лечения больных инфекциями мочевыводящих путей. Как выход из сложившейся ситуации может быть назначение комбинированной антибактериальной терапии [15, 16]. Ранее был популярен комбинированный препарат бисептол, сейчас фармацевтические фирмы все чаще выводят на рынок не монопрепарат, а комбинацию современных антибактериальных средств, например, цефоперазон и сульбактам.
Традиционно считается незыблемой ассоциация между бактериальным вагинозом и хроническим циститом.
O. H. Harmanli и соавт. [17] из 129 пациенток гинекологического приема у 67 (51,9%) диагностировали БВ. Среди больных с БВ у 15-и (22,4%) был рецидивирующий цистит, а среди гинекологических больных без БВ воспаление мочевого пузыря диагностировали лишь у 6 (9,7%). По данным И. В. Косовой и соавт. [18], среди 75 женщин с хроническим циститом в возрасте от 19 до 76 лет нарушения микробиоценоза влагалища выявлены у 47 (62,7%), причем умеренный дисбиоз влагалища диагностирован у 25 (33,3%) женщин, а выраженный дисбиоз – у 22 (29,3%) пациенток. Авторы обнаружили статистически значимую корреляцию между наличием дисбиоза влагалища и числом рецидивов цистита (r=0,310; p=0,007). Также было установлено, что дисбиоз влагалища достоверно чаще встречается у возрастных больных хроническим циститом, находящихся в менопаузе. Авторы заключают, что нарушение микрофлоры влагалища повышает риск развития и способствует более тяжелому течению цистита. Ю. С. Ковалёва и соавт. [19] установили, что у 79,5% пациенток с хроническим циститом имелся отягощенный гинекологический анамнез, включая БВ.
A. H. Sumati и соавт. [20] обнаружили БВ у 119 (68,39%) из 174 обследованных женщин; у 58 (48,7%) из них также был диагностирован хронический цистит.
Авторы полагают, что ассоциация БВ с инфекцией мочевыводящих путей, и наоборот, вероятно, обусловлена повышением рН влагалища и снижением количества вагинальных лактобактерий, продуцирующих лактат и перекись водорода. Частые половые контакты также способствуют повышенному риску развития как БВ, так и цистита. С учетом взаимосвязи этих заболеваний рекомендуют всех больных БВ обследовать на инфекции мочевыводящих путей, а у пациенток с ИМП – исключать БВ.
V. L. Handa и соавт. [21] недавно опубликовали всеобъемлющую главу «Does Bacterial Vaginosis Contribute to Urinary Tract Infection?» («Способствует ли бактериальный вагиноз инфекции мочевыводящих путей?»), являющуюся частью тематического сборника по инфекциям женских половых путей. Авторы подчеркивают, что имеющейся научной информации недостаточно, чтобы делать какие-либо безапелляционные выводы. Ограниченные данные позволяют предположить, что БВ может повышать восприимчивость к ИМП и, напротив, вагинальная микробиота с преобладанием лактобацилл может защищать от этих инфекций. Однако в настоящее время клиницисты мало что могут предложить пациентам для изменения связи между БВ, вагинальным микробиомом и ИМП. Нет никаких доказательств в поддержку лечения БВ антибиотиками с целью снижения заболеваемости ИМП. Дополнительные исследования роли БВ и вагинальной микробиоты в патогенезе ИМП оправданны и могут в долгосрочной перспективе привести к разработке новых методов лечения инфекций мочевыводящих путей и улучшения здоровья мочеполовой системы женщин.
Полученные нами данные также противоречивы. С одной стороны, ИМП у больных БВ выявлены всего в 4,9% наблюдений, с другой случаев БВ диагностирован у 58,4% больных хроническим циститом. Возникает вопрос: что первично? Быть может, многократные повторные курсы антибиотикотерапии по поводу цистита привели к развитию БВ, а не нарушение микробиоты влагалища способствовало развитию цистита? Такая диспропорция может быть объяснена и тем, что цистит манифестирует более демонстративно, чем БВ, на клинические проявления которого женщина не всегда обращает должного внимания, и пациентка обращается к врачу по поводу цистита, а БВ выявляют как вторичное заболевание или не диагностируют вовсе.
N. M. Gilbert и соавт. [22] предложили в качестве модели одного из механизмов ИМП активацию латентных внутриклеточных резервуаров E. coli в слизистой мочевого пузыря. Воздействие G. vaginalis на мочевыводящие пути в результате сексуальной активности приводит к отслоению эпителия мочевого пузыря, после эксфолиации кишечная палочка выходит из внутриклеточных резервуаров в просвет мочевого пузыря и вызывает воспаление. Таким образом, ИМП может быть вызвана кратковременным, но сильным воздействием на мочевыводящие пути вагинальных бактерий, которые сами по себе не являются «уропатогенными» в классическом смысле.
Эта парадигма «скрытого патогенеза» может применяться к другим латентным инфекциям (например, к туберкулезу) или к заболеваниям, которые в настоящее время определяются как неинфекционные, потому что рутинная культура не может обнаружить микробы признанного значения [23].
В открытом клиническом исследовании фазы II 28 участниц применяли вагинальные суппозитории, содержавшие Lactobacillus Crispatus, в течение 1 года либо каждые 2 дня, либо 3 раза в неделю. Первичной конечной точкой была частота ответа, оцениваемая по количеству эпизодов рецидивирующего цистита в течение года применения. Вторичными конечными точками были частота ответа, оцениваемая по эпизодам рецидивирующего цистита в течение 1 года после завершения периода введения; общее количество эпизодов рецидивирующего цистита до, во время и после введения; неблагоприятные события; изменения в спектре и степени выраженности бактериурии и динамика вагинального микробиома. В общей сложности 18 (86%) пациенток достигли эффективного ответа. Подавляющее действие вагинальных суппозиториев Lactobacillus на эпизоды цистита продолжалось до 1 года после введения последнего суппозитория. Исследование позволило сделать вывод: вагинальные суппозитории, содержащие штамм Lactobacillus сrispatus, эффективно предотвращают эпизоды рецидивирующего цистита как во время введения, так и в течение как минимум 1 года после введения [24–25].
В другом исследовании также было показано, что устранение факторов риска, к которым можно отнести дисбиоз влагалища, существенно сокращает число рецидивов и удлиняет безрецидивный период у женщин с РИМП [3].
И. А. Аполихина, Д. А. Малышкина [26] приводят результаты анонимного опроса 102 акушеров-гинекологов по поводу лечения больных циститом. Оказалось, что только в 42% случаев гинекологи отправляют пациентку с дизурией к урологу, а в 51% проводят лечение самостоятельно, что, безусловно, требует от них знания соответствующих клинических рекомендаций. Гинекологи отметили, что у 31% пациенток, получавших монотерапию антибиотиками, эффект был кратковременным и заболевание рецидивировало. Также авторы подчеркивают, что антибактериальная терапия приводит к дисбактериозу кишечника и влагалища, являющимуся фактором риска развития рецидива хронического цистита.
Мы полагаем, что различие результатов в группах нашего исследования обусловлено многокомпонентностью патогенеза цистита, влиянием на клиническую картину не только факта наличия или отсутствия патогена, но и степени нарушения микроциркуляции и биоценоза влагалища. Данная гипотеза подтверждена обнаруженными нами статистически значимыми различиями между группами по этим параметрам.
Заключение. Существуют онто-филогенетические предпосылки к хронизации инфекционно-воспалительного процесса в стенке мочевого пузыря у женщин. Мочепузырный треугольник имеет общее происхождение с влагалищем [4], что объясняет взаимное влияние дисбиоза влагалища и цистита. По нашим данным, у 4,9% больных БВ был диагностирован хронический цистит, но у 58,4% больных хроническим циститом присутствовал дисбиоз влагалища. Возможно, такое расхождение объясняется неполной диагностикой и недостаточным вниманием врачей к сопредельным областям организма; проведение обследования всех больных циститом на БВ, а всех больных БВ на цистит позволило бы получить истинную картину.
Применение комплекса антимикробных пептидов и цитокинов позволило существенно повысить двунаправленный эффект терапии, причем наилучшие результаты получены при ректальном применении суппозиториев Суперлимф и при вагинальном применении Ацилакт Дуо.



