Инфекционно-воспалительные заболевания органов мочеполовой системы занимают важное место в
структуре урологической патологии, особенно среди женщин: 80–90% всех больных хроническим пиелонефритом и циститом составляют женщины, 10–20% женщин хотя бы один раз за период взрослой жизни сталкиваются с эпизодом инфекции мочевой системы [1–4]. Проблема антибиотикотерапии больных с мочевыми инфекциями далека от своего разрешения ввиду недостаточной эффективности и массы побочных эффектов – токсико-аллергических и дисбиотических, а также из-за формирования антибиотикорезистентных микроорганизмов-возбудителей.
Инфекции урогенитального тракта существенно снижают качество жизни пациентов не только из-за
выраженного симптомокомплекса (боли, дизурии, диспареунии), но и из-за частых рецидивов заболевания; в частности, рецидивы цистита у 50% пациенток возникают более 3 раз в год. Факторы, ассоциированные с рецидивированием инфекций мочевыводящих путей, подразделяют на три группы: биологические, поведенческие и урогенитальные [3, 5].
К биологическим факторам относят:
1. Инфекции мочевыводящих путей в анамнезе.
2. Сахарный диабет 1 типа.
3. Дефицит эстрогенов.
4. Наличие генетической предрасположенности.
К поведенческим факторам относят:
1. Половой акт.
2. Использование в качестве метода контрацепциидиафрагмы.
3. Использование в качестве метода контрацепцииспермицидов.
4. Недавний курс антибиотикотерапии.
К урогенитальным факторам относят:
1. Недержание мочи.
2. Обструкция мочевыводящих путей.
3. Врожденные пороки развития.
4. Детрузорно-сфинктерная дисфункция.
5. Оперативные вмешательства.
Данные, полученные в ходе международного многоцентрового исследования ARESC, проведенного
в 2003–2006 гг., показали, что основным возбудителем инфекционно-воспалительных заболеваний
органов мочеполовой системы является кишечная палочка, значительно реже – другие микроорганизмы: Escherichia coli – в 77% случаев, Staphylococcus saprophyticus – в 4%, Klebsiella pneumoniae – в 3,5%, Proteus mirabilis – в 3%, другие – в 13% случаев [4]. Известно, что почки, мочеточники, мочевой пузырь, матка, предстательная железа – обычно стерильны. На слизистой оболочке передней уретры встречаются стафилококки, непатогенные нейсерии, сапрофитные трепонемы и коринеформные бактерии. Микрофлора наружных гениталий представлена эпидермальными стафилококками, коринеформными бактериями, зеленящими стрептококками, микобактериями (Mycobacterium smegmatis), Candida и энтеробактериями (напр., E. coli).
Кишечная палочка – широко распространенная условно-патогенная бактерия со сложной антигенной структурой, способная вызывать инфекционное поражение любой системы и органа. Однако
инфекции мочевыводящих путей вызваны особыми штаммами кишечной палочки – т. н. уропатогенной
E. coli.
Диагноз острого цистита, как правило, не вызывает затруднений и устанавливается на основании жалоб, данных анамнеза, результатов общего анализа мочи. В отдельных случаях возможно назначение лечения без лабораторного исследования. Однако при рецидивирующем цистите или неэффективности антимикробной терапии обязательно бактерилогическое исследование мочи с определением чувствительности возбудителя к антибиотикам. Кроме бактериологической верификации возбудителя очень важна комплексная диагностика сопутствующих заболеваний,
анатомических аномалий и функциональных расстройств, приводящих к нарушению уродинамики
нижних мочевыводящих путей.
В качестве эмпирической антибактериальной терапии острой инфекции мочевыводящих путей
рекомендованы:
• Фосфомицин.
• Фторхинолоны (норфлоксацин, ципрофлоксацин,левофлоксацин).
• “Защищенные” аминопенициллины.
• Цефалоспорины 2-го и 3-го поколений (оптимален цефиксим 400 мг в сутки).
Врачебные рекомендации пациенткам с рецидивирующим циститом обычно подразумевают употребление массы жидкости, у женщин с рецидивами после сексуальной активности – принудительное мочеиспускание сразу после полового акта, отказ от использования спермицидов и диафрагмы в качестве методов контрацепции. Однако контролируемые
клинические исследования не доказали эффективности данных подходов.
В Рекомендациях Европейской ассоциации урологов (2012) для профилактики рецидивов инфекции
мочевыводящих путей рекомендованы следующиеметоды [6]:
• Постоянная или посткоитальная антибактериальная профилактика.
• Применение иммуномодуляторов (в частности, уро-Ваксома).
• Применение пробиотиков – препаратов, содержащих живые культуры нормальной микрофлоры
человека (назначаются интравагинально).
• Местная терапия гормонсодержащими препаратами.
• Длительный прием экстракта или сока клюквы.
• Изменение образа жизни (ограничения в половой жизни, выборе нижнего белья и проч.).
Женщинам с рецидивирующим неосложненным циститом рекомендуется постоянная или посткоитальная антибактериальная профилактика триметопримом 50–100 мг в сутки, нитрофурантоином 50–100 мг в сутки или цефаклором, цефалексином, норфлоксацином, ципрофлоксацином или фосфомицином. В случае беременности рекомендован цефалексин 125–500 мг в стуки. Применение этой стратегии может осложняться дисбиозом кишечника, генитальным и орофарингеальным кандидозом, развитием прямой и перекрестной резистентности патогенной микрофлоры, токсическими поражениями печени, почек и кожи. Кроме того, постоянное применение посткоитальной антибиотикопрофилактики исключает возможность планирования беременности. Необходимо помнить, что при резистентности в популяции более 20% штаммов микроорганизмов к определенному антибиотику его прием нецелесообразен [7–14].
В сложившейся ситуации все большее внимание клиницистов привлекает профилактика рецидивирующих инфекционно-воспалительных заболеваний органов мочеполовой системы иммуномодулирующими препаратами. С позиций клинической иммунологии иммуномодулирующий препарат – это терапевтическое средство, назначаемое перорально и вызывающее эффекты повышения неспецифической резистентности и/или усиления специфической иммунной защиты макроорганизма. В большинстве случаев это так называемые лизаты – масса лизированных патогенных микроорганизмов, утративших жизнеспособность, но сохранивших специфические антигенные характеристики. Иммунотерапия бактериальными и грибковыми лизатами хорошо известна; в частности, в пульмонологии широко применяются такие препараты, как ИРС 19 (лизаты 18 бактерий), бронхо-мунал (8 лизатов), рибомунил (5 лизатов), бронхо-ваксом (8 лизатов), а в стоматологии – имудон (15 лизатов). В практике урологов и дерматовенерологов наиболее внушителен опыт применения уро-ваксома.
Уро-ваксом – оригинальный пероральный иммуностимулирующий препарат, являющийся лизатом 18 различных серотипов E. coli – самого распространенного возбудителя инфекций мочеполового тракта. Первоначально возникает вопрос: а зачем применять препарат на основе кишечной палочки, ведь она и так достаточно представлена в кишечной биопленке? Здесь целесообразно подчеркнуть, что в составе уро-ваксома присутствуют именно лизаты так называемых уропатогенных штаммов E. coli, специально отобранных из национальных коллекций микроорганизмов институтов Лондона и Пастеровского в Париже [15–17].
Иммуностимулирующий эффект уро-ваксома реализуется через сложное взаимодействие антигенраспознающих (дендритных) клеток слизистой оболочки кишечника и Т-клеток лимфоидной ткани кишечника (презентация антигена). Дендритные клетки через антигенраспознающие рецепторы (TLRs – Toll-like receptors, NLRs – The NOD-like receptors или Nucleotide Oligomerization Domain receptors, другие поверхностные рецепторы) активируют незрелые (или “наивные”) Т-клетки в скоплениях лимфоидной ткани кишечника (Пейеровых бляшках и гастроинтестинальной лимфоидной
ткани). В этой сложной цепочке участвуют также специализированные М-клетки, названные так
из-за специфической формы, характеризующейся инвагинацией, позволяющей “группировать” и пропускать антиген-презентирующие клетки. Прайминг запускает процесс специфической дифференцировки Т-клеток до Т-хелперов (Th) 1-го, 2-го и 17-го типов, в свою очередь синтезирующих спектр цитокинов. Решающее значение имеют интерлейкины (IL) -4, -5, -13, -17, -22, -10; интерферон гамма (IFNγ), туморнекротизирующий фактор альфа (TNFα) и фактор роста бета (TGFβ). Последние стимулируют выработку и целенаправленное действие факторов гуморального и клеточного иммунного ответа. Активированные фагоциты, последовательно выполняя хемотаксис и аттракцию, подвергают возбудитель киллингу, используя различные механизмы – кислородзависимые (опосредованные клеточной миелопероксидазой, супероксиддисмутазой и каталазой) и кислороднезависимые (опосредованные катионными белками, в том числе катепсином, лизоцимом, лактоферрином, протеолитическими и гидролитическими ферментами). Активированные В-клетки синтезируют антитела, вызывающие лизис патогенных бактерий или опсонизацию (адгезию антител на бактериальной мембране, облегчающую последующий фагоцитоз (см. рисунок).
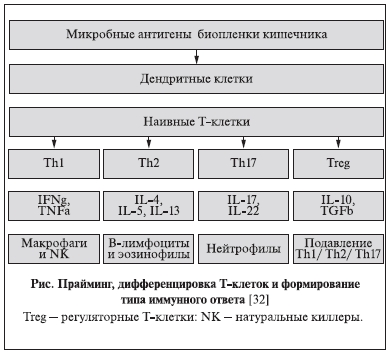
Усиление антимикробной защиты в мочеполовом тракте под воздействием уро-ваксома происходит в
двух направлениях – реализации специфического иммунного ответа (синтез специфических анти-E.
coli-антител) и увеличении неспецифической резистентности (макрофагальный и NK-фагоцитоз, синтез иммуноглобулина класса А). Направленность наработанного под воздействием уро-ваксома иммунного потенциала именно на мочеполовой тракт обусловлена подключением к презентации антигена “местных” макрофагов, функционирующих “под” базальной мембраной эпителиальной выстилки мочевыводящих путей и активизированных в очаге урогенитальной E. coli-инфекции.
Эффективность уро-ваксома даже при инфекции мочеполового тракта неуточненной этиологии (различные серотипы E. coli и/или возбудители, принадлежащие к другим родам бактерий) обусловлена, во-первых, наличием в составе препарата антигенов сразу 18 различных серотипов E. coli и, во-вторых, неспецифическим механизмом иммуностимулирующего действия [18–21].
Безопасность перорального иммуностимулирующего препарата уро-ваксом обусловлена высоким
качеством изготовления лизатов серотипов E. coli, обеспечивающим полное уничтожение жизнеспособности возбудителей и в то же время сохранение их специфических антигенных свойств. Важно, что безопасность уро-ваксома подтверждена результатами тщательно спланированных клинических исследований [22–24].
К настоящему моменту проведено 12 клинических исследований: 5 двойных слепых и 7 открытых, в
целом в них приняли участие 1259 пациентов [25– 28]. На основании этих данных в 2009 г. опубликован мета-анализ, результаты которого доказали, что применение уро-ваксома снижает частоту обострений инфекций урогенитального тракта и необходимость в повторной антибиотикотерапии, уменьшает число случаев лейкоцитурии на 45%, бактериурии на 33% и дизурии на 52%, уровень доказательности исследований 1А, степень рекомендации В [27]. Для других иммунотерапевтических препаратов крупные исследования третьей фазы не проводились. В небольших исследованиях второй фазы СтроВак и солко-уровак показали некоторую эффективность в режиме повторной реиммунизации (степень рекомендации С).
Поскольку иммуноактивная профилактика иэффективность уро-ваксома по сравнению с плацебо
доказаны в нескольких рандомизированных контролируемых исследованиях, препарат был включен в
рекомендации Европейской ассоциации урологов со степенью рекомендаций В [6]. В ходе специального исследования выявлено, что уро-ваксом способен компенсировать иммуносупрессию, вызванную применением антибиотиков [29].
Возможно ли применение уро-ваксома беременными? В инструкции к препарату указано, что “контролируемые исследования применения уро-ваксома при беременности не проводились, в то же
время изучение репродукции в экспериментальных исследованиях не выявило никакой опасности для
плода”. В Российской Федерации в связи с этим применять уро-ваксом беременными нельзя. Однако
в Швейцарии было проведено открытое пилотное исследование по эффективности и безопасности
уро-ваксома для беременных в 2003 г. [28]. В это исследование были включены беременные на сроке
16–28 недель с бактериурией с выраженностью более 105 КОЕ на 1 мл в средней порции мочи. Уро-ваксом применяли по 1 капсуле в день, конечными точками были число и длительность обострений инфекции мочевыводящих путей, выраженность дизурии и число курсов антибиотикотерапии. В результате было показано достоверное снижение частоты рецидивов инфекций мочевыводящих путей, которые сохранялись лишь у 19,4% пациенток, получавших уро-ваксом, против 52,5% в контрольной группе (р=0,002). Было также показано значительное уменьшение частоты дизурии – с 87% в начальной точке со снижением до 22,8% через 1 нед после окончания курса антибиотикотерапии и до 5% через 1 мес после начала исследования в группе уро-ваксома. Кроме того, было отмечено значительное уменьшение необходимости использования антибиотиков:
12,9% в группе получавших уро-ваксом против 55,7% в течение 6 мес беременности в контрольной группе (р=0,0002), причем продолжительность необходимого курса антибиотикотерапии снизилась на 37,5% (р=0,0016).
В то же время необходимо отметить ограничения эффективности уро-ваксома, обусловленные характером иммунопатологии для ряда пациентов.
Видимо, как и другие вакцины и лизаты, уро-ваксом будет недостаточно эффективен при так назы-ваемых критических иммунодефицитах, развивающихся при:
• длительной нейтропении (количество нейтрофилов в крови менее 500 кл/мм3 на протяжении
более 10 дней), обычно возникающей как результат химиотерапии гемобластозов;
• недавнем или текущем использовании иммуносупрессантов и/или антицитокинов (например,
циклоспорина, метотрексата, такролимуса, азатиоприна, инфликсимаба, ритуксимаба и др.);
• длительном (более 3 нед) использовании системных глюкокортикостероидов (в перерасчете на
преднизолон – более 0,3 мг/кг массы пациента в сутки);
• СПИДе;
• первичных иммунодефицитах (ОВИН – общей вариабельной иммунной недостаточности, селективном дефиците иммуноглобулина A и др.).
Уро-ваксом представляет собой капсулы, содержащие 6 мг активного вещества. Препарат разрешен
к применению пациентами с 4-летнего возраста. К настоящему времени в связи с отсутствием законченных клинических исследований беременных уроваксом официально не рекомендован к применению данной категорией больных. При лечении уро-ваксомом возможна его комбинация с другими препаратами, в частности с антибиотиками, витаминоминеральными комплексами, пробиотиками и др.
Регламентировано два основных способа применения уро-ваксома: первый – для лечения острого цистита по 1 капсуле ежедневно утром натощак не менее 10 дней вместе с противомикробным препаратом, второй – для профилактики рецидивов по 1 капсуле ежедневно утром натощак в течение 3 мес [29–31].
Таким образом, достижения клинической иммунологии и фармакологии последних лет внушают
существенный оптимизм в аспектах лечения пациентов с рецидивирующими инфекциями мочевыводящих путей. Отметим также, что большой интерес представляют результаты исследований, посвященных эффективности применения бактериальных лизатов при таких рецидивирующих инфекциях мочеполовой системы, как, например, простатит, пиелонефрит и др.



