Расстройства мочеиспускания являются причиной ежегодного обращения к врачу около 3 млн
женщин США [1, 2] Ведущей причиной дизурии является цистит, распространенность которого
составляет 15–20 тыс. на 1 млн человек в год [3]. Не менее 30% женщин испытывают по крайней
мере один эпизод цистита в течение жизни [4]. Диагноз “рецидивирующий цистит” подразумевает
два обострения цистита в течение 6 мес или три обострения в течение года.
Хронический цистит (ХЦ) – заболевание, характеризующееся длительно существующей воспалительной реакцией в ткани мочевого пузыря [5]. Воспаление мочевого пузыря превалирует в структуре заболеваний мочевыводящих путей [5–8]. Проблема стойкой дизурии у женщин остается
одной из наиболее актуальных в медицине. Это связано прежде всего с большой распространенностью
ХЦ среди женщин, составляющего до 30% от всех урологических заболеваний [9]. В той или иной
форме заболевание переносит каждая 4–5-я женщина, а 10% больных страдают рецидивирующим
циститом [10, 11].
По данным C. Perrotta и соавт. [12], от 40 до 50 % женщин хотя бы раз в жизни имели эпизод острого
цистита, а в постменопаузе – 8–10 %. Расстройства мочеиспускания у женщин, страдающих хроническими рецидивирующими инфекциями нижних мочевыводящих путей (НМП), – серьезная проблема, решения которой, несмотря на массу работ, посвященных этой теме, до сих пор не найдено [9, 13]. В России ежегодно регистрируется около 36 млн случаев острого цистита, в то время как заболеваемость им в среднем составляет 0,5–0,7 эпизода на 1 женщину в год. Представление о восходящем пути инфицирования женщин наиболее распространено [5]. Хронический рецидивирующий цистит в большинстве случаев встречается среди работоспособного контингента, может приводить к утрате трудоспособности и развитию неврозоподобного состояния, лишает женщин полноценного ночного сна и привычного образа жизни [14]. Для данного заболевания характерны возрастные колебания: в детородном возрасте оно встречается у 5% женщин, в период климактерия – у 10–15%, в пожилом возрасте – у 15–20% [15].
Важно помнить, что под “маской” цистита могут протекать следующие заболевания и синдромы:
• опущение влагалища и мочевого пузыря;
• камни нижней трети мочеточника;
• опухоль мочевого пузыря;
• туберкулез мочевого пузыря;
• интерстициальный цистит;
• инородное тело мочевого пузыря;
• гиперактивный мочевой пузырь.
Предрасполагающие факторы развития цистита [16]:
• естественные анатомо-физиологические особенности женского организма (короткий и широкий
мочеиспускательный канал, близость к естественным резервуарам инфекции – анусу и влагалищу);
• активная половая жизнь;
• сопутствующие гинекологические заболевания, изменяющие нормальную экосистему влагалища
(воспалительные процессы, гормональные нарушения);
• использование контрацептивов, содержащих спермициды;
• ослабление локальных антибактериальных механизмов мочеполовой системы;
• анатомические варианты и аномалии строения уретры;
• нарушения уродинамики НМП;
• низкий уровень гигиены;
• сухость слизистой оболочки в области уретры на фоне эстрогенового дефицита в климактерии.
В подавляющем большинстве случаев возбудителями острого цистита остаются E. coli, другие
грамотрицательные энтеробактерии, а также коагулазонегативные стафилококки [17]. Говоря о бактериурии, очень важно подчеркнуть, что обнаружение в моче даже первичных уропатогенов не является основанием постановки окончательного диагноза. Для подтверждения “истинной” бактериурии необходимо доказать, что концентрация бактерий в моче достаточно высока. Клинически значимой бактериурия считается в случае выявления монокультур E. coli и Staphylococcus saprophyticus в титре ≥103 КОЕ/мл, монокультур других бактерий в титре ≥104 КОЕ/мл, смешанных культур двух бактерий в титре ≥105 КОЕ/мл.
Механизмы защиты от инфекции мочевыводящих путей (ИМП): кислая реакция мочи, механическое
удаление бактерий потоком мочи, слизь в мочеиспускательном канале, клетки и антитела, задерживающие и уничтожающие бактерии.
Основными бактериальными агентами, которые обнаруживают в моче пациенток, страдающих
ИМП, по данным [18], являются E. coli, Proteus spp., Klebsiella spp., Staphylococcus spp. Результаты
международного исследования ECO-SENS Project, выполненного в 252 клиниках 16 стран Европы и
Канады, в ходе которого обследованы 4734 женщины с неосложненной ИМП, оказались практически
аналогичными [19] (рис. 1).
![Основные бактериальные возбудители ИМП по данным В. Рафальского и соавт. [18] 9а) и исследования ECO-SENS Project [19] (б)](https://lib.medvestnik.ru/apps/lib/assets/uploads/urology/2013/3/urol-3-2013-pic-94.jpg)
Wright и соавт. [20], также подчеркивают, что восходящее инфицирование мочевого пузыря, ослабление локальных антибактериальных механизмов мочеполовой системы, анатомические варианты и аномалии строения уретры, нарушения уродинамики НМП, низкий уровень гигиены – основные
факторы, вызывающие воспалительный процесс в НМП.
Важной проблемой является бессимптомная бактериурия у беременных, которая выявляется в 6 %
(2–11 %) случаев. В отношении бессимптомной бактериурии обнаружена зависимость ее частоты развития от социально-экономического положения беременных женщин. В отсутствие лечения у 40% из них развивается острый пиелонефрит. Бессимптомная бактериурия может приводить к преждевременным родам, анемизации беременной, преэклампсии, гипотрофии новорожденного и внутриутробной смерти плода [20, 21]. Риск рождения детей с низкой массой тела и преждевременных родов у беременных женщин с нелеченой бессимптомной бактериурией соответственно в 1,5 и 2 раза выше, чем у женщин без нее [22]. Бессимптомная бактериурия наиболее значима в развитии ИМП между 9-й и 17-й неделями беременности [23]. Адекватная антибактериальная терапия бактериурии на ранних сроках беременности предотвращает развитие пиелонефрита в 70–80% случаев, а в 5–10% – всех случаев невынашивания беременности [24].
За последнее время в литературе появились сообщения об увеличении числа пациентов с сохраняющимися расстройствами мочеиспускания, несмотря на нормализацию анализов мочи и ликвидацию бактериурии [25]. Эффективное этиотропное лечение цистита не всегда приводит к устранению нарушений мочеиспускания. В связи с этим для уточнения характера этих изменений и выбора дальнейшей тактики лечения таких больных представляется целесообразным проведение уродинамических исследований НМП [3, 26–31]. Выявляемые нарушения касаются как резервуарной, так и эвакуаторной функций мочевого пузыря. Причиной функциональных нарушений НМП могут быть различные процессы, сопровождающиеся изменением нервной регуляции их деятельности. Однако значительно чаще встречаются и имеют большее значение расстройства мочеиспускания вследствие хронической мочевой инфекции, вызывающие стойкие изменения нервно-мышечного аппарата детрузора, сфинктеров и тазового дна [31].
Отсутствие единого системного подхода к оценке расстройств мочеиспускания у пациентов, страдающих ХЦ, приводит к неправильной трактовке клинических проявлений заболевания и выработке ошибочной лечебной тактики [31–35]. При назначении лечения больным ХЦ часто не учитывается роль вегетативной нервной системы в регуляции сократительной функции мочевого пузыря. Согласно классической концепции нейрофизиологии, моторная функция мочевого пузыря обеспечивается антагонистическим взаимодействием симпатического и парасимпатического отделов нервной системы. На сегодняшний день известно немало способов коррекции нарушений функции НМП с применением холинергических и адренергических средств. Однако их системное действие делает их не всегда применимыми [36–44]. По данным некоторых авторов [44], возникновение стойкой дизурии у женщин с ХЦ обусловлено развивающимися микроциркуляторными, морфологическими и уродинамическими нарушениями, приводящими к нарушению функции уротелия и повышению его проницаемости. В связи с этим в качестве лечения ХЦ показано комплексное использование различных групп препаратов. По результатам выполненного нами уродинамического обследования пациенток, страдающих хроническим рецидивирующим циститом, нестабильность уретры выявлена в 45,68% случаев, гиперактивность детрузора – в 8,62%, сочетание гиперактивности детрузора и нестабильности уретры – в 22,4%, признаки детрузорно-сфинктерной диссинергии — в 25% [45].
Согласно рекомендациям Европейской ассоциации урологов (EAU, 2012) [46], к препаратам выбора
в лечении неосложненных инфекций НМП относятся триметоприм-сульфаметоксазол (TMP-SMX);
нитрофурантоин, фосфомицин, фторхинолоны.
Лечение острого неосложненного цистита преследует три основные цели: быстрое устранение клинических симптомов, эрадикацию возбудителя, профилактику реинфекций.
Антибактериальный препарат, используемый в лечении острого цистита, должен отвечать следующим требованиям:
• минимум соответствовать спектру антимикробной активности в отношении возбудителей острого
цистита;
• характеризоваться фармакокинетикой, позволяющей обеспечивать высокие концентрации в моче
при приеме препарата 1–2 раза в сутки;
• иметь высокий профиль безопасности.
Адекватная антибиотикотерапия является краеугольным камнем успешного лечения острого неосложненного цистита. Необходимо помнить, что прием антибактериального препарата нецелесообразен при резистентности к нему в популяции более 15–20% штаммов микроорганизмов.
Локальные данные по антибиотикорезистентности возбудителей внебольничных и нозокомиальных
ИМП – решающий фактор при выборе терапии. В России отмечаются высокий уровень резистентности уропатогенов к ампициллину и ко-тримоксазолу, вариабельная резистентность к фторхинолонам.
Как когда-то сказал Пауль Эрлих: “…лекарственная резистентность следует за лекарством, как преданная тень”. Для эффективного назначения антимикробных препаратов недостаточно данных о структуре возбудителей без данных о чувствительности уропатогенов в регионе. По данным международного многоцентрового исследования ARESC, устойчивость E. coli к фторхинолонам в России составляет 14,6%, в то время как во Франции, Германии, Австрии, Нидерландах и Венгрии – 1,6%, 3,7, 1,6, 3,4, 3,8% соответственно [47].
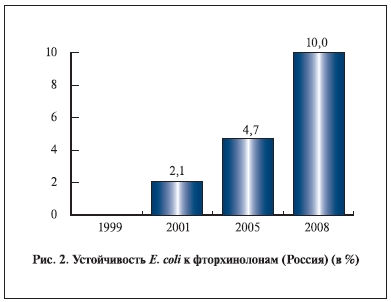
По данным В. В. Рафальского и соавт. (2008) [48], устойчивость кишечной палочки к фторхинолонам
в России с 1999 по 2008 г. выросла на 10% (рис. 2). При выборе антибиотиков для лечения неосложненной инфекции НМП необходимо учитывать ряд факторов. К ним относятся спектр и чувствительность уропатогенов, эффективность антибиотиков в клинических исследованиях, переносимость препаратов, побочные эффекты, стоимость и доступность препарата. Поскольку количество новых антибиотиков, находящихся на стадии разработки, невелико, единственный способ замедлить развитие резистентности – разумное применение антибиотиков [49].
Фосфомицин — антибиотик широкого спектра действия, активный в отношении большинства
аэробных грамотрицательных и грамположительных бактерий. В исследованиях in vitro показано,
что при той концентрации фосфомицина в моче, которая создается при его пероральном приеме,
большинство возбудителей ИМП, включая ванкомицинрезистентные энтерококки, становятся к нему
чувствительными [14, 50]. В целом частота выделения штаммов уропатогенной E. coli, устойчивой к
фосфомицину, составляет 0,7–1,0% с колебаниями между различными регионами – от отсутствия
резистентности до 1,5% [51]. Фосфомицин является высокоэффективным средством элиминации возбудителей мочевой инфекции за счет следующих механизмов: бактерицидного – вследствие угнетения одного из этапов синтеза клеточной стенки; антиадгезивного, препятствующего взаимодействию уропатогенных штаммов и клеток уротелия [52]. К достоинствам препарата также следует отнести отсутствие перекрестной аллергии с антибиотиками других групп, к недостаткам – частое развитие диареи после приема препарата. Препарат удобен в применении – однократно в дозе 3 г, при необходимости повторный прием через 24 ч. Немаловажным качеством также является отсутствие тератогенного, мутагенного и эмбриотоксического действий. Это позволяет назначать его детям и беременным женщинам. Фосфомицин не вызывает фототоксичности, поэтому его можно использовать в теплое время года. Применение фосфомицина трометамола показано в качестве не только лечения острого цистита, но и профилактики развития гнойно-воспалительных осложнений при некоторых урогинекологических и эндоскопических операциях и манипуляциях на нижних мочевыводящих путях, сопровождающихся установкой дренажей и катетеров.
Формирование резистентности штаммов микроорганизмов к наиболее часто применяемым антибиотикам заставляет корректировать терапию острого цистита. Более того, когда пациентке с инфекцией НМП грозит хотя бы небольшая опасность вовлечения верхних мочевыводящих путей или уже развившийся восходящий необструктивный пиелонефрит, спектр препаратов для ее лечения должен быть изменен. В данном случае возможно и оправданно использование цефалоспоринов. Цефиксим – цефалоспорин III поколения, обладающий бактерицидным эффектом в отношении основных уропатогенов, способностью накапливаться и сохраняться в высоких концентрациях в плазме крови, корковом и мозговом веществах почек даже через 12 ч после его приема [53]. Форма солютаб (диспергируемые таблетки) определяет достижение высоких концентраций препарата за меньшее по сравнению с обычными таблетками время. Длительный период полувыведения препарата обеспечивает возможность применения его 1 раз в сутки. Что немаловажно, препарат можно применять беременным. В экспериментальных исследованиях E. Halperin-Walega [54] концентрация препарата в тканях плода составила менее 1% от концентрации в биологических средах матери, в плазме крови плода была в 70 раз ниже, чем в плазме крови матери.
С учетом важности проблемы бессимптомной бактериурии у беременных использование данного препарата весьма перспективно.
Преимущества цефиксима:
• в условиях роста резистентности уропатогенов к фторхинолонам цефалоспорины III поколения
являются препаратом выбора;
• высокая активность в отношении внебольничных штаммов E. coli;
• высокие концентрации в моче и почечной паренхиме;
• безопасность применения во время беременности;
• минимальная кратность, удобство и многообразие способов приема.
Цефиксим независимо от режима приема (400 мг 1 раз в сутки или по 200 мг 2 раза в сутки) показал высокую бактериологическую и клиническую эффективность (до 98%) в отношении основных
уропатогенов, в некоторых исследованиях превосходя фосфомицин по чувствительности основных
бактериальных возбудителей (табл. 1, 2).
Таблица 1. Данные по эффективности цефиксима при неосложненной ИМП.
Таблица 2. Чувствительность микроорганизмов (в %) к основным антибактериальным препаратам,
применяемым при цистите (Garcia Garcia M. I. и соавт.) [60].
Согласно Российским национальным рекомендациям по антимикробной терапии и профилактике
инфекций почек, мочевыводящих путей и мужских половых органов (2012), цефиксим применяется:
• при лечении острого неосложненного цистита – в дозировке 400 мг/сут (5 сут), у беременных – 7 сут;
• при лечении обострений ИМП – по 400 мг/сут (7 сут);
• при проведении антимикробной профилактики – по 200 мг/сут – 6 мес.
В основе воспалительного инфильтрата в слизистой оболочке и подслизистом слое стенки мочевого
пузыря лежит повреждение межуточной субстанции соединительной ткани вследствие разных причин
как врожденного, так и приобретенного характера. Вне зависимости от этих причин исходом является
нарушение физиологической регенерации эпителия мочевого пузыря с нарушением барьерной функции переходного эпителия. Разрушение защитного слоя уротелия происходит по разным причинам: лучевая терапия, частые урогенитальные инфекции, недостаточность женских половых гормонов и т.д. Лечение ХЦ неэффективно без восстановления внутреннего слоя мочевого пузыря. При патологических процессах снижается концентрация гиалуроновой кислоты в тканях из-за нарушения баланса, замедляется процесс выздоровления. Гиалуроновая кислота – компонент гликозаминогликанового слоя, который находится в высоких концентрациях в субэпителиальном слое стенки мочевого пузыря и предназначен для защиты стенки мочевого пузыря от раздражающих компонентов мочи. Главная задача гликозаминогликанового слоя – защита собственной пластинки (lamina propria) и нервных окончаний от токсического действия мочи и всего, что в ней находится. Кроме того, гиалуроновая кислота связывает свободные радикалы и выступает в качестве иммуномодулятора. Для восстановления защитного внутреннего слоя мочевого пузыря разработаны и
выпускаются препараты на основе гиалуроновой кислоты и хондроитинсульфата, основным компонентом которого является гиалуроновая кислота.
В настоящее время на Российском фармацевтическом рынке представлен зарегистрированный препарат гиалуроновой кислоты УРО-ГИАЛ, разработанный MKC Laboratories. УРО-ГИАЛ – стерильный,
апирогенный, прозрачный, упруговязкий буферизованный физиологический растров гиалуроната
натрия неживотного происхождения (pH 6,5–7,5); 1 мл раствора содержит 0,8 мг гиалуроновой кислоты, 0,45 мг натрия дигидрофосфат моногидрата, 2 мг динатрия фосфата безводного, 8,5±0,05 мг натрия хлорида и деионизированную воду (q.s.). Препарат вводится в мочевой пузырь 1 раз в неделю, далее 1 раз в месяц при необходимости. Курс составляет от 4 до 12 инстилляций. Разумеется, при лечении рецидивирующих циститов до проведения инстилляций необходимо добиваться эрадикации возбудителя. Применение гиалуроновой кислоты стало новым перспективным и патогенетически обоснованным направлением в лечении рецидивирующих циститов, так как в настоящее время это единственный метод, способствующий восстановлению защитного слоя уротелия у этой сложной категории больных. Можно надеяться, что по мере накопления данных рандомизированных клинических исследований препарат УРО-ГИАЛ может занять ключевое место в противорецидивной терапии инфекций НМП.
В профилактике рецидивов ХЦ важным является определение тактики подхода к больным, страдающим данным заболеванием, а также выявление факторов риска развития заболевания. С целью профилактики рецидивов ИМП на сегодняшний день предложено множество стратегий. Использование различных методов профилактики ИМП позволяет удлинять период ремиссии заболевания.
Согласно рекомендациям EUA, с целью профилактики ИМП возможно применение следующих лечебных тактик: длительная профилактика с использованием низких доз антибиотиков, использование низких доз антибиотиков после полового акта. Длительная, или посткоитальная, антибактериальная профилактика рецидивов ИМП может использоваться только в случае безуспешности профилактических мер, например поведенческих, без использования антибиотиков (степень рекомендаций A). Лишь немногие антибиотики подходят для антибактериальной профилактики из-за проблем с резистентностью бактерий, приверженностью терапии, побочными эффектами.
Помимо применения низких доз антибиотиков с целью профилактики ИМП необходима разработка
следующих альтернативных стратегий:
• местная заместительная гормональная терапия в климактерическом периоде (эстриол);
• пробиотики (GR-1 и RC-14 лактобактерий; степень рекомендаций C);
• неспецифическая профилактика (подкисление мочи, сок клюквы и др.; степень рекомендаций C);
• иммуноактивная профилактика; единственным препаратом, рекомендуемым для иммунопрофилактики рецидивов ИМП у женщин, является УроВаксом (степень рекомендаций B).
Уро-Ваксом – капсулы по 6 мг, содержащие лиофилизированный бактериальный лизат 18 штаммов
E. coli, наиболее часто встречающегося возбудителя ИМП. Данный лекарственный препарат является
пероральным иммуностимулирующим средством, активирующим механизм иммунной защиты организма через лимфоидную ткань слизистой оболочки основных систем (MALT – mucosal associated
lymphoid tissue, GALT – gut-associated lymphoid tissue и UALT) и поддерживающим активность этих механизмов на высоком уровне [61]. Препарат стимулирует также гуморальный и клеточный иммунный ответ, в результате чего укрепляется естественная защита организма от инфекций НМП, вызванных различными микроорганизмами. Более того, Уро-Ваксом может обеспечивать защиту от более широкого спектра патогенов, являющихся возбудителями ИМП, а не только от микроорганизмов, используемых в его составе [62]. Препарат обеспечивает иммуноактивную профилактику за счет активизации собственных защитных сил организма, т.е. Уро-Ваксом усиливает реакцию со стороны иммунной системы человека. Концентрации иммуноглобулинов класса A и G у пациентов, принимающих Уро-Ваксом, в несколько раз превосходят таковые у больных, не принимающих данный препарат [24]. Препарат хорошо переносится и практически не имеет побочных эффектов. Положительная особенность препарата – возможность его применения как для лечения, так и с целью профилактики ИМП. В качестве лечения препарат используется совместно с антибиотиком по 1 капсуле в сутки в течение 10 дней, а для профилактики — по 1 капсуле в сутки в течение 3 мес. Частота выявления бактериурии к концу 3-го месяца применения Уро-Ваксома совместно с антибиотиком в 3 раза ниже, чем у пациентов, принимавших только антибиотик [63]. Уро-Ваксом сокращает частоту рецидивов инфекции НМП, количество, выраженность симптомов, а также необходимость применения антибиотиков.
Подводя итог, необходимо еще раз подчеркнуть, что лечение ИМП должно быть комплексным и
включать помимо антибактериальных и противовоспалительных препаратов средства, нормализующие функцию НМП (α1-адреноблокаторы, М-холиноблокаторы, антихолинэстеразные препараты в зависимости от изменений уродинамики), а также препараты местной и системной иммунопрофилактики, защиты уротелия от рецидива инфекции, а также местной заместительной гормонотерапии в климактерии.



