Введение. Большинство пациентов мужского пола с клиническими проявлениями атеросклероза различной локализации, в том числе с ишемической болезнью сердца (ИБС), имеют эректильную дисфункцию (ЭрД) [1]. ЭрД определяется как неспособность достигать и/или поддерживать эрекцию, достаточную для проведения полового акта [2]. В подавляющем большинстве случаев ЭрД обусловлена органическими причинами. Предрасполагают к развитию артериогенной ЭрД те же факторы, вызывающие заболевание коронарных артерий [3]. Общностью факторов риска ЭрД и сердечно-сосудистых заболеваний объясняется тот факт, что нередко эти патологические состояния развиваются параллельно [4, 5].
Оперативный метод прочно занял свое место в лечении больных ИБС: уже более 30 лет коронарное шунтирование (КШ) является наиболее часто выполняемой операцией во многих клиниках соответствующего профиля как в России, так и за рубежом. Доказано, что в результате КШ восстанавливается адекватный коронарный кровоток в пораженных артериях, ликвидируются симптомы ишемии, что способствует повышению продолжительности жизни пациентов, подвергшихся этому оперативному вмешательству [6, 7].
Возобновление сексуальной активности является одним из важных факторов, влияющих на психосоциальную реабилитацию пациентов после операции на сердце. Однако, несмотря на многочисленные исследования, посвященные изучению эндотелиальной и эректильной дисфункции у кардиологических больных, подвергшихся КШ, вопрос коррекции этих состояний обсуждается крайне редко.
Цель исследования: оценить влияние индуктора NO-синтазы импазы на функцию эндотелия и эректильную функцию больных, подвергшихся КШ.
Материалы и методы. В исследование вошли 127 мужчин со стабильной ИБС в возрасте 55,8±5,3 года. Всем больным было выполнено плановое КШ в условиях искусственного кровообращения. Все исследования с участием пациентов соответствовали этическим стандартам биоэтического комитета, разработанным в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека». Все пациенты подписывали информированное согласие на участие в исследовании. Протокол исследования одобрен локальным этическим комитетом НИИ КПССЗ СО РАМН.
 Критерии включения: пациенты со стабильной ИБС, которым планируется проведение КШ, в возрасте до 60 лет (работающие), подписавшие информированное согласие. Критерии исключения: подтвержденные эндокринные причины ЭрД; приобретенный первичный гипогонадизм; анатомические деформации наружных половых органов; снижение секреции тестостерона, обусловленное приемом лекарств; онкологические заболевания; инсульт в анамнезе; радикальные вмешательства на органах малого таза; декомпенсированные соматические заболевания.
Критерии включения: пациенты со стабильной ИБС, которым планируется проведение КШ, в возрасте до 60 лет (работающие), подписавшие информированное согласие. Критерии исключения: подтвержденные эндокринные причины ЭрД; приобретенный первичный гипогонадизм; анатомические деформации наружных половых органов; снижение секреции тестостерона, обусловленное приемом лекарств; онкологические заболевания; инсульт в анамнезе; радикальные вмешательства на органах малого таза; декомпенсированные соматические заболевания.
Оценку эффективности импазы проводили на амбулаторном этапе реабилитации. Пациентов обследовали за 5–7 дней до КШ, через 1, 6 и 12 мес после КШ.
Больные были рандомизированы на две сопоставимые по основным анамнестическим и исходным клинико-функциональным показателям группы: основную (n=60) и группу сравнения (n=67) (см. таблицу).
Пациенты группы сравнения проходили медицинскую реабилитацию по обычной программе, включившей базисную медикаментозную терапию (антиагреганты, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, статины), лечебную гимнастику, дозированную ходьбу, психотерапию, посещение занятий школы здоровья.
Больным основной группы в дополнение к базовой реабилитационной программе назначали индуктор NO-синтазы импазу ежедневно по таблетке в день сублингвально в течение 24 нед.
Клиническое обследование предусматривало оценку коронарной и сердечной недостаточности, лабораторные исследования (уровень липидов крови, тестостерона общего [набор СтероидИФА-тестостерон-01, Россия] и свободного методом иммуноферментного анализа [DRG Free Testosterone ELISA EIA-2924, Великобритания]), ЭхоКГ (эхокардиограф Sonos 2500 фирмы «Hewlett Packard»). Для регистрация ночных пенильных тумесценций (НПТ) использован аппарат NEVA System, посредством которого измеряли объемное электробиосопротивление сегмента ткани. Рассматривались эректильные события продолжительностью не менее 4 мин. Интерпретацию результатов осуществляли по алгоритму D. Knoll и K. Billups [8].
Для клинической оценки эндотелиальной функции использованы посткомпрессионные тесты на плечевой и кавернозных артериях. Посткомпрессионные тесты выполнены на ультразвуковом аппарате ALOKA ProSound SSD-α10 (Япония). В положении больного лежа на спине с помощью линейного датчика 7 МГц в режиме триплексного сканирования на расстоянии 3–4 см от корня полового члена измеряли диаметр обеих кавернозных артерий до и после 5 мин компрессии.
В качестве основного показателя был принят процент увеличения диаметра кавернозной артерии (ПУДКА), который рассчитывали по формуле: ПУДКА=(Dпк–Dдк)/Dдк 100%, где Dпк – диаметр кавернозных артерий после компрессии, Dдк – диаметр кавернозных артерий до компрессии. Показатели ПУДКА ниже 50% расценивали как проявление эндотелиальной дисфункции [9].
Для оценки системной эндотелиальной функции применяли посткомпрессионный тест на плечевой артерии по стандартизованной методике D. Celermajer и соавт. в модификации О. В. Ивановой [10].
О состоянии эндотелия судили также по его нитроксидпродуцирующей функции, определив уровень метаболитов оксида азота (нитриты и нитраты) в плазме крови с помощью реактива Грейса, согласно протоколу, утвержденному фирмой «R&D Systems» (США). Содержание эндотелина-1 (ЭТ-1) определено с использованием наборов Biomedica (Германия) методом твердофазного иммуноферментного анализа, согласно протоколу производителя. Регистрацию оптических плотностей и расчет результатов проводили на полуавтоматическом ИФА-анализаторе Униплан (Россия).
Эректильную функцию оценивали по 5-балльной шкале МИЭФ-5, при этом оценка 22–25 баллов свидетельствовала об отсутствии ЭрД, 17–21 – легкой ЭрД, 12–16 – умеренной, 5–10 баллов – тяжелой ЭрД [11].
Статистическую обработку проводили с помощью программы Statistica 6.0. Для принятия решения о виде распределения использовали критерий Шапиро–Уилка. Для каждой из непрерывных величин, имеющих нормальное распределение, рассчитывали среднее значение (М) и стандартное отклонение (SD). Проверку однородности двух выборок осуществляли с использованием критериев Манна–Уитни для несвязанных выборок и Вилкоксона – для связанных. Статистически значимыми признавали значения при р<0,05.
Результаты. В группе сравнения через 6 мес наблюдения прирост эректильной функции констатирован для 5 (8%) пациентов, ухудшение сексуальной активности – для 35 (52%), у 27 (40%) никаких изменений не выявлено. В целом нормализации показателей эректильной функции достигнуто не было. Через год после КШ доля пациентов с приростом эректильной функции уменьшилась до 7%, с ухудшением эректильной функции увеличилась до 56%, с отсутствием изменений уменьшилась до 37%.
В основной группе нормальная эректильная функция через 6 мес после КШ достигнута 7 (11%) пациентами. Прирост эректильной функции отмечен у 19 (32%) пациентов, не заметили каких-либо изменений эректильной функции 34 (57%) пациента. Однако через год после КШ доля пациентов с приростом эректильной функции уменьшилась до 21%, появились пациенты с ухудшением эректильной функции – 25%, уменьшилась доля пациентов, достигших нормальной эректильной функции и с отсутствием изменений до 7 и 47 % соответственно.
При сравнении групп пациентов с различными видами реабилитации оказалось, что у пациентов, получавших импазу, через 6 мес после КШ отмечено улучшение эректильной функции (по данным опросника МИЭФ-5) на 30%, тогда как у пациентов, прошедших традиционную реабилитацию, она уменьшилась на 10%. При этом обращает на себя тот факт, что средний балл по МИЭФ-5 у пациентов основной группы через 6 мес после КШ был статистически выше, чем у пациентов группы сравнения (рис. 1)
 Однако через год после КШ в основной группе отмечено снижение эректильной функции на 12% по сравнению с 6-месячными показателями. У пациентов группы сравнения спустя год после КШ также отмечено снижение эректильной функции на 7% по сравнению с показателями 6 мес. Следует отметить, что через год после КШ средний балл по МИЭФ-5 у пациентов основной группы все же был достоверно выше, чем у пациентов группы сравнения (см. рис. 1).
Однако через год после КШ в основной группе отмечено снижение эректильной функции на 12% по сравнению с 6-месячными показателями. У пациентов группы сравнения спустя год после КШ также отмечено снижение эректильной функции на 7% по сравнению с показателями 6 мес. Следует отметить, что через год после КШ средний балл по МИЭФ-5 у пациентов основной группы все же был достоверно выше, чем у пациентов группы сравнения (см. рис. 1).
Количество НПТ спустя 1 мес после КШ в обеих группах достоверно не изменилось (с 4±0,7 до 4,5±1 и с 4,2±0,7 до 3,8±0,9 в основной и группе сравнения соответственно; p≥0,05). Однако в основной группе через 6 мес после КШ отмечено достоверное увеличение количества НПТ по сравнению с исходными показателями (с 4±0,7 до 5,7±1,4; p=0,02), а через год – достоверное снижение данного показателя по сравнению с полугодовыми данными (с 5,7±1,4 до 4,4±1,1; p=0,02).
В группе сравнения через 6 мес после КШ выявлено достоверно значимое снижение количества НПТ по сравнению с исходными показателями (с 4,2±0,7 до 3,4±0,9; p=0,03). К году после операции сохранялась тенденция к уменьшению количества НПТ по сравнению с показателями, полученными в 6 мес (с 3,4±0,9 до 2,8±1,2; p≥0,05). Кроме того, через 6 мес и 1 год после КШ количество НПТ у пациентов основной группы было достоверно больше, чем у пациентов группы сравнения: 5,7±1,4 и 3,4±0,9 соответственно в 6 мес (p=0,002); 4,4±1,1 и 2,8±1,2 соответственно через год (p=0,001).
Показатели средней продолжительности НПТ у пациентов обеих групп достоверно не менялись в течение периоперационного периода. Однако у пациентов основной группы через 6 мес наблюдения средняя продолжительность НПТ была достоверно выше, чем у пациентов группы сравнения, – 18,9±6,1 и 11,8±5,7 мин соответственно (p=0,02). Спустя год после КШ эти различия нивелировались (14,8±6,2 и 11,5±5,8 мин соответственно; p≥0,05). Прирост объема пенильного кровотока в основной группе через 1 мес после КШ достоверно не изменился (с 144,5±15,5 до 132,8±17,1%; p≥0,05), однако к 6-му месяцу после КШ выявлен достоверный прирост данного показателя при сравнении с исходными показателями – с 144,5±15,5 до 168,1±28,9 % (p=0,02). Через год после операции достоверной динамики по сравнению с 6-месячными показателями не отмечено (168,1±28,9 и 154,7±20,7 %; p≥0,05).
Следует подчеркнуть, что через 6 мес и 1 год после КШ в основной группе данный показатель был достоверно выше, чем в группе сравнения (168,1±28,9 и 122,4±19,9 %; p=0,001; 154,7±20,7 и 124,6±14,8 %; p=0,02). Прирост объема пенильного кровотока через 1 мес после КШ в группе сравнения достоверно снизился по сравнению с исходными показателями (c 148,1±20,8 до 111,5±18,5 %; p=0,01). В дальнейшем достоверной динамики данного показателя не отмечено.
Показатель объема сосудистой зоны в основной группе достоверно улучшился к 6-му месяцу после КШ по сравнению с исходными показателями (с 22,3±4,3 до 26,8±4,4 см; p=0,04) и был достоверно выше, чем в группе сравнения (26,8±4,4 и 19,1±4,7 см соответственно; p=0,02). Через год данный показатель был также достоверно выше у пациентов, принимавших импазу, – 24,8±5 против 19,6±5,2 см у пациентов, не получавших импазу (p=0,02).
С учетом патогенетического механизма действия импазы при ЭрД, включившего повышение выработки NO эндотелием интересным представлялось изучить его эффективность в коррекции не только сексуальных нарушений, но и эндотелиальной дисфункции. В связи с этим следующим этапом была проведена оценка показателей эндотелийзависимой вазодилатации (ЭЗВД) в динамике периоперационного периода у пациентов с ЭрД в зависимости от вида реабилитации.
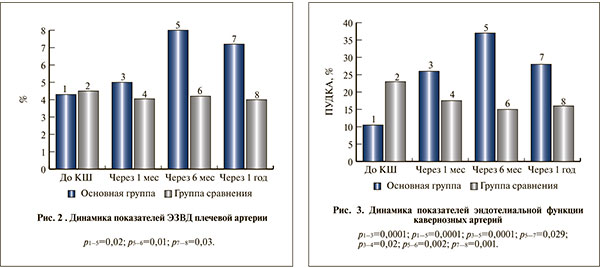
Исходные показатели больных обеих групп функционального состояния эндотелия как плечевой, так и кавернозных артерий, оцененные в пробе с реактивной гиперемией, перед КШ статистически значимо не различались. Показатели ЭЗВД через 1 мес после КШ в сравниваемых группах также не имели достоверных различий. Однако уже через 6 мес в группе пациентов, принимавших импазу, ЭЗВД была статистически значимо более высокой по сравнению с исходными данными. Кроме того, показатели ЭЗВД у них были достоверно выше, чем у тех, кто не получал импазу. К году наблюдения отмеченная тенденция сохранялась, однако различия между группами стали менее выраженными (рис. 2).
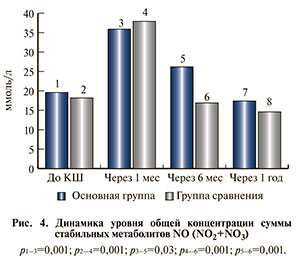
При исследовании динамики ПУДКА в пробе с реактивной гиперемией у больных группы сравнения имело место достоверное ухудшение этого показателя через 1 мес после КШ. Через 6 мес и 1 год после КШ достоверной динамики не выявлено. В основной группе через 1 мес после КШ данный показатель достоверно не изменился, что, возможно, связано с недостаточной продолжительностью приема импазы, однако через 6 мес констатировано достоверное увеличение ПУДКА. Через год ПУДКА статистически значимое снизился по сравнению с 6-месячными данными, однако как в 6 мес, так и в 1 год этот показатель был достоверно выше, чем у пациентов группы сравнения (рис. 3).
Как показала оценка лабораторных маркеров эндотелиальной дисфункции, общая концентрация суммы стабильных метаболитов NO через 1 мес после КШ значимо увеличилась в обеих группах. К 6-му месяцу наблюдения отмечено достоверное снижение концентрации суммы метаболитов NO в обеих группах, но все же выше она была у пациентов, получавших импазу. Через год после КШ достоверной динамики концентрации стабильных метаболитов NO не наблюдалось и различия между группами нивелировались (рис. 4).
При оценке динамики ЭТ-1 в основной группе спустя 1 мес после КШ достоверной динамики не выявлено (рис. 5). Однако уже через 6 мес после операции отмечено достоверное снижение концентрации ЭТ-1 по сравнению с исходными и месячными показателями. В группе сравнения через 1 мес после КШ выявлено достоверное повышение концентрации ЭТ-1. Через 6 мес наблюдалась тенденция к снижению концентрации ЭТ-1, но данный показатель был достоверно выше, чем у пациентов основной группы. Через год после КШ в обеих группах достоверной динамики данного показателя не было и различия между группами нивелировались.
В течение всего периода наблюдения не наблюдалось побочных эффектов и нежелательных взаимодействий импазы с кардиологическими препаратами.
 Обсуждение. Распространенность ЭрД среди больных ИБС, по разным данным, составляет от 44 до 75% [12, 13]. F. Monrorsi и соавт. [14] в ходе анкетирования 300 мужчин с ангиографически подтвержденной коронарной болезнью ЭрД выявили у 49% пациентов. Большинство пациентов мужского пола имеют снижение сексуальной активности как перед КШ, так, соответственно, и в послеоперационный период [15–17]. При этом полноценная и естественная сексуальная жизнь – важная составляющая здоровья мужчины независимо от его возраста. Именно нарушение эрекции нередко приводит к снижению самооценки мужчины, его качества жизни. Эндотелиальная дисфункция является связующим звеном между нарушениями эрекции и сердечно-сосудистыми заболеваниями [18].
Обсуждение. Распространенность ЭрД среди больных ИБС, по разным данным, составляет от 44 до 75% [12, 13]. F. Monrorsi и соавт. [14] в ходе анкетирования 300 мужчин с ангиографически подтвержденной коронарной болезнью ЭрД выявили у 49% пациентов. Большинство пациентов мужского пола имеют снижение сексуальной активности как перед КШ, так, соответственно, и в послеоперационный период [15–17]. При этом полноценная и естественная сексуальная жизнь – важная составляющая здоровья мужчины независимо от его возраста. Именно нарушение эрекции нередко приводит к снижению самооценки мужчины, его качества жизни. Эндотелиальная дисфункция является связующим звеном между нарушениями эрекции и сердечно-сосудистыми заболеваниями [18].
В 2001–2003 гг. было проведено рандомизированное плацебо-контролируемое исследование эффективности и безопасности импазы у пациентов с сердечно-сосудистыми заболеваниями с ЭрД. Было показано, что по способности улучшения эректильной функции импаза достоверно превзошла плацебо [19].
Результаты нашего исследования показали, что у пациентов, подвергшихся КШ, с наличием ЭрД прием импазы в течение 24 нед способствует оптимальной динамике выраженности ЭрД. Однако через год после КШ отмечается ухудшение эректильной функции, что свидетельствует о непродолжительном эффекте действия импазы и, возможно, требует более длительного ее назначения.
Кроме того, через 6 мес после КШ пациенты, получавшие импазу, имели лучшие показатели функциональной активности эндотелия как плечевой, так и кавернозных артерий по сравнению с пациентами, проходившими традиционную реабилитацию, однако к году наблюдения показатели так существенно уже не различались.
Результаты наших исследований свидетельствуют, что восстановительное лечение больных ИБС после оперативной реваскуляризации миокарда с включением импазы позитивно влияет на содержание уровня метаболитов NO, ЭТ-1, что отражается на функциональном состоянии эндотелия, которое характеризуется возрастанием вазодилататорных и уменьшением вазоконстрикторных свойств. Это согласуется с существующими данными о периферическом механизме действия препарата – восстановлении эндотелиальной функции [20]. Так, было показано, что использование импазы больными ИБС приводило к снижению содержания десквамированных эндотелиоцитов в крови, что говорит об улучшении метаболизма эндотелия сосудов всего организма [21].
В основе эффектов импазы лежит прежде всего улучшение функции эндотелия сосудов, т.е. препарат в отличие от других лекарственных средств воздействует не на следствие, а на причину развития ЭрД. Такие преимущества импазы, как достаточная эффективность, возможность сочетания с приемом кардиологических препаратов, отсутствие побочных эффектов и относительно низкая стоимость препарата, расширяют возможности фармакотерапии ЭрД.
Заключение. Особенности клинико-функционального статуса, в том числе дисфункция эндотелиальной функции мужчин с ИБС и ЭрД, подвергшихся КШ, обосновывают необходимость включения в послеоперационную реабилитационную программу препарата импаза, что позволяет уменьшать выраженность эректильной, эндотелиальной дисфункции и улучшать прогноз заболевания для данной категории пациентов.




