Введение. В настоящее время разрабатываются и изучаются различные малоинвазивные методики лечения небольших по размеру новообразований почек: воздействие фокусированными ультразвуковыми волнами высокой интенсивности (HIFU); коагуляция с помощью микроволновой термотерапии, лазерной интерстициальной коагуляцией, криотерапией и радиочастотной аблацией [1, 2]. Несмотря на то что предварительные результаты использования малоинвазивных методик воздействия на ткань новообразований почек многообещающие, все методики имеют общий недостаток: отсутствие контроля над происходящими процессами в тканях органа в ходе процедуры и после нее, что может обусловить, с одной стороны, ее нерадикальность, с другой – чрезмерное повреждение почечной паренхимы [3, 4]. Потенциальными преимуществами малоинвазивных пункционных технологий являются короткие сроки госпитализации, раннее возвращение к нормальной активности, потенциально меньшие затраты на лечение и возможность лечения пациентов с высоким операционным риском.
Лазер является источником коллимированного, монохроматического, когерентного света, излучаемого активизированным материалом лазера (полупроводником, кристаллом, газом или красителем) [5]. Ключевым фактором, определяющим возможность применения лазерного излучения для вышеуказанной цели, служит взаимодействие лазерного луча и тканей органа-мишени, которое зависит от таких его свойств, как отражение, рассеивание и поглощение [6, 7]. Преобразование энергии лазерного луча в тепловую приводит к повышению температуры ткани органа-мишени и может вызывать либо коагуляцию, либо вапоризацию. Лазерная коагуляция происходит, когда ткань нагревается до температуры, ниже таковой ее кипения (температуры парообразования), однако выше температуры, необходимой для денатурации белка, в результате которой возникает коагуляционный некроз с возможностью отсроченной морфологической циторедукции. Поглощение обеспечивается наличием хромофора, каковыми могут быть меланин, оксигемоглобин, гемоглобин и вода. Высокий коэффициент поглощения означает, что энергия лазерного излучения заданной длиной волны хорошо поглощается в выбранной среде. Низкий коэффициент поглощения соответствует более высокой степени прозрачности ткани, позволяющей свету заданной длины волны глубже проникать в среду [2, 7].
Длина затухания является очень важной его характеристикой, так как лазерное излучение с меньшей длиной волны будет передавать в ткань большее количество энергии на единицу площади. Это означает, что при одном и том же уровне мощности длина волны лазера с большей длиной затухания будет рассеивать переданную мощность и вызывать глубокий некроз, в то время как длина волны лазера с меньшей длиной затухания обеспечивает более концентрированную передачу его энергии, что приводит к повышению температуры до уровня выше таковой кипения (парообразования) и к непосредственной вапоризации ткани [8–10].
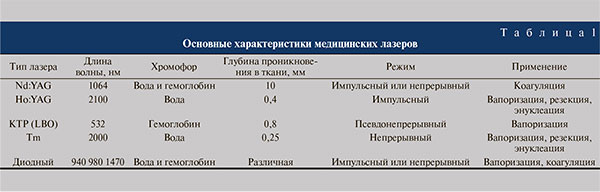
В литературе нет достаточной информации о патоморфологических изменениях в тканях почки при воздействии лазерного излучения [11, 12]. Для интерстициальной коагуляции используются Nd:YAG, диодный тип лазеров (табл. 1).
Изначально применение лазера Nd:YAG сопровождалось огромным энтузиазмом [2, 13]. Однако результаты клинического использования показали, что лазеры Nd:YAG не способны немедленно удалять ткани. Так, в исследовании [14] продемонстрировано, что лазеры, использующие ту же длину волны, что и Nd:YAG-лазер, приводили к глубокому коагуляционному некрозу с отсроченным (4–8 нед) отторжением некротических масс и вторичной аблацией закупоривающей ткани. Однако гистологического анализа тканей проведено не было [8, 14].
 Целью настоящей работы стало изучение взаимодействия излучения Nd:YAG-лазера с импульсно-периодическим режимом генерации с тканями почки для определения возможностей использования высокоинтенсивного излучения в эксперименте на животных in vivo. Для достижения цели требовалось определение оптимальных параметров лазерного излучения и условий воздействия Nd:YAG-лазера, работающего в импульсно-периодическом режиме генерации, при которых достигается интерстициальная лазерная коагуляция. Конечным результатом исследования явилось определение режимов воздействия и прогнозирование объемов изменений в тканях при лечении локализованных новообразований почки.
Целью настоящей работы стало изучение взаимодействия излучения Nd:YAG-лазера с импульсно-периодическим режимом генерации с тканями почки для определения возможностей использования высокоинтенсивного излучения в эксперименте на животных in vivo. Для достижения цели требовалось определение оптимальных параметров лазерного излучения и условий воздействия Nd:YAG-лазера, работающего в импульсно-периодическом режиме генерации, при которых достигается интерстициальная лазерная коагуляция. Конечным результатом исследования явилось определение режимов воздействия и прогнозирование объемов изменений в тканях при лечении локализованных новообразований почки.
Материалы и методы. Экспериментальная работа проведена на 6 кроликах-самцах весом до 3 кг и на 5 беспородных собаках весом до 20 кг. Всем животным интраоперационно под эфирным наркозом была произведена ИЛК почек. После лазерного воздействия на ткани почек при различных значениях ее энергии проведен забор органа и гистоморфологическое его изучение для определения границы зоны коагуляционного некроза тканей и области переходных процессов при различных режимах воздействия. У кроликов забор материала для проведения гистологических исследований также произведен спустя 1, 3, 7, 14, 21, 30 дней после лазерного воздействия, а у собак его осуществляли на 3-и, 7-е, 14-е, 35-е сутки после воздействия.
Материал фиксировали в нейтральном формалине, заливали в парафин и окрашивали гематоксилином, эозином, пикрофуксином. При гистологическом исследовании определена степень повреждения тканей почки экспериментальных животных, а также динамика их изменений в различные сроки после ИЛК.
В качестве источника излучения использован лазерный хирургический комплекс, в состав которого входит лазерный излучатель на основе иттрий-алюминиевого граната с неодимом (Nd:YAG) с оптоволоконной доставкой выходного излучения (скальпель-коагулятор).
Основные характеристики использованного лазера: максимальная средняя мощность 100 Вт, тип лазера Nd:YAG, длина волны 1,06 мкм, длина импульса 300 мкс, максимальная энергия импульса 1 Дж, пиковая мощность 3,3 кВт.
 Суть процедуры ИЛК состояла в установке выходного конца волоконного катетера внутрь ткани, при этом доставленная энергия лазерного излучения используется для разрушения ткани. Ранее использовались ITT-катетеры (волоконные световодные катетеры с цилиндрическим рассеивающим наконечником), которые на дистальном торце имели различного типа насадки для рассеивания лазерного излучения (диффузоры). При энергии 20–25 Вт и воздействии в течение 20 мин регистрировалось повышение температуры ткани до 55ºС. При общей энергии лазерного излучения в 420 Дж наблюдался коагуляционный некроз, а энергия в 720 Дж вызывала вапоризацию ткани и коагуляционный некроз периферийной зоны.
Суть процедуры ИЛК состояла в установке выходного конца волоконного катетера внутрь ткани, при этом доставленная энергия лазерного излучения используется для разрушения ткани. Ранее использовались ITT-катетеры (волоконные световодные катетеры с цилиндрическим рассеивающим наконечником), которые на дистальном торце имели различного типа насадки для рассеивания лазерного излучения (диффузоры). При энергии 20–25 Вт и воздействии в течение 20 мин регистрировалось повышение температуры ткани до 55ºС. При общей энергии лазерного излучения в 420 Дж наблюдался коагуляционный некроз, а энергия в 720 Дж вызывала вапоризацию ткани и коагуляционный некроз периферийной зоны.
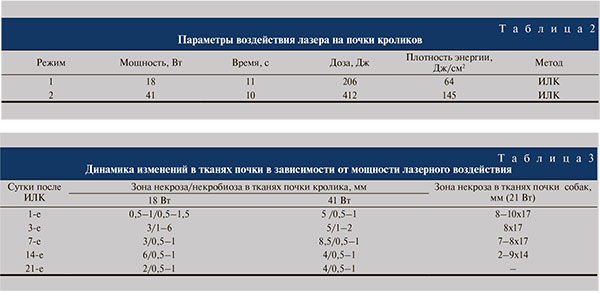
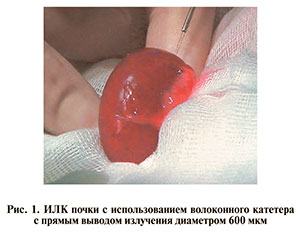
В работе использован волоконный катетер с прямым выводом излучения диаметром 600 мкм в течение 2–10 с. Воздействие осуществлено контактно дистальным торцом кварцевого волоконно-оптического катетера диаметром сердцевины 600 мкм, по которому произведена доставка излучения в раневую область (рис. 1). Воздействие на почки кроликов осуществлено в двух различных режимах, значения параметров выходного излучения которых представлены в табл. 2.
ИЛК ткани почки осуществлен в режимах 1 и 2 при разных значениях мощности лазерного излучения. Суммарная доза энергии составила 206±10 и 412±20 Дж соответственно. Коагуляция проведена в двух областях каждой почки: одного из полюсов и в среднем ее сегменте. Выходная мощность лазерного излучения при воздействии в первой области у кроликов составила 18 Вт, во второй – 41, а у собак – только 21 Вт. Продолжительность лазерного излучения в каждой из мест воздействия была равной 10 с. Дистальный торец волокна поместили внутрь ткани на глубину 1–2 мм.
Выходную мощность лазерного излучения во всех экспериментах контролировали измерениями его энергии на выходе волокна. Продолжительность воздействия и дозу облучения задавали предварительно.
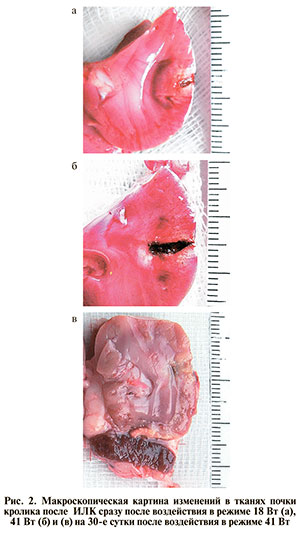
Результаты. Макроскопически после ИЛК в ткани почки фиксировали области полностью коагулированной ткани почки, размеры которых зависели от дозы облучения и составили до 8 мм при мощности лазерного излучения 18 Вт и до 11 мм при мощности 41 Вт (рис. 2).
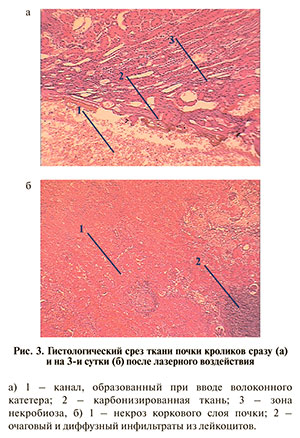
Морфологическое исследование показало (табл. 3), что сразу после воздействия зона коагуляции представлена небольшим каналом сухого некроза, вокруг которого определяются область некроза экскреторных канальцев шириной 3–4 мм, отек и разрушение коллагеновых волокон. На 3-й день после воздействия зона некроза увеличилась до 8 мм в ширину и 17 мм в длину. Изменения в тканях за некрозом представлены отеком, сосудистым стазом, нейтрофильной инфильтрацией и появлением новообразованных сосудов. На 7–14-й день зона коагуляции достигла 9 мм в ширину и 14 мм в длину с тотальным некрозом экскреторных канальцев и формированием фибробластов. В окружающих тканях вместе с ростом сосудов увеличивалась инфильтрация нейтрофилами и лейкоцитами. Разрастание соединительной ткани в корковом слое почки свидетельствовало о тенденции к заживлению повреждения путем рубцевания. В участке некроза мозгового слоя наблюдалось значительное замедление процессов регенерации. К 14-м суткам наблюдения пролиферации фибробластов не отмечено, что, вероятнее всего, обусловлено физиологическими особенностями медуллярной зоны почки. Скорость медуллярного кровотока значительно ниже, чем в коре, и кровь в нее поступает через юкстамедуллярные клубочки и ложные прямые артериолы, оказавшиеся поврежденными после воздействия на почку. Размер зоны некроза зависел от мощности и времени воздействия (табл. 3).
На рис. 3 представлена микроскопическая картина изменений тканей кролика почки после ИЛК.
Обсуждение. После ИЛК в тканях почки можно четко выделить следующие зоны:
- зону некроза, которая характеризуется тотальной гибелью клеточных элементов в виде коагуляционного некроза. Определить границы между клеточными элементами не представляется возможным, ядра в клетках не определяются. Отмечаются явления карбонизации (обугливания);
- зону транзиторных изменений, характеризующуюся значительным разнообразием морфологических изменений. Отмечается сочетание обратимых и необратимых изменений. В отделах, прилежащих к зоне карбонизации (зона некроза), преобладают необратимые процессы, в то время как в отделах, прилежащих к следующей зоне – демаркационного воспаления, доминируют обратимые изменения. Следует, однако, отметить, что в транзиторной зоне отмечаются выраженный полиморфизм морфологических изменений и тесное переплетение обратимых и необратимых процессов;
- зону демаркационного воспаления, которая характеризуется сочетанием выраженного отека, полнокровия сосудов микроциркуляторного русла и наличия круглоклеточного инфильтрата;
- зону относительно сохранной ткани, в которой тканевые изменения практически отсутствуют.
Обращает на себя внимание, что при увеличении мощности воздействия увеличивается размер зон патологических изменений. При морфометрии отсроченного материала зона некроза увеличивается. Это объясняется тем, что клеточные элементы в зоне транзиторных изменений, альтерация которых носила необратимый характер, погибли. Большинство таких структур находилось вблизи зоны некроза, гибель их и увеличила размер некроза.
При анализе морфологических изменений в зоне проведения ИЛК следует отметить, что зона некроза является практически диаметром повреждения, поскольку изменения происходят вокруг введенного проводника, а зоны транзиторных изменений и демаркационного воспаления – это суммационный показатель фокусов, расположенных по обе стороны от зоны некроза.
Чем хуже функционируют транспортные системы (кровоток, лимфоток) в тканях, подверженных лазерному излучению, тем в большей степени выражена альтерация.
 Признаки повреждения (альтерации) нарастают по мере повышения величины параметров (мощности) лазерного воздействия. Увеличивается количество клеток с признаками различных вариантов дистрофии, в том числе зернистой, когда в цитоплазме клеток появляется масса мелких эозинофильных гранул, либо гидропической (вакуольной), характеризующейся появлением в цитоплазме вакуолей различной величины. Но если появление мелких вакуолей (мелкокапельная гидропическая дистрофия) – обратимый процесс, то при наличии вакуолей, занимающих большую часть пространства цитоплазмы либо имеющих величину, сравнимую с величиной ядра, то он необратим и по прошествии времени неминуемо перейдет в некробиоз и некроз.
Признаки повреждения (альтерации) нарастают по мере повышения величины параметров (мощности) лазерного воздействия. Увеличивается количество клеток с признаками различных вариантов дистрофии, в том числе зернистой, когда в цитоплазме клеток появляется масса мелких эозинофильных гранул, либо гидропической (вакуольной), характеризующейся появлением в цитоплазме вакуолей различной величины. Но если появление мелких вакуолей (мелкокапельная гидропическая дистрофия) – обратимый процесс, то при наличии вакуолей, занимающих большую часть пространства цитоплазмы либо имеющих величину, сравнимую с величиной ядра, то он необратим и по прошествии времени неминуемо перейдет в некробиоз и некроз.
Размер зоны альтерации по прошествии некоторого времени увеличивается за счет морфологических изменений в тканях, имеющих промежуточный характер повреждений, а именно:
- увеличивается количество клеточных элементов с патологическими изменениями в виде некробиоза, преимущественно за счет развивающегося процесса фокального либо тотального коликвационного некроза в тканях;
- появляются очаги деструкции в соединительнотканной строме, характеризующиеся развитием гамма-метахромазии, не носящие характера необратимых вариантов повреждения соединительной ткани, а ограничивающиеся лишь патологическими изменениями в виде мукоидного набухания и отека.
Таким образом, можно констатировать, что повреждения тканей почки после ИЛК выражены умеренно и большинство из них носят обратимый характер. Увеличение среднего диаметра сосудов микроциркуляторного русла свидетельствует о возможной активации репаративных процессов, которые достаточно быстро смогут возместить небольшие фокусы повреждения.
Заключение. Результаты проведенного экспериментального исследования позволили установить этапность и характеристики изменений в тканях почки после ИЛК, что позволяет рекомендовать ее для деструкции образований почек малых размеров в клинических условиях без нарушения функции органа.
Определены дозы воздействия лазерного излучения при осуществлении ИЛК, предпочтительные для тканей почки; они находятся в диапазоне 20–40 Вт выходной его мощности при дозе энергии облучения в диапазоне 200–400 Дж.