Введение. Венозная недостаточность (ВН), или патологический венозный дренаж (ПВД), может быть основным или сопутствующим симптомом для 20–35% пациентов с эректильной дисфункцией (ЭД). У молодых мужчин чаще определяется изолированная веногенная ЭД, в то время как у возрастных пациентов преобладают смешанные артериовенозные изменения [1–4].
Тактика лечения больных с указанными нарушениями зависит от выраженности и характера сосудистых нарушений. При умеренно выраженной ВН возможно проведение консервативных мероприятий: медикаментозное лечение ингибиторами фосфодиэстеразы 5-го типа (иФДЭ-5), андрогенами, а также применение различных констрикторов, обеспечивающих механическое сдавление основания полового члена с целью возникновения, удержания и пролонгации эрекции. При невозможности коррекции ВН консервативными способами рекомендуется оперативное лечение [5–8].
Выделяют три типа ПВД: дистальный, проксимальный и смешанный, определяющих методику оперативного вмешательства. Принцип операции при дистальном ПВД заключается в ограничении венозного оттока от кавернозных тел за счет максимально возможной перевязки всех выявленных интраоперационно дренирующих вен. При проксимальном типе иногда применяются «гофрирующие/пликирующие» операции, когда промежностным доступом в области ножек кавернозных тел на белочную оболочку накладываются нерассасывающиеся лигатуры, за счет чего увеличивается компрессия кавернозных тел.
Отдаленные результаты всех этих операций, к сожалению, далеко неутешительные. Наиболее результативны легирующие операции на стволе полового члена. При проксимальном или смешанном типе ПВД эффективность вмешательства в течение первого года не превышает 40–50% [2, 9]. Многие авторы объясняют это тем, что вместо блокированных во время операции вен в процесс патологического венозного оттока вовлекаются новые коллатерали [4, 5]. Другие исследователи считают, что клинический рецидив ЭД – это результат наличия остаточных (нелегированных во время операции) вен, но не реканализация старых [10]. Проведенное в течение 17 лет исследование продемонстрировало, что легированная венозная сеть не способна к реканализации [11]. E. Meuleman [12] полагает, что наилучшие кандидаты для венорестриктивных операций – пациенты с анатомическими аномалиями: эктопическими венами, дренирующими кавернозные тела, а также кавернозо-спонгиозными или кавернозо-гланулярными шунтами.
При выраженной сосудистой недостаточности возможно сразу же прибегать к радикальному вмешательству – операции фаллоэндопротезирования [8]. Однако эта операция далеко не всегда оправданна для выполнения молодым пациентам.
 Все это заставляет искать новые пути решения проблемы веногенной ЭД, особенно в отношении молодых пациентов, при проксимальном и смешанном типе ПВД.
Все это заставляет искать новые пути решения проблемы веногенной ЭД, особенно в отношении молодых пациентов, при проксимальном и смешанном типе ПВД.
За рубежом были предприняты попытки внедрения рентгенэндоваскулярных операций в лечении ВН [13, 14], однако широкого распространения эта многообещающая технология не получила вследствие недостаточной отработки показаний и методик выполнения, а также отсутствия безопасных окклюзирующих материалов.
С 2009 г. в клиническую практику отделения андрологии и урологии ЭНЦ внедрена и запатентована безопасная и высокоэффективная методика рентгенэндоваскулярной окклюзии простатического сплетения (РЭВОПС) в лечении веногенной ЭД (патент РФ на изобретение № 2438595).
Целью исследования явилась разработка безопасного и эффективного метода лечения ПВД проксимального и смешанного типов.
Материалы и методы. Были обследованы 1649 пациентов, обратившихся с жалобами на ЭД с 2009 по 2012 г. Из них у 1053 (63%) пациентов в возрасте 18–59 лет была выявлена ЭД сосудистого генеза.
С учетом критериев включения/исключения группу исследования составили 11,1% (117/1053) мужчин с изолированной веногенной ЭД проксимального и смешанного типов ПВД, проявлявшейся нестабильной эрекцией и быстрой детумесценцией. Всем этим пациентам была выполнена РЭВОПС. До операции все пациенты получали препараты иФДЭ-5 в максимальных дозах не менее 3 мес, но без существенного эффекта. В общей группе (n=1053) распределение мужчин с ЭД по возрасту составило: 18–29 лет – 10%, 30–39 – 14%, 40–49 – 35%, 50–59 лет – 41%. Распределение по возрасту пациентов с ПВД: 18–29 лет – 38%, 30–39 – 28%, 40–49 – 17%, 50–59 лет – 17%.
Критерии включения: ЭД в результате ПВД проксимального и смешанного типов, не корригируемая консервативной терапией. Критерии исключения: артериогенная ЭД; андрогенный дефицит, гиперпролактинемия, гипо-, гипертиреоз; декомпенсированный сахарный диабет (СД), диабетическая нейропатия (при этом наличие СД в стадии компенсации без специфических осложнений не считали критерием исключения); курение.
После сбора анамнеза и физикального осмотра все больные заполняли опросники МИЭФ-5, AMS (Aging Male Symptom), после чего проходили комплексное обследование, включившее общеклинические тесты, исследование уровней гормонов крови и лучевое обследование. Клиническая характеристика больных представлена в табл. 1. При этом наличия дополнительных факторов, обусловливающих снижение качества эрекции, выявлено не было.
Всем пациентам проведено андрологическое обследование, включившее оценку полового статуса с определением объема и консистенции тестикул, пальцевое ректальное и ультразвуковое исследование предстательной железы. Дефицит андрогенов не имеет строго специфичных симптомов, поэтому объективным критерием данного синдрома является сниженный уровень циркулирующего в крови общего тестостерона менее 12 нмоль/л [15–17].

Перед началом исследования всем пациентам проведен тест на выявление у них возможного андрогенного дефицита. Выраженность клинических симптомов оценивали при помощи международного стандартизированного опросника AMS. Для определения андрогенного дефицита в нашей работе мы больше ориентировались на лабораторные показатели уровня тестостерона в крови, так как ЭД как тяжелая фрустрирующая составляющая хронического заболевания может значимо влиять на результаты любых психологических опросников. Депрессия амплифицирует проявления соматического заболевания, особенно когда имеется правильное понимание сущности и перспектив болезни (особенно в активном периоде жизни) [18–21]. Зависимости количества баллов по опроснику AMS от уровня тестостерона в крови, длительности ЭД и возраста установлено не было (табл. 2).
При исследовании уровней гормонов в крови данных за заболевания эндокринной системы получено не было. Показатели тиреотропного гормона, пролактина, тестостерона в исследуемой группе были в пределах референсных значений.
У 22 пациентов диагностирован СД, из них у 15 – СД 1-го типа (подгруппа СД1), у 7 – СД 2-го типа (подгруппа СД2). Гликированный гемоглобин (HbA1c) является универсальным критерием оценки компенсации СД. Уровень HbA1c в группе пациентов с СД составил 6,7±0,6% (5,4–7,5). В подгруппе СД1 длительность течения СД составила 7,3±5,8 года, уровень HbA1c – 6,9±0,8%, в подгруппе СД2 – 8,9±6,3 года и 6,5±1,1%. Диабетической дистальной и автономной нейропатии, а также патологических изменений в артериях нижних конечностей ни в одной подгруппе не выявлено.
Первым обязательным тестом лучевой диагностики для всех пациентов стала ультразвуковая фармакодопплерография (ФДГ) пенильного кровотока [22]. Фармакологическую инициацию эрекции проводили с помощью препарата простагландина Е2 (альпростадил 10–20 мг). Операцию РЭВОПС выполняли только пациентам, у которых по результатам теста отсутствовали нарушения артериального компонента эректильной функции (пиковая систолическая скорость кровотока (Vmaxs) более 25 cм/c). Но были выявлены косвенные признаки венозной недостаточности – конечная диастолическая скорость кровотока (Vmaxd) в кавернозных артериях больше 6 см/с, линейная скорость кровотока в ГДВ больше 5 см/с, увеличение диаметра ГДВ более чем на 30 % после инъекции вазоактивного препарата, а также положительная проба Вальсальвы (табл. 3).

В алгоритме лучевого обследования пациента с ЭД венозного генеза ФДГ является скрининговым тестом, позволяет качественно и количественно оценивать тяжесть заболевания. Однако для объективной визуализации путей венозной утечки из кавернозных тел самым доступным методом остается фармакокавернозография (ФКГ) [23]. Изначально кавернозографию для регистрации и рентгенологического отображения кавернозно-венозного дренажа предложил R. Virag еще в 1978 г. Мы модифицировали методику выполнения стандартной ФКГ, что позволило повысить диагностическую эффективность метода.
Исследование проведено в ангиографическом кабинете в позиции пациента лежа на спине. Возможность перемещения лучевой трубки вокруг плоскости больного при динамическом мониторинге распределения контрастного вещества по пещеристым телам члена и визуализации путей венозной утечки позволяет получать высокоинформативные трехмерные кавернозограммы. При этом не возникает потребности в передвижении самого пациента на столе, что обычно рекомендуется при выполнении статических рентгенограмм.
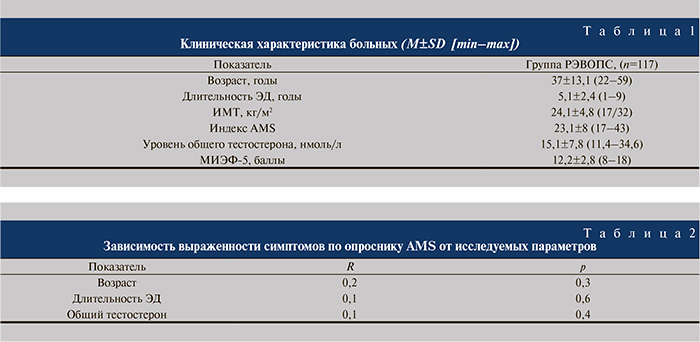
В случае выраженного венозного сброса предварительная инъекция вазоактивного препарата может не вызывать полной ригидности пениса, поэтому мы в обязательном порядке проводили также модифицированную нами динамическую перфузию кавернозных тел физиологическим раствором до достижения полной (максимальной) ригидности. И только на высоте эрекции вводили необходимое количество низкоосмолярного контрастного вещества. Количество вводимого исходно физиологического раствора не имеет значимой диагностической ценности, равно как и скорость введения, что обычно учитывается при типичной фармакокавернозометрии (ФКМ). Важно достигнуть ригидности пениса, в противном случае результаты рентгеновского исследования могут быть ложноположительными. После полного заполнения кавернозных тел контрастным веществом определяли пути ПВД (рис. 1).
После подтверждения диагноза патологического венозного шунтирования, уточнения типа ПВД (дистальный, проксимальный или смешанный) и определения показаний к операции пациенту рекомендовали выполнение оперативного вмешательства. При ПВД проксимального и смешанного типов проводили РЭВОПС.
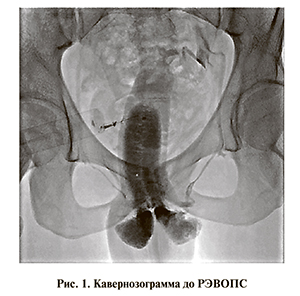
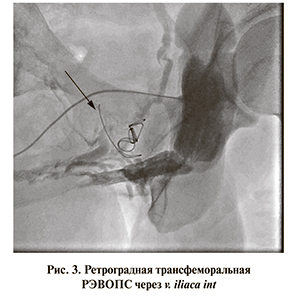 Оперативное пособие осуществлено в стандартной ангиографической операционной. В положении больного на спине под местной анестезией производили выделение и пункцию ГДВ полового члена. Далее вводили рентгенэндоваскулярный интродьюссер интралюминально до венозного простатического сплетения. После визуализации путей венозного дренирования при обязательном контроле получаемой лучевой картины проводили окклюзию индивидуально выбранных участков простатического сплетения окклюзирующими спиралями (рис. 2). В случае если при контрольной флебографии визуализировался недостаточный эффект в виде сохраняющегося оттока венозной крови либо в случае дополнительного сброса крови по круральным венам для лучшего результата дополнительно проводили окклюзию вен антеградным либо ретроградным доступом трансфеморально (рис. 3). Также РЭВОПС ретроградно проводится при невозможности ее выполнения антеградно, при рецидивах ПВД, после легирующих операций. Об эффекте операции судили по отсутствию или выраженному уменьшению оттока венозной крови по сравнению с исходным (см. рис. 2). После ушивания раны и наложения компрессирующей повязки пациента отпускали домой с необходимыми рекомендациями.
Оперативное пособие осуществлено в стандартной ангиографической операционной. В положении больного на спине под местной анестезией производили выделение и пункцию ГДВ полового члена. Далее вводили рентгенэндоваскулярный интродьюссер интралюминально до венозного простатического сплетения. После визуализации путей венозного дренирования при обязательном контроле получаемой лучевой картины проводили окклюзию индивидуально выбранных участков простатического сплетения окклюзирующими спиралями (рис. 2). В случае если при контрольной флебографии визуализировался недостаточный эффект в виде сохраняющегося оттока венозной крови либо в случае дополнительного сброса крови по круральным венам для лучшего результата дополнительно проводили окклюзию вен антеградным либо ретроградным доступом трансфеморально (рис. 3). Также РЭВОПС ретроградно проводится при невозможности ее выполнения антеградно, при рецидивах ПВД, после легирующих операций. Об эффекте операции судили по отсутствию или выраженному уменьшению оттока венозной крови по сравнению с исходным (см. рис. 2). После ушивания раны и наложения компрессирующей повязки пациента отпускали домой с необходимыми рекомендациями.
Результаты. Длительность ЭД, субъективно оцененной пациентом (первые клинические признаки заболевания), варьировалась от года до 9 лет. Выраженность веногенной ЭД (по опроснику МИЭФ-5) не зависела (р=0,3) от длительности заболевания (0–5 и 6–10 лет) и составила 11,7±4,7 и 13,5±5,1 балла соответственно.
Через 6 мес после проведения РЭВОПС выраженность жалоб по критериям AMS достоверно не изменилась (р=0,2). Корреляционной зависимости тяжести проявления ЭД, определяемой по опроснику МИЭФ-5, и длительности заболевания выявлено не было (р=0,2).
Показатель по опроснику МИЭФ-5 продемонстрировал достоверную положительную динамику. У пациентов с СД достоверных различий степени выраженности ЭД по опроснику МИЭФ до и после РЭВОПС по сравнению с пациентами без СД не выявлено, не определялись также достоверные различия и между подгруппами СД1 и СД2 (табл. 4).
Контрольную перфузионную ФКГ выполнили 36 больным в срок от 3 мес до года после операции. Основной причиной отказа пациентов от проведения контрольного обследования было хорошее качество эрекции и отсутствие желания проводить дискомфортную процедуру. Из 36 пациентов, кому была проведена контрольная ФКГ, у 17, не имевших жалобы на ЭД, венозного сброса отмечено не было.
Жалобы на резидуальную ЭД предъявили 19 пациентов. В 12 наблюдениях выявлен ПВД. У остальных 7 пациентов ПВД не определялся, но выявлена психогенная ЭД, которая развилась после выполнения РЭВОПС. При этом причиной ЭД в виде психологических проблем стали стрессовый фактор, а именно «синдром ожидания неудачи», а также сложность в поиске и налаживании контакта с половыми партнерами после длительной половой абстиненции. Так как коррекция органической ЭД в группе из 7 пациентов с психологическими проблемами была выполнена, они были направлены к специалистам-психологам, им был также рекомендован прием иФДЭ-5.
Из 12 пациентов, у которых по результатам контрольных ФКГ выявлен ПВД, троим выполнено фаллоэндопротезирование функциональными протезами. У данных пациентов при обследовании выявлен диффузный кавернозный фиброз (ДКФ), подтвержденный данными гистологического исследования во время операции. Причиной ДКФ была существовавшая длительное время выраженная венозная утечка, что в итоге явилось негативным фактором, препятствовавшим достижению положительного результата РЭВОПС. У остальных 9 пациентов с ПВД после РЭВОПС резидуальная ЭД успешно корректировалась иФДЭ-5, при этом показатель по опроснику МИЭФ стал достоверно больше, чем до РЭВОПС (см. табл. 4).
Необходимо отметить, что отрицательный результат был получен от пациентов, которым выполняли РЭВОПС на начальном этапе освоения методики, и от больных с выраженным ПВД. При оценке результата операции также учитывали, что до вмешательства длительное применение иФДЭ-5 не давало эффекта, что в целом и оказалось побуждающей причиной для обращения пациентов в ЭНЦ. При этом следует подчеркнуть, что во всех случаях выявления ПВД при ФКГ после РЭВОПС выраженность венозной утечки была значительно меньше, чем до операции.

Из осложнений у 1 пациента наблюдали умеренное кровотечение из раны в первые сутки после операции. Еще у 5 мужчин сохранялся лимфостаз пениса в течение 3 нед после операции. Данное осложнение развилось у пациентов с поливазальным типом ГДВ и трудным (травматичным) ее выделением.
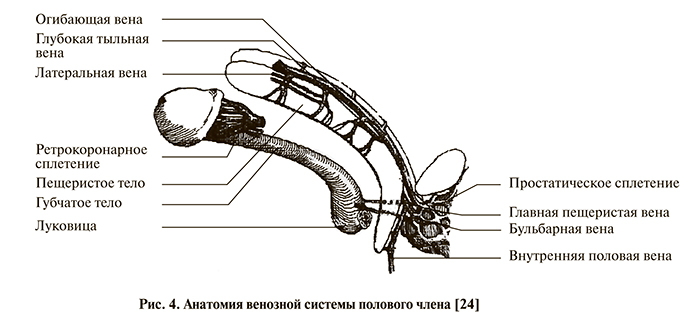
Обсуждение. Известно, что венозный отток крови от полового члена осуществляется по трем дренажным коллекторам: системам поверхностной дорсальной вены, глубокой дорсальной вены, глубоких круральных/кавернозных вен (рис. 4) [24]. Поверхностная дорсальная вена дренирует кожу полового члена и фасции, проходя по дорсальной поверхности органа. Глубокая дорсальная вена (ГДВ) дренирует головку, спонгиозное тело уретры и дистальные 2/3 кавернозных тел. Эмиссарные вены в проксимальных отделах полового члена объединяются в глубокие пенильные и кавернозные вены, дренируя бульбозный отдел спонгиозного тела уретры, и впадают далее во внутреннюю половую вену и простатическое сплетение.
Именно данная анатомическая особенность оттока крови по дренирующим сосудам в основной коллектор (простатическое сплетение) определяет низкую результативность всех предлагаемых операций при веногенной ЭД. Разумеется, при изолированном дистальном типе ПВД будет эффективно как лигирование дорсальной и эмиссарных вен, так и спонгиолизис. Однако рекомендуемая при проксимальной ПВД операция пликирования ножек полового члена не позволяет полностью остановить венозное шунтирование из круральных вен в силу их анатомической недоступности из зоны оперативного вмешательства. А при расширении раны и большей мобилизации ножек увеличивается риск осложнений: развития полной ЭД, деформации пениса, повреждения нервов полового члена.
Ранее была предложена лапароскопическая методика лигирования вен позадилонного сплетения, которая оказалась несостоятельной в силу невозможности интраоперационной визуализации всех глубокорасположенных вен простатического сплетения.
В связи с этим для коррекции веногенной ЭД проксимального и смешанного типа совершенно логичной была идея окклюзии венозных коммуникантов не снаружи вен, а интралюминально с использованием новых высокотехнологичичных методик, сочетающих минимальную травматичность и высокую эффективность. С нашей точки зрения, этому требованию соответствует эндоваскулярная хирургия.
Веноокклюзивный механизм зависит от целостности и функциональности гладкомышечных волокон кавернозной ткани и эластичности белочной оболочки. Патологический венозный дренаж относится к дисфункции веноокклюзивного механизма – недостаточной компрессии субтуникальных вен белочной оболочкой пениса. Это происходит из-за чрезмерного развития как экстра-, так и интракавернозных вен, несостоятельности расширенных синусоидов, потери эластичности собственной белочной оболочки, фиброза и дегенерации интракавернозной гладкой мускулатуры, недостатка нейромедиаторов. Однако ПВД может быть и самостоятельной причиной венозной ЭД [25–27].
С широким внедрением в практику новейших методик лучевого обследования стало возможным использовать для диагностики ЭД такие методы, как магнитно-резонансная томография (МРТ) и мультиспиральная компьютерная томография (МСКТ) с интракавернозным контрастированием. Мы инициировали применение данных высокотехнологичных методик в нашей стране и неоднократно сообщали ранее об их возможностях и перспективах использования [28–30]. Однако наш опыт показал, что методика кавернозографии с помощью МРТ или МСКТ предусматривает довольно продолжительное статическое нахождение больного без перфузии кавернозных тел, что приводит к неизбежной детумесценции и ложноположительному результату исследования, что не всегда учитывают клиницисты при внедрении данных методик в свою практику.
Именно по этой причине в последнее время мы предпочитаем использовать динамическую перфузионную ФКГ, выполняемую в ангиографической рентгеноперационной. Этот метод позволяет с первой минуты введения достоверно оценивать равномерность распространения контрастного вещества по пещеристой ткани и выявлять все венозные сосуды, шунты и патологические пути сброса венозной крови. Мы считаем, что данное исследование следуют называть именно так – фармакокавернозофлебография, поскольку целью визуализации являются именно дренирующие венозные сосуды, исходящие от пещеристых тел.
Инфузионная ФКГ в ее классическом виде с измерением скорости притока и объема вводимого интракавернозно физиологического раствора выполняется в клинической практике все реже в связи с меньшей ее необходимостью, да и многие специалисты не считают этот метод обязательным. Однако инфузия растворов для достижения полной ригидности пениса должна обязательно проводиться в ходе ФКГ, если нет достаточной эрекции после введенного вазоактивного препарата. В противном случае результат визуализации патологической утечки будет ложноположительным.
Качественная лучевая визуализация путей венозной утечки является обязательной в установлении показаний к РЭВОПС. Мы убедились, что данная технология высокоэффективна и безопасна, является патогенетически обоснованным методом выбора в лечении мужчин с проксимальным и смешанным типами ПВД.
Венозного застоя, тромбоза крупных сосудов малого таза после выполнения РЭВОПС отмечено не было, что подтверждалось данными допплерографии до и после операции на этапах внедрения методики. Имплантированные спирали абсолютно инертны и не мигрируют при правильном выборе их размера, способа и места установки, что также подтверждается лучевыми методами.
Кроме того, на основании нашего накопленного опыта мы считаем, что в определенных ситуациях целесообразно применение РЭВОПС и при смешанном генезе ЭД (артериальном+венозном) с целью уменьшения венозного сброса. Это дает возможность артериальному притоку крови компенсаторно обеспечивать необходимую ригидность полового члена. Продолжающаяся работа в этом направлении оправдывает данное предположение.
Заключение. Таким образом, методика РЭВОПС является новой, безопасной, малоинвазивной и патогенетически обоснованной технологией лечения ЭД, вызванной патологическим дренированием венозной крови от кавернозных тел. Операция выполняется в амбулаторных условиях. Это способствует широкому распространению и внедрению методики в клиническую практику.
Обязательным условием, необходимым для освоения технологии и ее успешного применения, считаем альянс уролога, имеющего опыт лучевой и рентгенэндоваскулярной хирургии, с ангиохирургом, непосредственно участвующим в операции. Умение видеть зону операции в трехмерном лучевом изображении, понимание принципов имплантационных эндолюминальных оперативных вмешательств, знание свойств самих имплантируемых материалов и умение прогнозировать направления перераспределенных потоков крови обеспечат правильное и безопасное расположение окклюзирующих спиралей в необходимом месте и нужном количестве, что и будет служить залогом успеха. С учетом тенденции на персонификацию медицины, невозможную без мультидисциплинарного подхода, нам представляется актуальным, что РЭВОПС не просто очередная инновация, а составная часть современного направления в хирургии, которое может способствовать формированию новой специализации – ангиоуролог.



