Введение. Рак предстательной железы (РПЖ) сегодня считается одной из самых серьезных медицинских проблем мужского населения. В Европе он является наиболее распространенным солидным раком, заболеваемость которым составляет 214 случаев на 100 тыс. мужчин, опережая рак легких и колоректальный рак [1]. К тому же в настоящее время РПЖ занимает 2-е место среди онкологических заболеваний по смертности мужчин в США [2]. В России заболеваемость РПЖ продолжает неуклонно расти: с 1999 по 2009 г. она увеличилась на 144% (с 15,69 по 38,41 случая на 100 тыс. населения) и в структуре онкологической заболеваемости мужского населения составила 10,7% [3].
Наряду с «золотым» стандартом лечения локализованных форм РПЖ – радикальной простатэктомией, в последние годы все большую популярность набирает метод интерстициальной лучевой терапии – брахитерапия. Суть метода заключается во внедрении в ткань предстательной железы закрытых лучевых микроисточников (I125, Pd103).
С начала применения брахитерапии до сегодняшнего дня соотношение числа выполненных радикальных простатэктомий и брахитерапии неуклонно увеличивается в пользу последней. Так, в США с 1994 по 2003 г. количество брахитерапий увеличилось с 4 до 52 тыс. в год. Результатом брахитерапии является безрецидивная выживаемость от 66 до 95% при сроках наблюдения 5–12 лет [4–6].
Несмотря на то что брахитерапия представляется как малоинвазивный метод лечения РПЖ, для нее характерны различные осложнения. На основании результатов многоцентровых исследований разработана классификация расстройств мочеиспускания после брахитерапии, включающая три степени нарушений. Обструктивная симптоматика при первой степени требует приема α-адреноблокаторов, при второй – интермиттирующей катетеризации, при третьей степени – оперативного лечения либо (реже) цистостомии и бужирования уретры [4–6].
Кроме того, осложнения брахитерапии разделяют на ранние и поздние. Ранние осложнения, возникающие в течение 12 мес после операции, – это ирритативные расстройства мочеиспускания, острая задержка мочеиспускания, стриктуры уретры, проктит. Патогенез ранних осложнений, по нашему мнению, в основном обусловлен отеком предстательной железы, лучевым простатитом и уретритом вследствие высокой дозы облучения, приходящейся на эти органы (до 200 Гр для предстательной железы и 120 Гр для уретры). Так, частота острой задержки мочеиспускания после брахитерапии, по данным разных авторов, при достаточном количестве наблюдений составляет от 5 до 22% случаев [4–6]. Консервативное лечение, как правило, оказывается эффективным, однако применение интермиттирующей катетеризации мочевого пузыря (нередко затруднительной или осложненной) может приводить к развитию стриктур или облитераций уретры. В качестве первой медицинской помощи в таких ситуациях обычно больным устанавливают эпицистостому, которая, решая проблему оттока мочи из мочевого пузыря, в свою очередь усложняет последующее восстановление самостоятельного мочеиспускания. Помимо этого имеет место так называемый пустой мочевой пузырь, что также увеличивает вероятность развития лучевого цистита.
К поздним осложнениям, возникающим не ранее чем через 12 мес после брахитерапии, обычно относят склероз простаты (шейки мочевого пузыря), недержание мочи, стриктуру уретры, гематурию, эректильную дисфункцию, проктит, а также осложнения эндоскопических операций после брахитерапии. Так, например, наиболее частой причиной стрессового недержания мочи у больных после брахитерапии ряд авторов считает выполненную с целью ликвидации инфравезикальной обструкции трансуретральную резекцию (ТУР) предстательной железы [4–6].
Таким образом, профилактика и своевременная коррекция осложнений, возникших после проведения интерстициальной лучевой терапии, являются важными факторами лечения больных данной категории и в значительной степени могут улучшить качество их жизни. Внедрение в клиническую практику современных эндоскопических технологий открывает новые перспективы в лечении пациентов с обструктивными осложнениями брахитерапии РПЖ [7].
Целью работы явилась оценка ближайших и отдаленных результатов применения эндоскопических методов лечения к пациентам с обструктивными осложнениями брахитерапии.
Материалы и методы. В настоящее исследование был включен 51 пациент в возрасте от 59 до 82 лет с РПЖ в стадии Т1–Т3, которому с 2001 по 2013 г. на базе ГКУБ № 47 Москвы (ныне ГКБ № 57) произведено эндоскопическое оперативное лечение по поводу обструктивных осложнений после выполненной брахитерапии в различных клиниках Москвы и других городов России. Всем пациентам выполнена брахитерапия с I125.
Шестнадцать пациентов были госпитализированы в клинику по поводу острой задержки мочеиспускания (8 установлена временная троакарная эпицистостома), 34 – в связи с хронической задержкой мочеиспускания и 1 больной – в связи с болями в правой поясничной области на фоне правостороннего уретерогидронефроза. Двадцать три пациента после брахитерапии продолжали курс адъювантной гормонотерапии, семерым дополнительно проведен курс дистанционной лучевой терапии.
Все пациенты проходили стандартное комплексное клинико-лабораторное обследование, начавшееся со сбора и изучения жалоб и анамнеза, физикального осмотра. Лабораторные исследования подразумевали клинический и биохимический анализ крови, определение уровня простатспецифического антигена (ПСА), общий анализ мочи, коагулограмму, а также бактериологический анализ мочи с определением чувствительности к антибиотикам. Основными инструментальными методами обследования стали УЗИ мочевого пузыря и простаты, урофлоуметрия, обзорная урография, восходящая и микционная цистоуретрография. В отдельных наблюдениях выполнены экскреторная урография, магнитно-резонансная томография органов малого таза, динамическая нефросцинтиграфия. После проведенной брахитерапии уровень ПСА варьировался от 0,02 до 1,20 нг/мл, объем предстательной железы – от 23 до 87 см3.
Оперативные вмешательства проведены преимущественно под эпидуральной анестезией (46 пациентов), в остальных наблюдениях с учетом выраженных изменений позвоночника методом выбора был эндотрахеальный наркоз.
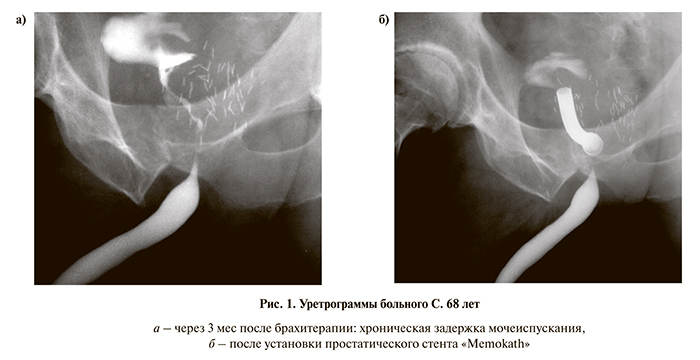
Одиннадцати пациентам по поводу острой и хронической задержки мочеиспускания, возникшей на 9–58-е сутки после брахитерапии, выполнено эндопротезирование простаты (рис. 1). Было установлено 3 биорастворимых и 8 металлических простатических стентов. В последующем через 7–13 мес у всех был удален простатический стент и проведена ТУР простаты.
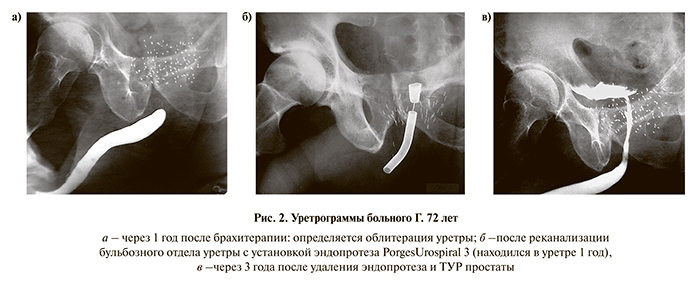
Шестнадцати пациентам выполнена внутренняя уретротомия или реканализация уретры по поводу ее стриктуры или облитерации, возникшей спустя 3–32 мес после брахитерапии: троим внутренняя уретротомия выполнена дважды, одному – трижды. В 5 наблюдениях операция завершалась установкой уретрального эндопротеза (рис. 2) и в 9 наблюдениях внутренняя уретротомия сочеталась с инцизией или ТУР простаты.
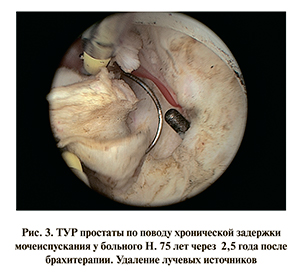
Двадцати трем пациентам через 8–72 мес после брахитерапии выполнена ТУР (инцизия) простаты в связи с хронической задержкой мочеиспускания (рис. 3), из них 2 больным выполнена дважды, а у 7 сочеталась с цистолитотрипсией.
 Пациенту с правосторонним уретерогидронефрозом, обусловленным лучевой стриктурой терминального отдела и камнем нижней трети правого мочеточника, развившейся через 7 лет после брахитерапии в результате чрезмерно близкого расположения к устью имплантируемых радиоактивных зерен, выполнены ТУР мочевого пузыря и мочеточникового устья с удалением радиоактивных зерен, эндоуретеротомия, уретеролитоэкстракция.
Пациенту с правосторонним уретерогидронефрозом, обусловленным лучевой стриктурой терминального отдела и камнем нижней трети правого мочеточника, развившейся через 7 лет после брахитерапии в результате чрезмерно близкого расположения к устью имплантируемых радиоактивных зерен, выполнены ТУР мочевого пузыря и мочеточникового устья с удалением радиоактивных зерен, эндоуретеротомия, уретеролитоэкстракция.
Контрольное обследование было произведено всем пациентам спустя 3, 12 и 24 мес после эндоскопического лечения и включило сбор жалоб по шкале IPSS/QoL, урофлоуметрию, определение объема остаточной мочи и контроль ПСА. Ряду больных выполнена уретрография. Пациенту после ТУР устья мочеточника и эндоуретеротомии проведены ультразвуковое, рентгенологическое и изотопное исследования верхних мочевыводящих путей.
Результаты и обсуждение. Время операции составило от 20 до 55 мин. Все операции прошли без осложнений. Продолжительность госпитализации варьировалась от 3 до 10 сут. Сроки контрольного обследования составили от года до 13 лет.
Ранний послеоперационный период для большинства больных протекал гладко, всем восстановлено самостоятельное мочеиспускание. Лишь у 1 пациента на 2-е сутки после ТУР простаты возник острый эпидидимит, купированный консервативными мероприятиями. В позднем послеоперационном периоде у 2 больных отмечена острая задержка мочеиспускания, вызванная миграцией эндопротеза, потребовавшая его репозиции. Двум пациентам со склерозом шейки мочевого пузыря, возникшим после ТУР простаты, выполнена лазерная инцизия шейки мочевого пузыря с длительным положительным эффектом. У 4 больных с лучевыми стриктурами и облитерациями уретры после брахитерапии возникали повторные рецидивы заболевания после неоднократного эндоскопического лечения – всем пациентам установлены различные модификации уретральных эндопротезов на длительное время (8–27 мес). После удаления эндопротезов рецидивов стриктур уретры отмечено не было (см. рис. 2, в). У 3 пациентов после ликвидации обструктивной симптоматики сохранялось стрессовое недержание мочи.
Ни в одном наблюдении не было отмечено прогрессирования основного заболевания, также не зарегистрировано значимого изменения уровня ПСА крови. Уродинамические показатели после трансуретральных операций соответствовали таковым для необструктивного типа мочеиспускания (показатель Qmax составил в среднем 19,3 мл/с) в отсутствие значимого объема остаточной мочи; средний балл по шкале IPSS/QoL составил 12,3/3,1. У больного после ТУР мочевого пузыря, мочеточникового устья и эндоуретеротомии при контрольном обследовании через 12 и 48 мес данных за нарушение оттока мочи не получено.
Ко всем пациентам с острой задержкой мочеиспускания в ранние сроки после брахитерапии при неудаче консервативной терапии и интермиттирующей катетеризации мы с успехом применили эндопротезирование простаты.
Резекционных и инцизионных оперативных вмешательств не выполняли сознательно, приняв во внимание, что:
- любая облученная рана плохо заживает;
- при резекции, инцизии и коагуляции еще больше нарушается кровоснабжение тканей, что значимо увеличивает потенциальную опасность осложнений;
- вместе с тканями удаляются и радиоактивные зерна, что снижает эффективность метода.
Технической особенностью резекционных операций в поздние сроки после брахитерапии, когда действие радиоактивных зерен прекращается (не менее 6–8 мес), выявилось отсутствие чрезмерного радикализма во время вмешательства. Большинство операций выполнено в объеме «паллиативной ТУР» с удалением средней доли и щадящим удалением апикальных тканей для профилактики послеоперационного недержания мочи. По тем же причинам и для уменьшения послеоперационной дизурии мы применили минимальную коагуляцию тканей.
Заключение. Эндоскопические методы лечения эффективны и безопасны в ликвидации обструктивных осложнений брахитерапии РПЖ. Использование эндоскопических методов не приводит к прогрессированию основного заболевания. Брахитерапия должна с осторожностью выполняться пациентам с РПЖ на фоне необструктивной аденомы предстательной железы размером свыше 60 см3. В случае выявления стриктуры уретры, выступающей в качестве причины задержки мочеиспускания, целесообразно выполнять внутреннюю уретротомию, а при рецидивном течении заболевания – завершать операцию следует установкой уретрального стента.



