Рак является мультифакториальной болезнью, поэтому избавление больного от рака одного органа не может считаться полным выздоровлением.
Первично-множественные злокачественные опухоли представляют сложную и многогранную проблему, причем отмечается тенденция к росту заболеваемости [1–4].
В структуре онкологических заболеваний среди мужчин на долю злокачественных новообразований мочеполовых органов приходится 9,4%. При этом около 68% составляет рак органов мочевыделительной системы и 32% – предстательной железы. По данным ряда авторов, частота первично-множественных злокачественных опухолей урологических локализаций отмечается в 4,7–16,8% случаев [5–7].
 Совершенствование алгоритма комплексной диагностики первично-множественных опухолей особенно актуально в связи увеличением продолжительности жизни этих больных и, соответственно, повышением вероятности возникновения новой опухоли. К тому же ряд исследователей утверждают, что риск развития второй опухоли на фоне вторичного иммунодефицита выше, чем в отсутствие такового [8, 9].
Совершенствование алгоритма комплексной диагностики первично-множественных опухолей особенно актуально в связи увеличением продолжительности жизни этих больных и, соответственно, повышением вероятности возникновения новой опухоли. К тому же ряд исследователей утверждают, что риск развития второй опухоли на фоне вторичного иммунодефицита выше, чем в отсутствие такового [8, 9].
Общепринятый диагностический алгоритм включает осмотр пациента, определение в сыворотке крови уровня простатспецифического антигена (ПСА), пальцевое ректальное исследование (ПРИ), трансректальное УЗИ (ТРУЗИ) простаты и мочевого пузыря, рентгенографию легких, экскреторную урографию, остеосцинтиграфию скелета, цистоскопию, компьютерную томографию (КТ) и/или магнитно-резонансную томографию (МРТ), клинические лабораторные анализы [10, 11].
Для оценки субъективного состояния больного дизурией при раке предстательной железы используется международная система оценки заболеваний предстательной железы (IPSS) и международная система оценки качества жизни (QоL) [12].
Последние десятилетия ознаменовались значительными успехами онкоурологии в лечении пациентов благодаря новому уровню диагностики, появлению лекарственных препаратов последнего поколения. В научной литературе постоянно появляются сообщения о новых селективных молекулярных онкомаркерах и прогностических гормональных факторах [13–15].
На сегодняшний день не существует стандартной методики лечения больных первично-множественными опухолями мочеполовой системы. Выбор адекватного объема лечения этого контингента больных представляет собой серьезную медицинскую проблему и в первую очередь должен определяться распространенностью опухолевых процессов.
О достоинствах и недостатках органосохраняющих и органоуносящих методов лечения онкоурологических заболеваний ученые спорят в течение последнего века. При системном поиске в Medlinе создается впечатление, будто до сих пор неясно, когда и к кому из больных применять этот колоссальный арсенал методик с наибольшей пользой и эффективностью.
Традиционными остаются органоуносящие операции, внушающие пациентам и ряду специалистов большее доверие своей основательностью и «радикальностью». Однако потеря органа и/или органов в результате оперативного лечения – это невозвратимые утраты для больного. Вместе с тем органосберегающие методики и эндоскопические операции вызывают у больных сомнения в их радикальности. Приверженность специалиста установкам своей школы налагает незримый отпечаток на принятие окончательного решения в выборе тактики. Немаловажную роль по-прежнему играет техническое оснащение клиники и стоимость лечения, иногда пожизненного. Неизбежно врач своим авторитетом подталкивает пациента к определенному выбору.
После введения критерия «качество жизни» как одного из современных показателей эффективности лечения картина кардинальным образом изменилась.
Предлагаем вашему вниманию опыт 18-летнего лечения пациента с 4 асинхронными злокачественными опухолями органов мочеполовой системы.
В доступной нам литературе упоминаний о подобных случаях не найдено.
Б о л ь н о й Р. 69 лет в марте 1994 г. впервые отметил примесь крови в моче с мелкими бесформенными сгустками. При УЗИ и КТ органов мочеполовой системы на левой боковой стенке мочевого пузыря выявлено объемное образование до 5 мм в диаметре на тонком основании без инфильтрации мышечного слоя. Поражений тазовых лимфатических узлов не выявлено. Структура печени и почек не изменена. При экскреторной урографии теней конкрементов в проекции мочевыводящих путей не выявлено, пассаж контрастированной мочи сохранен. На остеосцинтиграммах – воспалительно-дистрофические изменения костей скелета. При рентгенографии легких и на локальных снимках костного скелета метастатических изменений не выявлено. Показатели кислой и щелочной фосфатазы крови в пределах нормы.
В марте 1994 г. больному выполнена трансуретральная резекция (ТУР) мочевого пузыря. По результатам гистологического исследования диагностирован умеренно дифференцированный переходно-клеточный рак мочевого пузыря. При ТУР-биопсии неизмененной слизистой элементов опухолевого роста не получено. Установлена стадия заболевания рТ1N0М0.
Комплексное обследование проводилось каждые 3 месяца. При контрольной цистоскопии в январе 1995 г. выявлено 3 нежно-ворсинчатые опухоли на тонком основании до 4–6 мм в диаметре на задней стенке мочевого пузыря. По данным ТРУЗИ и МРТ инфильтрации мышечного слоя мочевого пузыря не выявлено. Произведена ТУР опухолей до мышечного слоя с биопсией неизмененных участков слизистой мочевого пузыря. Данные гистологического исследования: умеренно дифференцированный переходно-клеточный рак мочевого пузыря. При ТУР-биопсии неизмененной слизистой элементов опухолевого роста не получено. Больному начата внутрипузырная химиотерапия адриабластином. После двух сеансов развилась клиническая картина химического цистита. От дальнейшего проведения внутрипузырной химиотерапии больной категорически отказался.

С учетом склонности к мультифокальности процесса пациенту проведен курс дистанционной лучевой терапии в дозе 50 Гр на область мочевого пузыря. Отмечались симптомы лучевого цистита, купированные интравезикальными инстилляциями дибунола, применением анальгетиков трансректально и противовоспалительной терапией. При контрольных цистоскопиях до 1996 г. рецидива заболевания выявлено не было. Затем контроль осуществляли с помощью УЗИ и МРТ, так как цистоскопии из-за сужения дистального отдела уретры и шейки мочевого пузыря стали травматичными и пациент от них категорически отказался. Следует отметить наличие у него врожденной аномалии развития: головчатую форму гипоспадии.
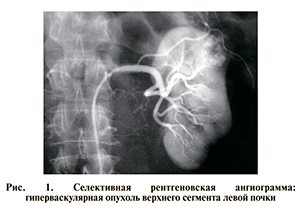
 При диспансеризации в августе 1995 г. по данным УЗИ и КТ с контрастным усилением выявлена опухоль верхнего сегмента левой почки. Регионарные лимфоузлы в процесс не вовлечены. В ЦКБ при дообследовании диагноз подтвержден данными ультразвуковой и прямой рентгенангиографии (рис. 1).
При диспансеризации в августе 1995 г. по данным УЗИ и КТ с контрастным усилением выявлена опухоль верхнего сегмента левой почки. Регионарные лимфоузлы в процесс не вовлечены. В ЦКБ при дообследовании диагноз подтвержден данными ультразвуковой и прямой рентгенангиографии (рис. 1).
Остеосцинтиграфия выявила воспалительно-дистрофические изменения. Костно-деструктивных изменений рентгенографически не было выявлено.
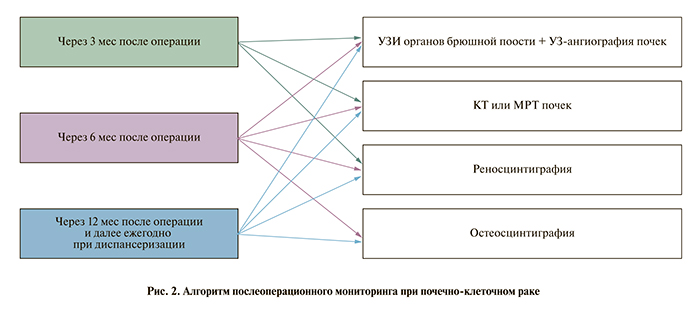
23.08.95 произведена резекция верхнего сегмента левой почки. Гистологически установлен диагноз высокодифференцированного светлоклеточного рака почки без признаков прорастания фиброзной капсулы. Время тепловой ишемии – 20 мин. Регионарного распространения процесса не отмечено. Установлена стадия заболевания Т1N0M0. Послеоперационный период протекал без особенностей. Повышения уровня мочевины и креатинина не отмечено. Послеоперационный мониторинг осуществлен по схеме (рис. 2).
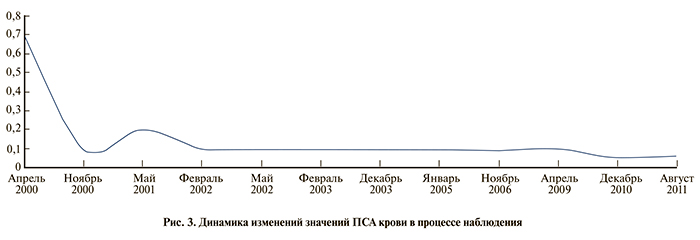
При очередном обследовании в марте 2000 г. на фоне нормальных значений ПСА отмечено прогрессирующее увеличение простаты в размерах (рис. 3).
В ходе ПРИ определялись уплотнение и нечеткость контуров левой доли простаты. По данным трансректальной УЗ-ангиографии в левой доле очаг пониженной эхогенности до 12 мм, нечеткость контуров простаты, нарушение капсулы простаты на значительном участке. При остеосцинграфии – очаги накопления радиофармпрепарата в в Тh8 и L4.
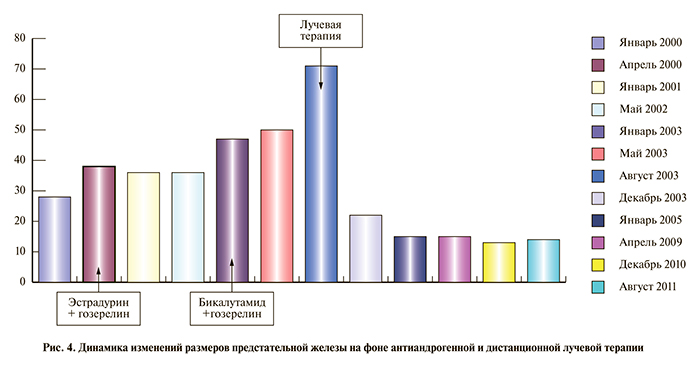
03.04.00 произведена трансперинеальная пункционная биопсия простаты. Гистологически диагностирован тубулоальвеолярный светлоклеточный рак простаты. МРТ-данных за поражение тазовых лимфатических узлов получено не было. Поражений регионарных лимфоузлов не выявлено. Установлена стадия заболевания T4NxM1. От проведения лучевой терапии пациент категорически отказался, лечение начато максимальной антиандрогенной блокадой (МАБ) эстрадурином и гозерелином по общепринятой схеме. Контроль осуществлялся измерением уровня ПСА, ТРУЗИ и остеосцинтиграфией (рис. 2, 4).
При остеосцинтиграфии отмечено появление новых очагов гиперфиксации радиофармпрепарата на фоне частичного исчезновения старых. Рентгенологически на локальных снимках и КТ костной деструкции отмечено не было.
В мае 2002 г. у пациента выявлено отграниченное поверхностное образование головки полового члена. В результате гистологического исследования соскоба диагностирован плоскоклеточный рак кожи головки полового члена. Установлена стадия процесса T1NxM1. Проведен курс дистанционной лучевой терапии на головку полового члена и область паховых лимфоузлов в дозе 60 Гр. Отмечен полный регресс опухолевых изменений кожи головки. Поражений паховых лимфоузлов не выявлено.
С января 2003 г. по данным ТРУЗИ рост объема простаты продолжился, отмечено прорастание опухоли простаты в заднюю уретру, появились боли в области крестца, отмечена уретроррагия. При ретроградной уретроцистографии выявлены сужение уретры до 5 мм и деформация простатического отдела уретры. Уровень ПСА в крови существенно не изменился. В июне произведена коррекция гормонотерапии рака предстательной железы: бикалутамид и гозерелин, без видимого эффекта. Опухоль признана гормонорезистентной, и после согласия пациента проведен радикальный курс дистанционной лучевой терапии на простату в дозе 51 Гр. С паллиативной целью (появление болей) проведена дистанционная лучевая терапия на кости правой половины таза и правого тазобедренного сустава в дозе 32 Гр (рис. 4).
Во время лучевой терапии отмечена острая задержка мочеиспускания, от троакарной эпицистостомии пациент категорически отказался. Был установлен постоянный уретральный катетер, проводилась терапия селективным α1А-адреноблокатором тамсулозином. В связи с психологическими особенностями пациента катетер был удален через 6 мес. Восстановилось самостоятельное мочеиспускание. Остаточной мочи нет.
При контрольном обследовании в конце декабря 2003 г.
отмечена выраженная положительная динамика. При УЗ-ангиографии в среднем сегменте левой почки выявлена простая киста 1,4 см. По данным ТРУЗИ объем простаты уменьшился до 24,2 см3.
В январе 2005 г. во время планового лечения пациента в терапевтическом отделении по поводу ИБС при обследовании констатирована дальнейшая положительная динамика.
При УЗ-ангиографии в паренхиме почек кровоток прослеживается до коркового слоя (рис. 5). Пассаж мочи не нарушен. Ректально простата плотная, безболезненная, уменьшена в размерах, слизистая над железой подвижна, срединная бороздка сглажена. При ТРУЗИ объем простаты уменьшился до 16 см3, капсула прослеживается фрагментарно, паренхима железы неоднородна с множественными кальцинатами. Эхогенность повысилась, в парапростатической клетчатке сосуды не лоцировались. Сосудистый рисунок железы обеднен. Семенные пузырьки дифференцируются (рис. 6). Показатели крови в пределах нормы. Незначительная лейкоцитурия. При остеосцинтиграфии на фоне воспалительно-инволютивных изменений сохраняется накопление радиофармпрепарата в Тh5 и L1 слабой интенсивности. Кожа головки полового члена не изменена.
 19.03.08 по поводу митрального стеноза больному выполнена резекция дистального отдела уретры. При гистологическом исследовании в части мелких фрагментов выявлен рост внутриэпидермального рака с началом инвазивного роста. В подлежащей дерме лимфоидная инфильтрация. Операция выполнена в пределах здоровых тканей. Кожа головки полового члена без признаков опухоли.
19.03.08 по поводу митрального стеноза больному выполнена резекция дистального отдела уретры. При гистологическом исследовании в части мелких фрагментов выявлен рост внутриэпидермального рака с началом инвазивного роста. В подлежащей дерме лимфоидная инфильтрация. Операция выполнена в пределах здоровых тканей. Кожа головки полового члена без признаков опухоли.
В ноябре 2009 г. при диспансеризации выявлены изменения кожи головки полового члена (рис. 7).
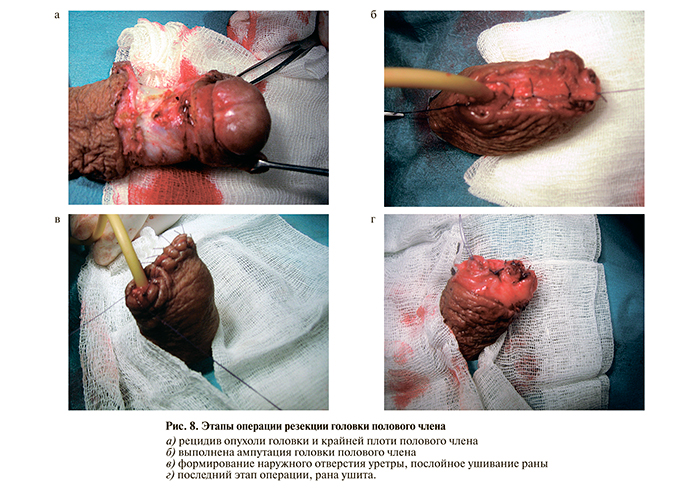
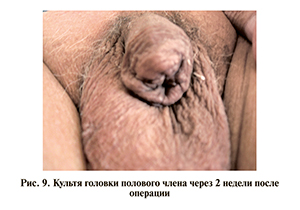
10.11.09 выполнена операция – резекция головки полового члена с экстренной биопсией (рис. 8). По результатам гистологического исследования установлен диагноз: плоскоклеточный ороговевающий рак. Вид культи головки полового члена через 2 нед после операции представлен на рис. 9.
Таким образом, пациент был избавлен от 4 злокачественных опухолей мочеполовой системы с помощью органосохраняющего оперативного лечения и радикальной лучевой терапии. Следует отметить, что такой результат удалось достичь лишь в условиях систематического диспансерного наблюдения, применения разработанных нами специальных скрининговых программ и схем послеоперационного мониторинга. Ультразвуковые методики играют определяющую роль в ранней диагностике и динамическом наблюдении пациентов. Применение новых методик ультрасонографии позволяет уменьшать травматичность диагностики и мониторинга онкоурологических заболеваний.
Применение новейшей аппаратуры для лучевой дистанционной терапии позволяет радикально и комфортно для пациента проводить лечение.
Главной целью всей системы медицинской помощи является восстановление или сохранение качества жизни.
Объем лечения в каждом конкретном наблюдении должен определяться индивидуально с учетом всех медицинских, социальных факторов и при активном участии самого пациента.
Регулярное диспансерное наблюдение данного пациента позволило вовремя диагностировать рецидив рака головки полового члена и развитие гормоно-резистентной фазы рака простаты, провести необходимую коррекцию лечения: дистанционную лучевую терапию и оперативное лечение соответственно.
Продемонстрированное наблюдение убедительно показывает необходимость многолетнего корректирующего мониторинга онкологических больных. Это особенно актуально для больных первично-множественным асинхронным раком.



