Введение. Несмотря на применение всех рекомендуемых методов обследования пациентов с гистологически верифицированным раком предстательной железы (РПЖ), ошибки стадирования процесса на этапе дооперационного обследования пока продолжают иметь место быть. По данным зарубежной литературы, в 30–60% случаев результаты гистологического исследования операционного материала после радикальной простатэктомии указывают на то, что клиническая стадия заболевания занижена [1]. Между тем точное определение стадии РПЖ необходимо для прогноза развития онкологического процесса и определения объема хирургического вмешательства.
В эпоху создания различных математических моделей, помогающих определить зону поражения предстательной железы, не уменьшается значимость методов исследования, основанных на визуальной оценке специалистом лучевой диагностики МРТ-изображений [2].
Целью настоящего исследования было оценить диагностическую значимость дооперационного выполнения МРТ малого таза пациентам, перенесшим радикальную простатэктомию.
Материал и методы. В клинике урологии МГМСУ им. А. И. Евдокимова на базе ГКБ № 50 проведено ретроспективное исследование историй болезни 360 пациентов, перенесших радикальную простатэктомию с февраля 2009 по март 2014 г. в клинике урологии МГМСУ. Выполнено сравнение предоперационных протоколов МРТ малого таза с результатами гистологического исследования операционного материала. Фиксировались такие формальные параметры, как наличие экстракапсулярного распространения опухоли и инвазия семенных пузырьков. Все МРТ выполнены не ранее чем через 4 нед после биопсии предстательной железы.
Средний возраст пациентов составил 61,4±6,2 (от 48 до 74 лет), индекс массы тела – 27,4±3,9. Объем предстательной железы колебался от 11 до 120 см3 и составил в среднем 41,7±20,0 см3. Содержание простатспецифического антигена в среднем соответствовало уровню 11,5±9,4 нг/мл.
Следует отметить, что, согласно дизайну исследования, были проанализированы заключения МРТ из разных лечебно-профилактических учреждений с целью максимально приблизить полученные результаты к стандартам «реальной клинической практики». Использование данных МРТ, выполненных в одном лечебном учреждении на одном аппарате одним специалистом, существенно ограничило бы возможность экстраполировать их на ситуацию в целом. При этом все гистологические заключения получены из нашей собственной кафедральной патоморфологической лаборатории. Несмотря на то что в стандартах выполнения МРТ больным РПЖ неоднократно подчеркивалась более высокая диагностическая ценность использования эндоректального датчика и/или напряженности магнитного поля 3 Тл; высокая стоимость и малая доступность таких исследований заставили нас отказаться от такого сужения критериев включения пациентов в исследование. Подавляющему большинству (74,3%) пациентов МРТ выполнялась без эндоректального датчика с напряженностью магнитного поля 1,5 Тл. Единственным обязательным условием выполнения МРТ стало применение контрастного усиления.
Определяли чувствительность, специфичность и общую точность МРТ малого таза пациентов с РПЖ отдельно по двум признакам: экстракапсулярная инвазия (ЭКИ) и инвазия семенных пузырьков опухолью с использованием традиционных статистических методов [3].
На первом этапе работы полученные результаты сопоставления данных по каждому признаку были разделены на четыре группы и формально озаглавлены следующим образом:
- Достоверно положительный (ДП) результат – распространение опухоли выявлено при МРТ и подтверждено гистологически.
- Ложноотрицательный результат (ЛО) – распространение опухоли не выявлено при МРТ, но подтверждено гистологическим исследованием.
- Ложноположительный результат (ЛП) или так называемая гипердиагностика – распространение опухоли заподозрено при МРТ и отсутствовало в заключении патоморфолога.
- Достоверно отрицательный результат (ДО) – отсутствие распространения опухоли по результатам МРТ, что совпадает с гистологическим заключением.
На втором этапе исследования рассчитаны показатели, характеризующие диагностическую значимость МРТ: чувствительность (способность выявлять заболевание), информативность – соотношение правильных заключений к общему числу окончательных диагнозов; специфичность – способность метода отвергать заболевание, констатировать его отсутствие там, где его действительно нет; общую точность – соотношение числа достоверно положительных и достоверно отрицательных заключений к общему числу окончательных диагнозов.
Для этого использованы приведенные ниже формулы [3].
Чувствительность=ДП/(ДП+ЛО).
Специфичность=ДО/(ДО+ЛП).
Общая точность=(ДП+ДО)/(ДП+ДО+ЛП+ЛО).
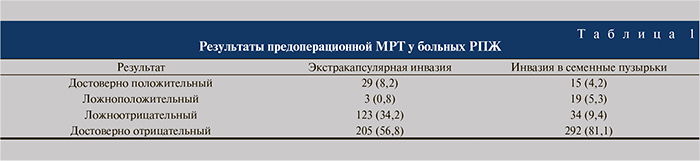
Результаты. При анализе результатов МРТ 360 включенных в исследование пациентов у 32 (8,9%) из них зафиксировано наличие ЭКИ. В ходе сопоставления этих результатов с данными гистологического исследования выяснилось, что в отношении 3 из 32, т.е. 9,4%, эти данные не подтвердились. В то же время имевшие место по данным гистологического исследования 123 случая ЭКИ не были диагностированы при МРТ.
Инвазия в семенные пузырьки описана в 34 случаях, из которых 19 оказались ложными и 15 подтвердились гистологически. Не диагностированными оказались 34 случая (табл. 1).
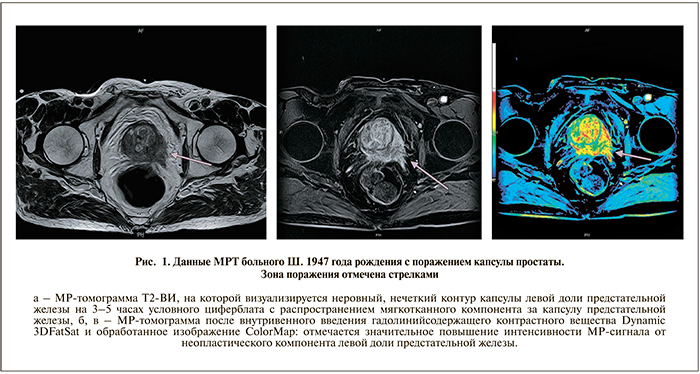
Согласно полученным нами данным, МРТ малого таза позволило диагностировать только 19,1% случаев экстракапсулярной инвазии из гистологически подтвержденных, что доказывает низкую чувствительность данного метода в отношении прогноза распространения опухоли простаты за границы пораженного органа. С другой стороны, из 32 ЭКИ, зафиксированных при МРТ, патоморфологическое исследование опровергло это утверждение только в отношении 3 пациентов. Таким образом, специфичность предоперационной МРТ в диагностике ЭКИ составила 98,5% и может быть признана высокой (рис. 1).
Соотношение числа достоверно положительных и достоверно отрицательных заключений ЭКИ к общему числу окончательных диагнозов (общая точность) составило 65%, что доказывает высокую диагностическую значимость МРТ для больных локализованным раком предстательной железы.
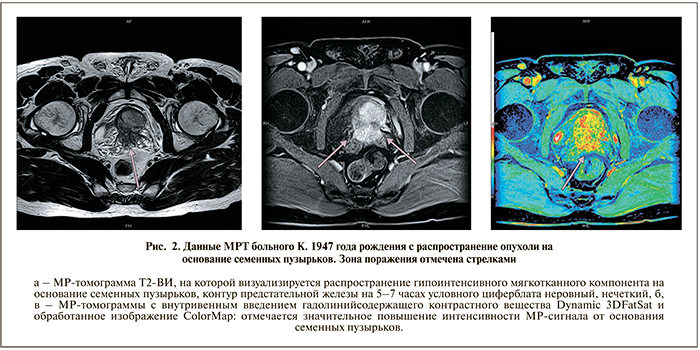
Диагностическая ценность МРТ в выявлении инвазии опухоли в семенные пузырьки оказалась низкой – 30,6%. При этом, как и в случае с ЭКИ, данные МРТ позволили «исключить» факт распространения опухолевого процесса на семенные пузырьки с высокой точностью – 93,9%. Таким образом, можно говорить о высокой специфичности МРТ для определения поражения семенных пузырьков. Общая точность диагностики инвазии опухоли в семенные пузырьки при помощи МРТ с контрастным усилением составила 85,3% (рис. 2, табл. 2).
Обсуждение. Приходится признать, что, несмотря на все усилия последних 10 лет, пристальный интерес урологов всего мира к проблеме ранней диагностики злокачественных заболеваний предстательной железы и стремительный технический прогресс по-прежнему ощущается острая нехватка в достоверных и информативных методах предоперационного обследования больных РПЖ. План лечения пациента напрямую зависит от распространенности опухолевого процесса, его локализации и прочих пространственных и качественных характеристик, способных при малейшем изменении исходных данных полностью поменять прогноз течения заболевания. Лучевая диагностика вместе с морфологическим исследованием лежит в основе диагностического поиска. Наиболее информативной из всех методов визуализации простаты бесспорно является МРТ. К обязательным требованиям к включению специалиста в рабочую группу экспертов Европейского общества урогенитальных радиологов относятся его участие в исследованиях, сравнивающих результаты заключений протоколов МРТ с таковым патоморфологов, совместная работа с урологами и т.д. [4].
В рекомендуемый протокол МР-исследования предстательной железы Европейское общество урогенитальных радиологов в 2012 г. включило следующие требования: напряженность магнитного поля 3 Тл, при 1,5 Тл предпочтительно использовать эндоректальный датчик, изображение должно включать весь орган, Т2-взвешенное изображение в аксиальной, фронтальной, сагитальной плоскостях с толщиной среза 3 мм, диффузно-взвешенное изображение, динамическая МРТ с контрастным усилением [4, 5]. С другой стороны, реалии нашего здравоохранения значительно лимитируют применение столь высоких стандартов. Аппараты для МРТ с мощностью 3 Тл и эндоректальными катушками нередко оказываются не доступными даже для жителей крупных городов РФ. В подавляющем большинстве к нам обращаются пациенты, выполнившие исследование на аппаратах 1,5 Тл без применения дополнительных датчиков. Задачей нашего исследования было выяснить валидность таких исследований и целесообразность их рутинного выполнения. В сравнительном анализе, описанном ниже, мы не приводим данных отечественной литературы (чувствительность, специфичность и общая точность МРТ малого таза при стадировании РПЖ) по причине отсутствия подобных обзорных работ.
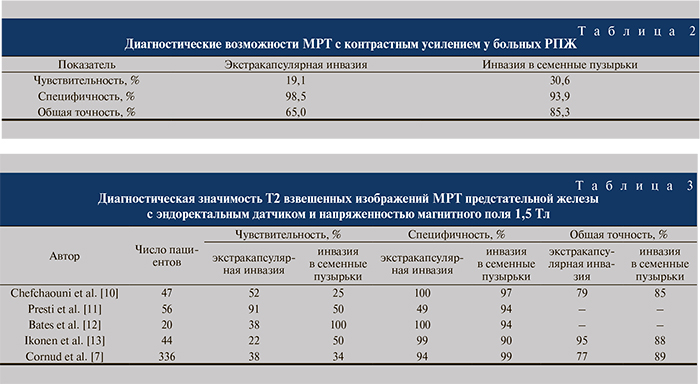
В мировой литературе растет количество публикаций, посвященных диагностической точности МРТ предстательной железы. Обращает на себя внимание тот факт, что большая часть зарубежных исследований по данной проблеме выполнена на небольших группах пациентов, а потому результаты, с нашей точки зрения, не всегда информативны и показательны (табл. 3) [6]. Другим общим недостатком всех найденных нами публикаций считается, по нашему мнению, слишком академический дизайн исследований, подразумевавших выполнение всех МР-томографий на одном аппарате одним и тем же исследователем. По числу пациентов наше исследование сопоставимо с работой F. Cornud и соавт., но и они приводят результаты только собственных исследований [7]. К тому же они выполняли МРТ через 2–3 нед после биопсии, а не через 4, как в нашем протоколе. Тем ни менее мы согласны с утверждением, будто МРТ с контрастным усилением целесообразно рекомендовать не всем без исключения пациентам, а только больным с высоким и промежуточным риском прогрессирования заболевания, оцененным по классификации Д’Амико.
Из общей картины выделяются результаты, описанные в публикациях T. Ваtes и J. Presti. Первый приводит данные о 100%-ной чувствительности при определении инвазии семенных пузырьков, второй – 91%-ной чувствительности при экстракапсулярной инвазии. Эти данные значительно отличаются от полученных другими специалистами, и различия, вероятно, могут быть обусловлены небольшим количеством наблюдений.
P. Kozlowski и соавт. [8] представили убедительные аргументы в пользу применения динамического контрастного усиления. В данной работе патоморфологические заключения сравнивали с данными МРТ (внешняя катушка на 1,5 Тл), выполненной в режимах диффузно-взвешенного изображения при комбинации с динамическим контрастным усилением и без такового. При этом зафиксировано увеличение чувствительности метода с 54 до 87% в группе, в которой использовалось контрастное усиление.
По данным [9], МРТ с напряженностью магнитного поля 1,5 Тл высокого пространственного разрешения (воксел 1,79 мм3) в комбинации с динамическим контрастным усилением и эндоректальной катушкой обеспечивает значительные преимущества в диагностике РПЖ и может повышать чувствительность до 86%, специфичность – до 95%.
Несмотря на формальные различия в дизайне исследований, прослеживается некоторое единство общей картины, свидетельствующей о высокой специфичности метода при показателях чувствительности, оставляющих желать лучшего.
Заключение. Полученные в ходе настоящего исследованиях данные позволяют утверждать, что МРТ малого таза с применением контрастного усиления на этапе дооперационной подготовки целесообразно выполнять всем пациентам с РПЖ, относящимся к группам промежуточного и высокого риска прогрессирования заболевания по системе градации Д’Амико. Наши данные – одно из звеньев в цепочке публикаций, посвященных стандартизации подхода к МРТ-исследованиям в онкоурологии. Чувствительность этого метода во многом зависит от опыта специалиста лучевой диагностики и технических возможностей оборудования, но полученные результаты безусловно обнадеживают. Общая точность применения МРТ в определении наличия экстракапсулярной инвазии рака простаты – 65%. Общая точность применения МРТ для определения инвазии в семенные пузырьки – 85,3%. Оба показателя отражают высокую диагностическую ценность МРТ у больных раком предстательной железы.
При выявлении ЭКИ и поражения семенных пузырьков по результатам МРТ эти данные следует принимать в расчет при определении стадии заболевания и формировании плана оперативного вмешательства, поскольку специфичность таких изменений весьма высока – 98,5 и 93,9% соответственно.
Результаты нашего исследования могут быть экстраполированы в «реальную клиническую практику», поскольку критерии включения пациентов в данное исследование соответствуют стандартам «реальной клинической практики».
Работа выполнена при поддержке Министерства образования и науки РФ, НШ-5428.2014.7.



