Введение. В настоящее время эпителиальные образования мочевыводящих путей занимают одну из ведущих позиций в структуре всех онкоурологических заболеваний. Это обусловлено не только распространенностью онкологических поражений данной области, но и быстрым прогрессированием и высокой частотой рецидивирования [1].
 Согласно статистическим данным, в 2013 г. в структуре заболеваемости злокачественными новообразованиями в России доля впервые выявленного рака мочевого пузыря составила 2,7%, обеспечив заболеванию 13-е ранговое место. В абсолютных значениях этот показатель составил 14 327 случаев для обоих полов [2]. Несмотря на то что опухоли мочевого пузыря по своему гистогенезу достаточно разнообразны, основную долю (95%) составляют опухоли эпителиального происхождения: переходноклеточная и плоскоклеточная папиллома, переходноклеточный и плоскоклеточный рак, аденокарцинома, недифференцированный рак. На все остальные формы приходится 5–10%. Впервые выявленный рак почки составил 3,9% (20 892 случая для обоих полов), заняв при этом 10-е ранговое место [2]. Эпителиальные опухоли почечной лоханки и чашечек в структуре рака почки составляют от 10 до 25%; опухоли мочеточника встречаются значительно реже – в 1–2% наблюдений [2]. Среди всех онкологических поражений верхних мочевыводящих путей (ВМП) первое место занимают опухоли эпителиального происхождения: переходноклеточный рак, на долю которого приходится 92–99% всех опухолей ВМП; плоскоклеточный рак, составляющий 1–8%; переходноклеточная папиллома, инвертированная папиллома, аденокарцинома. В то же время на долю мезенхимальных опухолей приходится только 1% [1].
Согласно статистическим данным, в 2013 г. в структуре заболеваемости злокачественными новообразованиями в России доля впервые выявленного рака мочевого пузыря составила 2,7%, обеспечив заболеванию 13-е ранговое место. В абсолютных значениях этот показатель составил 14 327 случаев для обоих полов [2]. Несмотря на то что опухоли мочевого пузыря по своему гистогенезу достаточно разнообразны, основную долю (95%) составляют опухоли эпителиального происхождения: переходноклеточная и плоскоклеточная папиллома, переходноклеточный и плоскоклеточный рак, аденокарцинома, недифференцированный рак. На все остальные формы приходится 5–10%. Впервые выявленный рак почки составил 3,9% (20 892 случая для обоих полов), заняв при этом 10-е ранговое место [2]. Эпителиальные опухоли почечной лоханки и чашечек в структуре рака почки составляют от 10 до 25%; опухоли мочеточника встречаются значительно реже – в 1–2% наблюдений [2]. Среди всех онкологических поражений верхних мочевыводящих путей (ВМП) первое место занимают опухоли эпителиального происхождения: переходноклеточный рак, на долю которого приходится 92–99% всех опухолей ВМП; плоскоклеточный рак, составляющий 1–8%; переходноклеточная папиллома, инвертированная папиллома, аденокарцинома. В то же время на долю мезенхимальных опухолей приходится только 1% [1].
«Золотым» стандартом диагностики эпителиальных опухолей мочевыводящих путей являются цистоскопия и уретеронефроскопия, позволяющие урологу осмотреть весь пораженный уротелий и при необходимости выполнить биопсию, удаление опухоли или аблацию подозрительных участков.
Сочетание эндоскопии с узкоспектровой диагностикой (Narrow Band Imaging – NBI) – оптический метод повышения качества визуализации, разработанный компанией «Olympus» (Япония). Технология позволяет с помощью фильтров выделять оптические волны определенной длины и получать более качественное и контрастное изображение сосудистого рисунка подслизистого слоя уротелия, применяя эффект выборочного поглощения гемоглобином некоторых длин волн видимого спектра светового излучения, и тем самым лучше выявлять участки с измененным кровотоком. Применение режима NBI при исследованиях помогает идентифицировать специфичный сосудистый рисунок опухолей и определять зоны, пораженные дисплазией высокой степени. При освещении поверхности слизистой мочевой системы лучом узкой полосы спектрального излучения свет, активно поглощаясь кровеносными сосудами, легко проникает сквозь ткани слизистой оболочки. В результате появляется возможность контрастного выделения капилляров и других структур слизистых. Раньше узкоспектровое исследование можно было выполнять только с помощью видеофиброцистоскопа. В настоящее время создана новая видеоплатформа, позволяющая работать практически с любым ригидным и гибким эндоскопическим инструментом. Мы имеем опыт применения узкоспектровой диагностики с 2008 г. более чем 600 больными с опухолями верхних и нижних мочевыводящих путей. Метод достаточно хорошо изучен при диагностике опухолей мочевого пузыря и в связи с созданием новой эндоскопической платформы начинает активно внедряться в стандартную клиническую практику диагностики опухолей ВМП [3–7].
 В то же время получить более контрастное изображение сосудистого рисунка подслизистого слоя уротелия возможно путем компьютерной обработки изображения в режиме реального времени. Метод получил название компьютерной хромоэндоскопии, при этом за счет изменения спектра света и контрастирования изображения может быть получена более информативная эндоскопическая картина [8]. На этапе освоения технологии применяли компьютерную коррекцию получаемого с видеокамеры цифрового сигнала путем частичной замены каналов RGB (как одно из, на наш взгляд, наиболее эффективных преобразований видеосигнала): красный канал заменялся на зеленый, а зеленый – на синий. Перед этим увеличивали насыщенность оранжевого и голубого спектра цвета для максимальной контрастности. Для решения подобных задач использовали оборудование компании «Karl Storz» (Германия).
В то же время получить более контрастное изображение сосудистого рисунка подслизистого слоя уротелия возможно путем компьютерной обработки изображения в режиме реального времени. Метод получил название компьютерной хромоэндоскопии, при этом за счет изменения спектра света и контрастирования изображения может быть получена более информативная эндоскопическая картина [8]. На этапе освоения технологии применяли компьютерную коррекцию получаемого с видеокамеры цифрового сигнала путем частичной замены каналов RGB (как одно из, на наш взгляд, наиболее эффективных преобразований видеосигнала): красный канал заменялся на зеленый, а зеленый – на синий. Перед этим увеличивали насыщенность оранжевого и голубого спектра цвета для максимальной контрастности. Для решения подобных задач использовали оборудование компании «Karl Storz» (Германия).
Цель работы: изучить возможности узкоспектровой эндоскопии и компьютерной хромоэндоскопии в диагностике эпителиальных образований мочевого пузыря и ВМП.
Материалы и методы. Эффективность применения дополнительных эндоскопических методов диагностики оценивали проспективно у пациентов с эпителиальными образованиями мочевого пузыря и ВМП, проходивших лечение на базе отделения урологии ГКБ № 57 Москвы (ранее ГКУБ № 47) с сентября 2010 по сентябрь 2014 г.
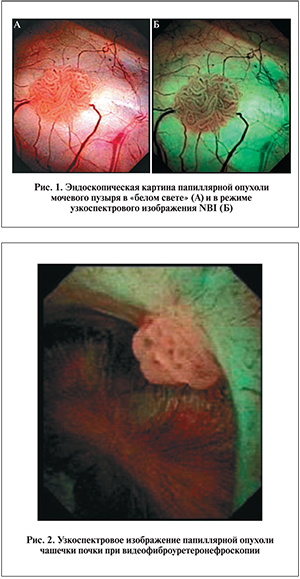
Дополнительная диагностика при эндоскопическом осмотре нижних мочевыводящих путей была выполнена 76 пациентам в возрасте от 36 до 82 лет с ранее установленным диагнозом мышечно-неинвазивного рака мочевого пузыря (РМП) или подозрением на него по данным клинического обследования (ультрасонография, МРТ, КТ). Использовали ригидные уретроцистоскопы и резектоскопы диаметром 16–28 Fr с применением оптик 12° и 30°, а также фиброцистоскопы диаметром 16 Fr. В целом было выполнено 132 уретроцистоскопии. Ригидная уретроцистоскопия проведена 49 (64,5%) пациентам (80 [60,6%] исследований), фиброуретроцистоскопия – 27 (35,5%) (52 [39,4%] исследования). После тщательного первоначального осмотра мочевого пузыря в «белом свете» в ходе 58 (43,9%) исследований дополнительно использовали узкоспектровую диагностику (рис. 1) и 74 (56,1%) – компьютерную хромоэндоскопию. Патологические новообразования удаляли с помощью монополярной, биполярной или лазерной резекции (в т.ч. с применением методики en bloc), в местах с измененной слизистой выполняли «холодную» биопсию.
Для оценки эффективности применения дополнительных технологий при эндоскопическом осмотре ВМП были обследованы 47 пациентов (19 – с единственной или единственно функционирующей почкой) в возрасте от 51 года до 82 лет с установленным диагнозом или подозрением (по данным экскреторной урографии или КТ) на папиллярные образования мочеточника (27 больных), лоханки (14) или чашечек почки (6), которым выполнено 57 эндоскопических исследований ВМП с помощью ригидных и гибких уретеропиелоскопов диаметром 6–9Fr, а также ригидного нефроскопа диаметром 26 Fr.
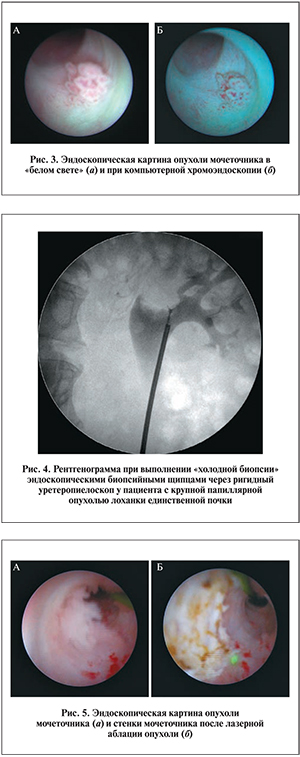
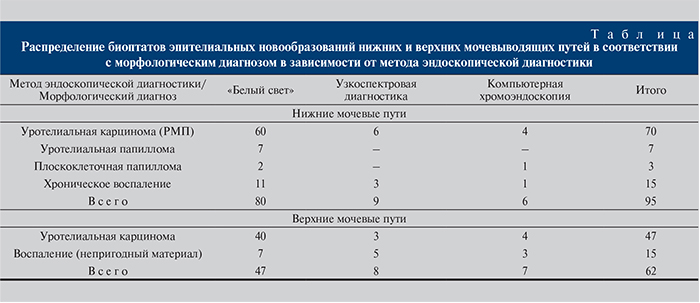
Трансуретральная уретеронефроскопия выполнена 45 (95,7%) пациентам (54 [94,7%] исследования), перкутанная пиелокаликоскопия – 2 (4,3%) (3 [5,3%] исследования). В 30 (52,6%) исследованиях помимо уретеронефроскопии в «белом свете» дополнительно применялась узкоспектровая диагностика (рис. 2), в 27 (47,4%) – компьютерная хромоэндоскопия (рис. 3).
Папиллярные образования после их биопсии «холодными» щипцами (рис. 4) или корзинками удаляли с помощью электро- или лазерной аблации (рис. 5). Места слизистой с измененным сосудистым рисунком подвергали биопсии.
Результаты и обсуждение. Всего при уретроцистоскопии было заподозрено 95 патологических новообразований мочевого пузыря, среди которых 72 (75,8%) имели экзофитный рост, а 23 (24,2%) – вид плоских опухолей, из них в 5 (5,3%) случаях опухоль прорастала устье мочеточника. Пятьдесят семь (60%) образований были размером от 0,5 до 1,0 см, 22 (23,2%) – 1–2 см и 16 (16,8%) – более 2 см. Все образования были полностью удалены с помощью различных электрохирургических и лазерных методик и исследованы морфологически.
При эндоскопическом осмотре мочевого пузыря только в «белом свете» выявлено и удалено 80 подозрительных новообразований, при морфологическом исследовании которых в 60 (75%) случаях был установлен диагноз эпителиального РМП (уротелиальная карцинома), в 7 (8,7%) наблюдениях найдена уротелиальная папиллома и в 2 (2,5%) – плоскоклеточная папиллома (см. таблицу). Дополнительное применение новой видеоплатформы NBI позволило выявить и удалить еще 9 (9,5%) патологических новообразований, 6 (66,7%) из которых морфологически оказались переходноклеточным раком. Дополнительное применение компьютерной хромоэндоскопии позволило диагностировать еще 6 (6,3%) новообразований, пропущенных при осмотре в «белом свете». По результатам морфологического исследования 4 (66,7%) образца являлись переходноклеточным раком, 1 (16,7%) – плоскоклеточной папилломой, в 1 (16,7%) образце получено хроническое воспаление.
Таким образом, при морфологическом исследовании всех 95 биоптатов, полученных из новообразований, подозрительных на эпителиальные опухоли мочевого пузыря, в 25 (26,3%) образцах диагноз рака не подтвержден: уротелиальная папиллома установлена в 7 (7,4%) биоптатах, плоскоклеточная – в 3 (3,1%) и хроническое воспаление – в 15 (15,8%). В 70 (73,7%) биоптатах установлен диагноз переходноклеточного рака, при этом при осмотре только в «белом свете» диагноз установлен в 60 (85,7%) случаях, дополнительное применение узкоспектровой диагностики и компьютерной хромоэндоскопии позволило верифицировать еще 6 (8,6%) и 4 (5,7%) уротелиальных карцином соответственно, повысив выявляемость рака мочевого пузыря суммарно на 14,3 %.
При эндоскопическом осмотре ВМП в 52 (91,2%) исследованиях с помощью ригидной и гибкой эндоскопии удалось полностью осмотреть весь уротелий, в 5 (8,8%) случаях всю чашечно-лоханочную систему полностью осмотреть не удалось из-за чрезмерно узких и длинных шеек чашечек или очень острого угла между мочеточником и нижней чашечкой.
Всего было заподозрено 62 патологических новообразования ВМП, среди которых 20 (32,3%) составили мелкие образования (менее 0,5 см в диаметре), 34 (54,8%) – средних размеров (от 0,5 см до 1 см) и 8 (12,9%) – крупных (более 1 см в диаметре). Все образования были полностью удалены с помощью различных электрохирургических и лазерных методик или эндоскопических биопсийных щипцов и исследованы морфологически.
При эндоскопическом осмотре ВМП только в «белом свете» выявлено и удалено 47 подозрительных новообразований, при морфологическом исследовании которых в 40 (85,1%) случаях был установлен диагноз уротелиальной карциномы – переходноклеточного рака ВМП (см. таблицу). Дополнительное применение узкоспектрового режима диагностики позволило выявить и удалить еще 8 (12,9%) патологических новообразований, 3 (37,5%) из которых морфологически являлись переходно-клеточной карциномой. С помощью компьютерной хромоэндоскопии удалось выявить еще 7 (11,3%) новообразований, пропущенных при осмотре ВМП в «белом свете», 4 (57,1%) из которых оказались переходноклеточной карциномой. Во всех остальных случаях или диагностировано хроническое воспаление, или материал был не пригоден для морфологического исследования.
Таким образом, при морфологическом исследовании 62 биоптатов, полученных из новообразований, подозрительных на папиллярные опухоли ВМП, в 15 (24,2%) образцах диагноз рака не подтвержден. Переходноклеточная карцинома установлена в 47 (75,8%) исследованиях, при этом в ходе осмотра ВМП только в «белом свете» диагноз установлен в 40 (85,1%) случаях, дополнительное применение узкоспектровой диагностики и компьютерной хромоэндоскопии позволило верифицировать еще 7 (14,9%) злокачественных опухолей.
Заключение. Использование узкоспектровой диагностики и компьютерной хромоэндоскопии позволило на 14,3% улучшить диагностику РМП и на 14,9% повысить выявляемость переходноклеточной карциномы ВМП на этапе освоения метода. Дальнейшие исследования в этом направлении позволят более точно определить диагностическую ценность (чувствительность и специфичность) данных методик.



