Введение Проблема социально-медицинской реабилитации пациентов после успешного лечения онкологических заболеваний в отсутствие рецидива является одной из ведущих во всем мире. Особенно актуальна сексуальная реабилитация для определенной категории молодых, а также сексуально активных мужчин [1].
Основным хирургическим методом лечения рака полового члена на сегодняшний день является резекция/ампутация головки и ствола полового члена в пределах здоровых тканей. Очевидно, что успешное оперативное вмешательство продлевает жизнь пациента, но приводит к его тяжелейшей социально-психологической дезадаптации. Для возрастных пациентов, как правило, важна возможность осуществлять мочеиспускание привычным образом. Но для сексуально активных мужчин актуально восстановление половой функции. То же относится и к мужчинам с последствиями травматического повреждения или ампутации полового органа [2].
 Для улучшения качества жизни этих мужчин и их сексуальной адаптации предложены различные реконструктивно-пластические операции, заключающиеся в коррекции размеров полового члена или его реконструкции.
Для улучшения качества жизни этих мужчин и их сексуальной адаптации предложены различные реконструктивно-пластические операции, заключающиеся в коррекции размеров полового члена или его реконструкции.
В случаях полной утраты полового члена оптимально выполнение тотальной фаллоуретропластики различными методиками [3]. В случаях частично сохранной культи ствола полового члена и нецелесообразности или нежелания пациента подвергаться фаллоуретропластике, приходится прибегать к другим хирургическим методикам.
Удлинение культи полового члена возможно посредством лигаментотомии с мобилизацией кавернозных тел [4]. Для закрытия кожного дефекта ствола полового члена рекомендуется аутодермопластика свободным расщепленным или полнослойным кожным трансплантатом, а также скротальными или паховыми лоскутами [2, 5].
Для визуальной симуляции головки полового члена укрывают верхушки кавернозных тел уретральными лоскутами или дермальными трансплантатами, а реконструкцию головки выполняют васкуляризированным мышечным лоскутом из передней брюшной стенки или мошонки [6–8]. Пластику дефекта уретры проводят, как правило, двухэтапно местными тканями в комбинации с буккальными трансплантатами [1, 9].
К сожалению, все существующие методики далеки от совершенства и не лишены недостатков, что и обусловливает поиск альтернативных методик реконструкции полового члена.
Приводим наш опыт успешной социально-психологической и сексуальной реабилитации пациента, перенесшего ампутацию полового члена по поводу рака при устойчивом отсутствии рецидива. Пациенту была выполнена комплексная реконструкция всех частей утраченного органа (кавернозных тел, уретры, головки) с использованием общепринятых и инновационных методик реконструктивно-пластической хирургии. Описания подобных вмешательств в литературе мы не нашли.
П а ц и е н т Ф. 57 лет. В 2005 г. по поводу рака полового члена выполнена ампутация органа в пределах границы средней и проксимальной трети с последующей химиотерапией. В 2007 г. в связи с желанием пациента улучшить сексуальную жизнь по месту жительства была осуществлена попытка удлинения полового члена и реконструкция головки кожно-мышечным лоскутом из передней брюшной стенки на осевом кровотоке. Исход операции неудачный – развился некроз трансплантата в течение 1 мес. после операции.
В марте 2013 г. обратился в отделение андрологии и урологии ЭНЦ с жалобами на сексуальную дисфункцию по причине малого размера культи полового члена. Не курит с 2007 г. Алкоголем не злоупотребляет. Имеет двоих детей.
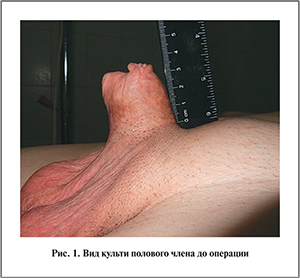
Общий соматический статус удовлетворительный. Культя полового члена при инициации эрекции до 3 см в длину (рис. 1).
Наружное отверстие уретры свободное, локализуется на верхушке культи полового члена, уринация не нарушена. Яички расположены в мошонке нормальных размеров, плотно-эластической консистенции, безболезненные при пальпации. Per rectum: простата умеренно увеличена, мягкоэластической неоднородной консистенции, безболезненная при пальпации. Срединная бороздка сохранена. Биохимический и общеклинический анализы крови без значимых отклонений. Анализ мочи без патологических изменений.
Данные УЗИ. Почки расположены типично, контуры четкие, неровные, паренхиматозный слой справа до 18 мм, слева до 19 мм, чашечно-лоханочная система обеих почек не расширена, уплотнена. Мочевой пузырь: контуры четкие, ровные, стенка не утолщена, содержимое однородное. Предстательная железа: размеры 41х22х42 мм, структура неоднородная, в периуретральной зоне участки повышенной эхогенности до 5 мм. Яички в мошонке нормальной эхогенности с четкими, ровными контурами, правое 4,8х3,3х2,7 см; левое 4,5х3,2х2,5 см. Придатки без особенностей, вены яичек не расширены, свободной жидкости нет.
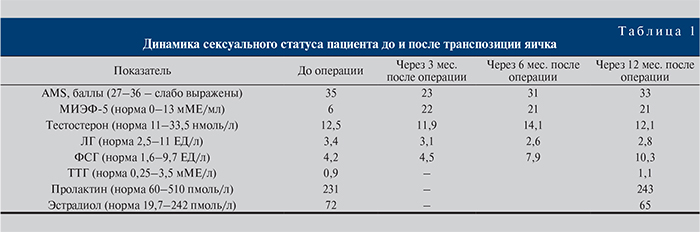
 Для выявления возможного андрогенного дефицита использован опросник Aging male symptom (AMS). Оценку качества эрекции проводили с помощью опросника МИЭФ-5. Уровни тестостерона, ТТГ, пролактина, секс-стероид-связывающего глобулина (СССГ) в крови не выходили за пределы референсных значений (табл. 1).
Для выявления возможного андрогенного дефицита использован опросник Aging male symptom (AMS). Оценку качества эрекции проводили с помощью опросника МИЭФ-5. Уровни тестостерона, ТТГ, пролактина, секс-стероид-связывающего глобулина (СССГ) в крови не выходили за пределы референсных значений (табл. 1).
Пациенту было проведено трехэтапное оперативное лечение – увеличивающая фаллогланулоуретропластика. Продолжительность периодов реабилитации между этапами составила 5–12 мес.
В марте 2013 г. в ходе первой операции выполнено рассечение поддерживающей связки полового члена (лигаментотомия) в комбинации с корпоротомией и графтингом аллотрансплантатом, что обеспечило условия для удлинения кавернозных тел полового члена до 8 см. Для реконструкции кожных покровов использовали свободный расщепленный кожный аутолоскут с передней поверхности бедра.
Через 3 мес. после полного заживления ран пациент возобновил сексуальную активность, однако уменьшившийся в длине до 6 см половой член и недостаточная эротическая чувствительность не устраивали мужчину. В связи с этим в сентябре 2013 г. он вновь обратился в ЭНЦ с настойчивой просьбой воссоздать головку полового члена. Поскольку прошлая попытка реконструкции головки полого члена из мышечного аутолоскута закончилась неудачей, была предложена инновационная методика: неогланулопластика методом транспозиции яичка на питающей сосудистой ножке на апикальную часть кавернозных тел. После всестороннего обсуждения с пациентом возможных исходов планируемой операции и подписания информированного согласия был проведен следующий этап хирургического лечения.
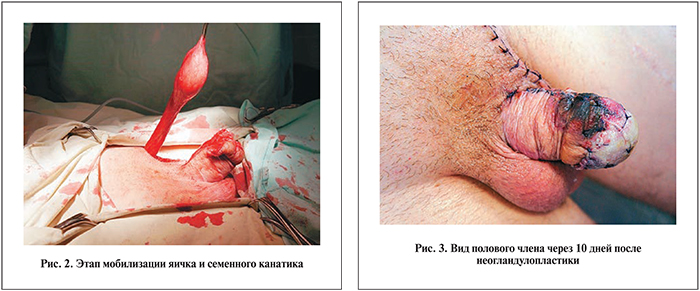
Боковым разрезом мошонки мобилизовано левое яичко вместе с семенным канатиком и после подготовки реципиентной зоны фиксировано на апикальную часть кавернозных тел. Семенной канатик укрыт дубликатурой кожных лоскутов на дорсальной поверхности полового члена. Операция завершена трансплантацией свободного аутодермального лоскута на фасции транспозированного яичка. В мошонку установлен тестикулярный имплантат (рис. 2, 3).
Послеоперационный период протекал без особенностей.
Половая активность возобновлена через 4 мес. после операции. Качество полового акта пациент оценивал как удовлетворительное. В течение первых 4 нед. время коитуса (5 половых актов) пациент ощущал слабые ноющие болевые ощущения в паховой области слева, которые уменьшались и полностью прекратились через 2 мес. после начала половой жизни. В дальнейшем частота половых актов составляла 2–3 раза в неделю. Начиная с 3-го месяца половой активности дискомфорта при коитусе не возникало. Кроме того, пациент отмечал умеренную дополнительную сексуальную стимуляцию от соприкосновения неоголовки со стенками влагалища.
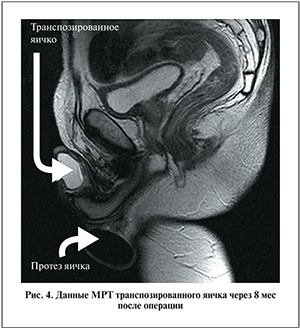
В ходе наблюдения за пациентом в течение года не было выявлено патологических процессов, кроме повышения уровня ФСГ в крови. Динамика клинико-биохимических показателей и онкомаркеров представлена в табл. 1, 2. При УЗДГ определен сохранный артериальный кровоток в паренхиме транспозированного яичка. При МРТ хорошо визуализировались перемещенное яичко (неоголовка полового члена), в мошонке – тестикулярный имплантат (рис. 4).
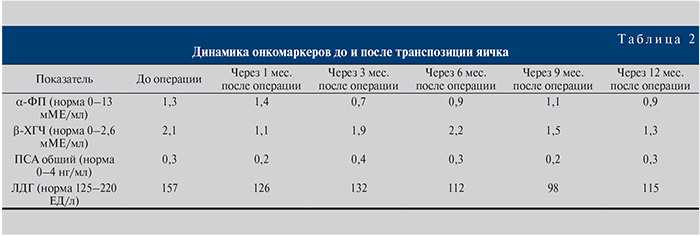
Через год после формирования неоголовки пациент вновь госпитализирован для проведения заключительного этапа лечения – уретропластики. Была выполнена одноэтапная уретропластика методом дорсальной вставки буккальной слизистой и тубуляризации неоуретры с укрытием раневого дефекта ротированным скротальным кожнофасциальным лоскутом (рис. 5). Послеоперационный период без особенностей. Через 4 нед. восстановлено самостоятельное мочеиспускание и удалена цистотома.
Выполнение данной нестандартной операции было обусловлено настойчивым желанием пациента иметь удовлетворительную половую функцию. При принятии решения мы учитывали факторы возможного риска развития онкопроцесса в транспозированном яичке. Известно, что доля опухолей яичка составляет 1–1,5% в структуре общей онкологической заболеваемости мужчин. В западных странах регистрируют 3–10 новых случаев заболевания в год на 100 тыс. мужского населения. Пик заболеваемости приходится на 3-й десяток жизни для несемином и на 4-й десяток жизни – для семиномы. Встречаются случаи семейного рака яичка, особенно среди родных братьев. К эпидемиологическим факторам риска развития опухолей яичка относятся крипторхизм, синдром Кляйнфельтера, опухоли яичка в анамнезе ближайших родственников, наличие контралатеральной опухоли в яичке, а также бесплодие [10].
В нашем случае у пациента не было выявлено ни одного классического фактора риска развития онкопроцеса в яичках при неотягощенной наследственности. Согласно рекомендациям Европейской ассоциации урологов (2015), регулярная травматизация не рассматривается как фактор, предрасполагающий к возникновению онкопроцесса в яичке.
С пациентом до выполнения оперативного пособия были детально обсуждены риски возникновения онкопоражения и периоперационных осложнений. Несмотря на отсутствие формальных факторов риска развития онкопроцесса в транспозированном яичке, мы продолжаем мониторинг состояния по персонифицированному плану. На сегодняшний день польза скрининговых онкопоисковых программ не доказана, однако продемонстрировано, что стадия и прогноз заболевания непосредственно связаны с ранней диагностикой [10], поэтому пациенту рекомендовано наблюдение в режиме 1 консультация в 3 мес. в течение первого года после операции, 1 раз в 6 мес. на втором году и далее 1 раз в год в течение всей жизни.
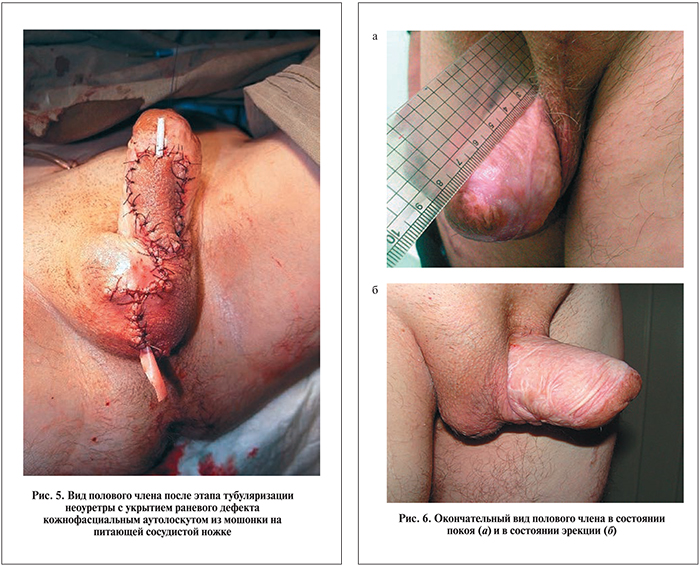
У пациента полностью восстановлена половая функция с возможностью проведения удовлетворительного сексуального общения при сохранении семяизвержения. Транспозированное яичко у пациента вызывало незначительные болевые ощущения только при первых половых контактах. Необходимо подчеркнуть, что данный успешный результат лечения достигнут за счет комплексной реконструкции полового члена только аутотканями и без проведения вспомогательной имплантации пенильных эндопротезов в кавернозные тела и/или неофаллопластики (рис. 6).
Заключение. Операция неогланулопластики транспозицией аутотестикула эффективна и безопасна (в краткосрочном периоде), а также позволяет улучшать сексуальную функцию пациента после ампутации полового члена.
Мы не нашли в литературе аналога выполненной операции и выражаем надежду, что предложенная технология не оставит равнодушными коллег и вызовет всестороннее обсуждение, а в дальнейшем, возможно, дополнит имеющийся арсенал реконструктивно-пластических операций, используемых для реконструкции полового члена.


