Введение
Нозокомиальные инфекции (синонимы: госпитальные; внутрибольничные), согласно современным представлениям, рассматриваются в группе инфекций, связанных с оказанием медицинской помощи (healthcare-associated infections). В ту же группу входят инфекции у больных, получающих программный гемодиализ или перитонеальный диализ, инфекции, возникающие у лиц, находящихся в учреждениях социальной защиты населения, санаторно-оздоровительных учреждениях, а также получающих лечение в дневных стационарах поликлиник (Покровский В.И. и соавт., 2012). Среди инфекций, связанных с оказанием медицинской помощи, нозокомиальная группа имеет значительную распространенность, а также наибольшее медицинское, социальное и экономическое значение.
Для разграничения внебольничных и нозокомиальных инфекций в настоящее время принят интервал 48 ч от времени госпитализации, хотя из-за условности этого критерия в некоторых пограничных ситуациях решение об отнесении инфекции к внебольничной или нозокомиальной должно приниматься индивидуально. Таким образом, к нозокомиальным инфекциям мочевыводящих путей (МВП) относятся те, которые возникают через 48 ч и более от момента госпитализации пациента (при исключении инкубационного периода внебольничных инфекций), а также в течение 1 мес после выписки пациента, но непосредственно связанные с проведенными в стационаре лечением и обследованием. Не рассматриваются в качестве нозокомиальных инфекции, симптомы которых наблюдались при госпитализации пациента и прогрессировали в последующем с развитием осложнений, даже если происходила смена возбудителя. Например, у пациента, госпитализированного с обострением хронического пиелонефрита, осложнившемся в последующем абсцессом почки и уросепсисом, инфекцию следует трактовать как внебольничную.
Эпидемиология
Нозокомиальная инфекция МВП, согласно современным эпидемиологическим данным, является второй по частоте после нозокомиальной инфекции нижних дыхательных путей (пневмония и трахеобронхит). При этом еще два десятилетия назад инфекция МВП занимала первое место в этой группе.
Согласно данным CDC (Centers for Disease Control and Prevention), NHSN (National Healthcare Safety Network), NNIS (National Nosocomial Infection Surveillance), нозокомиальные инфекции МВП составляют 30% всех госпитальных инфекций, регистрируемых в стационарах США, при этом их частота превышает 560 тыс. случаев ежегодно (Klevens R.M., 2007; Hidron A.I., 2008).
Только в скоропомощных стационарах США ежегодно диагностируют 93,3 тыс. случаев нозокомиальных инфекций МВП, 75% которых связаны с наличием катетера (Magill S.S., 2014). Данные ежегодного мониторинга NHSN показывают увеличение частоты нозокомиальных инфекций МВП в стационарах США с 2009 по 2013 г. на 6%, однако с 1990 г. и по настоящее время (Burton D., 2011) глобальная частота таких инфекций существенно сократилась за счет внедрения программ профилактики катетер-ассоциированных инфекций МВП в отделениях реанимации и интенсивной терапии (ОРИТ).

По данным NHSN, в 2010 г. частота катетер-ассоциированных инфекций МВП составила от 4,7/1000 катетерных дней в ожоговых ОРИТ до 1,3/1000 – в медицинских и хирургических ОРИТ; в педиатрических ОРИТ частота инфекций отмечалась в пределах 2,2–3,9/1000 катетерных дней.
Более высокие значения частоты нозокомиальных инфекций МВП демонстрируют проспективные многоцентровые исследования. В частности, P.A. Tambyah и соавт. (2000) оценивают ежегодное количество нозокомиальных инфекций МВП в 1 млн эпизодов, большая часть которых связана с мочевым катетером. Недооценка частоты нозокомиальных инфекций МВП в официальных статистических отчетах логично объясняется тем, что большая их часть характеризуется нетяжелым и малосимптомным течением, быстро прекращается после удаления катетера и поэтому не регистрируется. Это стало особенно заметным после 2008 г., когда американские компании обязательного медицинского страхования Medicare и Medicaid перестали оплачивать лечение нозокомиальных катетер-ассоциированных мочевых инфекций (Saint S., 2009).
 По данным Испанского национального исследования распространенности нозокомиальных инфекций (EPINE), ежегодно проводимого с 1990 г., мочевые инфекции составляли от 26% в 1990 г. до 20% в 2011-м в группе нозокомиальных (Estudio de Prevalencia, 2012).
По данным Испанского национального исследования распространенности нозокомиальных инфекций (EPINE), ежегодно проводимого с 1990 г., мочевые инфекции составляли от 26% в 1990 г. до 20% в 2011-м в группе нозокомиальных (Estudio de Prevalencia, 2012).
По данным Европейского эпидемиологического исследования ESGNI (Bouza E., 2001), частота нозокомиальных инфекций МВП составила 3,55 эпизода на 1000 пациенто-дней, а оценочная распространенность – 10,65 на 1000 пациентов. Наиболее часто эти проблемы возникают в ОРИТ, а также урологических и неврологических отделениях. По данным исследования EPIC II (Vincent J.-L., 2009), в ОРИТ стран Восточной Европы инфекции МВП составляют 19,7% всех заболеваний. Распространенность нозокомиальных инфекций МВП в урологических отделениях составляет около 10% (Bjerklund-Johansen T.E. et al., 2007), причем доминируют среди них бессимптомная бактериурия (29%), катетер-ассоциированный цистит (26%) и пиелонефрит (21%).
По данным Российского многоцентрового исследования ЭРГИНИ (2013), инфекции МВП в структуре нозокомиальных инфекций в ЛПУ занимают второе место с частотой 16,7%. При регистрируемом количестве нозокомиальных инфекций в РФ в 2,3 млн случаев в год прогнозируемая частота нозокомиальных инфекций МВП составляет около 380 тыс. ежегодно (Yakovlev S.V., 2014; С.В. Яковлев, 2014).
Хотя нозокомиальные инфекции МВП в меньшей степени влияют на прогноз и повышение риска смерти пациента в стационаре по сравнению с другими (пневмония, перитонит), следует отметить, что от 15 до 25% эпизодов нозокомиальных мочевых инфекций сопровождаются бактериемией, что приводит к росту атрибутивной летальности от 4 до 30% (Van Nieuwkoop C., 2010; Horcajada J.P., 2013).
Согласно современным рекомендациям, нозокомиальную инфекцию МВП относят к осложненным (Grabe M., 2011). При всей условности такого деления это положение следует признать логичным, так как нозокомиальные инфекции МВП, будучи вторичными, как правило, развиваются при наличии у пациента осложняющего фактора (мочевой катетер, камни, рефлюкс и др.)
В большинстве случаев они вызываются полирезистентными возбудителями и требуют более длительных курсов антибактериальной терапии по сравнению с неосложненными инфекциями.
Нозокомиальные инфекции МВП, как и внебольничные, классифицируются в зависимости от преимущественной локализации на пиелонефрит, цистит, уретрит, простатит. При наличии мочевого катетера целесообразно выделение в отдельную группу катетер-ассоциированных инфекций (в большинстве случаев нижних отделов – цистит, уретрит, простатит) с учетом особенностей патогенеза, а также тактики лечения и профилактики. При невозможности уточнить локализацию используют термин «нозокомиальная инфекция МВП неуточненная».
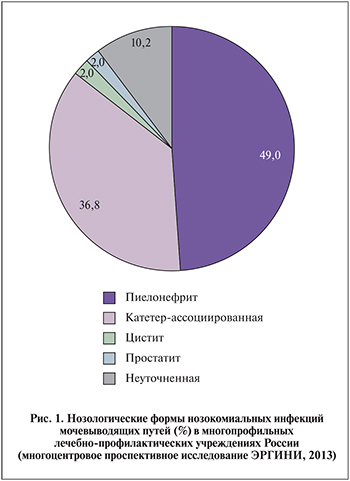
К осложненным формам нозокомиальной инфекции МВП относят гнойно-деструктивные заболевания почек (абсцесс, карбункул почки) и уросепсис (случаи с клинически значимой бактериемией, и/или синдромом полиорганной недостаточности, и/или септическим шоком). По данным российского проспективного исследования ЭРГИНИ [Яковлев С.В. и соавт. Антибиотики и химиотерапия (книга нпходится в печати)], частота развития нозомиальных инфекций МВП варьируется в различных отделениях ЛПУ (от 0% в хирургии до 7,8% в неврологии), при этом их доля среди всех нозокомиальных инфекций, зарегистрированных в данном отделении, наибольшая в отделениях урологии и неврологии (табл. 1). Нозологическая структура нозокомиальных инфекций МВП в российских скоропомощных многопрофильных ЛПУ представлена на рис. 1.
Факторы риска
Наиболее важным и стабильный фактором риска развития бактериурии и нозокомиальной инфекции МВП служат катетеризация мочевого пузыря и ее продолжительность – относительный риск (RR) составляет от 2,3 до 22,4 в зависимости от длительности нахождения катетера в мочеиспускательном канале (Platt R., 1986; Tissot E., 2001). У женщин риск нозокомиальной бактериурии выше (RR=1,7–3,7) по сравнению с мужчинами. Несоблюдение рекомендаций по постановке катетера и уходу за ним также существенно увеличивает опасность инфицирования. К другим значимым факторам риска следует отнести тяжелое состояние пациента, инсульт головного мозга, пожилой возраст, сахарный диабет, почечную недостаточность, колонизацию периуретральной области нозокомиальными штаммами микроорганизмов (Chenoweth C.E., 2014).
Частота развития бактериемии и сепсиса на фоне нозокомиальных инфекций МВП варьируется в широком диапазоне в различных исследованиях и зависит от многих предрасполагающих факторов.
В среднем частота бактериемии/сепсиса вследствие нозокомиальных инфекций МВП составляет <4% (Chang R., 2011). В одном из последних исследований частота бактериемии вследствие нозокомиальной мочевой инфекции составила 1,4 на 10 тыс. пациенто-дней (Fortin E., 2012). К факторам риска развития вторичной бактериемии и сепсиса на фоне нозокомиальной инфекции МВП относятся мужской пол, иммуносупрессия, нейтропения, заболевания почек, злокачественные опухоли. Бактериемия достоверно чаще развивается при нозокомиальной мочевой инфекции, вызванной энтерококками и грибами рода Candida (Chang R., 2011; Green M.T., 2012).
Патогенез
В большинстве случаев основной путь нозокомиального инфицирования МВП – восходящий: микроорганизмы, колонизующие промежность и периуретральную область, проникают в мочеиспускательный канал и мочевой пузырь; в ряде случаев (особенно при наличии рефлюкса) – в почки. Катетеризация мочевого пузыря, нарушение уродинамики, часто наблюдаемые у тяжелых пациентов, способствуют нарушению факторов местной защиты и проникновению микроорганизмов в мочевыводящие пути.
При нозокомиальных инфекциях МВП возможны два основных механизма инфицирования мочевых путей: эндогенный и экзогенный. При первом эндогенная кишечная микрофлора (энтеробактерии, энтерококки) попадает в мочеиспускательный канал из прямой кишки и промежности, причем инфекция может быть вызвана как нативными кишечными штаммами, обитающими в кишечнике человека с низким уровнем устойчивости к антибиотикам, так и госпитальными. Последнее возможно, если во время госпитализации произошла колонизация толстой кишки внутрибольничными штаммами и особенно если они получили селективное преимущество в результате применения антибиотиков. При экзогенном инфицировании микроорганизмы попадают в мочевые пути из внешней больничной среды через руки медперсонала, унитазы, нестерильные инструменты. В этом случае происходит колонизация мочевых путей исключительно госпитальными штаммами микроорганизмов с высоким уровнем антибиотикорезистентности. Среди последних следует выделить свободноживущие микроорганизмы (синегнойная палочки, ацинетобактерии) и кожную микрофлору (стафилококки, энтерококки), а также колонизующие больничные поверхности энтеробактерии.
При наличии мочевого катетера риск колонизации уретры и мочевого пузыря госпитальными микроорганизмами существенно возрастает. В этом случае возможно как экстралюминальное (наиболее часто), так и интралюминальное инфицирование. Колонизация внешней поверхности катетера происходит достаточно быстро из-за попадания эндогенной микрофлоры, колонизующей прямую кишку и промежность, в дистальную часть мочеиспускательного канала.
Колонизация внутренней поверхности катетера происходит в результате либо контаминации мешка или другого резервуара для сбора мочи, либо нарушения целостности дренажной системы. В этих ситуациях в мочевые пути попадает экзогенная госпитальная микрофлора.
Ведущую роль в патогенезе нозокомиальных мочевых инфекций имеют микробные биопленки, которые представляют собой скопления микроорганизмов, фрагментов и нуклеиновых кислот в мукополисахаридной среде на твердых поверхностях – катетерах, мочеприемниках, стентах. Как только происходит адгезия микроорганизмов к таким поверхностям, они начинают секретировать внеклеточное вещество (матрикс), содержащее гликокаликс. Таким образом, колония микроорганизмов становится отграниченной от внешней среды полупроницаемой мембраной и не доступной для факторов иммунокомпетентной системы макроорганизма (иммуноглобулины, нейтрофилы, макрофаги). Это объясняет возможность длительного персистирования в макроорганизме инфекций, связанных с биопленками.
Сложности эрадикации микроорганизмов в биопленках можно объяснить несколькими факторами, из которых два наиболее значимы.
- Микроорганизмы в биопленках находятся в особой биологической форме, характеризующейся низкой метаболической и внешнесекреторной активностью, при этом рост и размножение бактерий практически не отмечаются. В результате они становятся менее чувствительными к антибиотикам, которые действуют преимущественно на растущие микроорганизмы.
- Пенетрация некоторых антибиотиков (аминогликозиды, ципрофлоксацин, ванкомицин) через гликокаликс существенно затруднена, что не позволяет создавать внутри биопленки бактерицидные концентрации.
Указанные биологические свойства микробных биопленок необходимо учитывать при проведении антимикробной терапии нозокомиальных катетер-ассоциированных инфекций МВП.
Этиология и антибиотикорезистентность уропатогенов
К уропатогенным микроорганизмам, вызывающим инфекции МВП, относятся грамотрицательные бактерии семейства Enterobacteriaceae (прежде всего Escherichia coli), Pseudomonas aeruginosa; среди грамположительных бактерий следует выделить энтерококки (Enterococcus faecalis, Enterococcus faecium), коагулазонегативные стафилококки (преимущественно Staphylococcus saprophyticus); определенную этиологическую роль имеют также грибы (Candida albicans и Candida spp.). В то же время такие микроорганизмы, как Staphylococcus epidermidis, Gardnerella vaginalis, дифтероиды, коринебактерии и лактобациллы, практически не вызывают инфекций МВП, хотя также колонизуют прямую кишку, влагалище и периуретральную область. Следует подчеркнуть, что анаэробные микроорганизмы не рассматриваются как этиологически значимые при мочевых инфекциях. Также не следует расценивать в качестве нозокомиальных патогенов атипичные микроорганизмы (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma genitalium), имеющие значение в этиологии внебольничных урогенитальных инфекций.
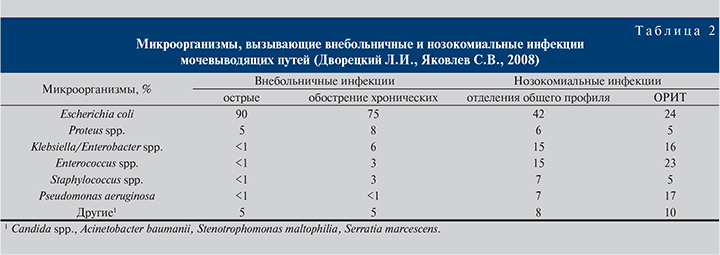
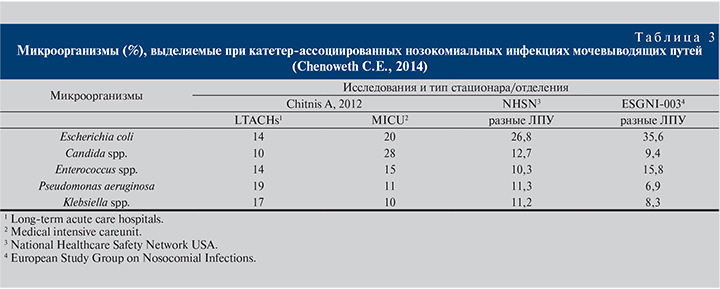
Этиологическая структура нозокомиальных инфекций МВП существенно отличается от внебольничных. При последних доминирует кишечная палочка (70–95%), отличающаяся чувствительностью к большинству антибиотиков (защищенные аминопенициллины, цефалоспорины II–III поколений, фторхинолоны, нитрофураны, аминогликозиды, фосфомицин). По нашим данным (Дворецкий Л.И., Яковлев С.В., 2008) и данным международных исследований (Bouza E., 2001), при нозокомиальных инфекциях МВП доля кишечной палочки снижается до 40–50% ( в ОРИТ – до 20–26%) за счет увеличения частоты других энтеробактерий (Klebsiella spp., Proteus spp., Enterobacter spp.), при этом также существенно возрастает значение грамположительных микроорганизмов, прежде всего энтерококков и неферментирующих грамотрицательных бактерий (P. aeruginosa и др.), что отражено в табл. 2 и 3.
Необходимо подчеркнуть значение Candida spp. в этиологии нозокомиальных мочевых инфекций, особенно для пациентов в ОРИТ и с нарушенным иммунитетом. Однако в большинстве случаев выделения этого микроорганизма, особенно при наличии мочевого катетера, клинических симптомов инфекции не наблюдается и эту ситуацию следует трактовать как бессимптомную кандидурию.
Приведенные данные отражают общие тенденции этиологической структуры нозокомиальных инфекций МВП, при этом в отдельных лечебно-профилактических учреждениях могут наблюдаться существенные отличия от приведенных среднестатистических данных, поэтому при планировании эмпирической антимикробной терапии важное значение имеют данные локального микробиологического мониторинга.
Учет этиологии возбудителей нозокомиальных инфекций МВП служит важным, но не единственным критерием, определяющим адекватные режимы эмпирической антибактериальной терапии в ЛПУ. Другим фактором, влияющим на эффективность лечения, служит знание антибиотикорезистентности наиболее частых возбудителей инфекций.
В последние годы в стационарах нашей страны, как и во всем мире, получили широкое распространение полирезистентные микроорганизмы, которые служат источником нозокомиальных инфекций в разных отделениях. Сложившаяся ситуация диктует необходимость пересмотра традиционных подходов к стартовой эмпирической антибактериальной терапии нозокомиальных инфекций МВП.
При планировании эмпирической терапии следует учитывать, что в последние 10–15 лет кишечная палочка и другие энтеробактерии, продуцирующие бета-лактамазы расширенного спектра и нечувствительные к цефалоспориновым антибиотикам, стали эндемичными в наших стационарах. По данным исследования ЭРГИНИ, 61% нозокомиальных штаммов E. coli, 95% Klebsiella spp. и 79% Proteus mirabilis характеризуются устойчивостью к цефалоспоринам III–IV поколений. При этом наблюдается высокий уровень ассоциированной устойчивости к фторхинолонам и аминогликозидам. В последние 5 лет в наших ЛПУ также стали регистрироваться энтеробактерии (прежде всего Klebsiella spp.), устойчивые к карбапенемам.
Неферментирующие грамотрицательные микроорганизмы (P. aeruginosa, Acinetobacter spp.) традиционно характеризуются полирезистентностью. Для нозокомиальных штаммов синегнойной палочки характерна высокая устойчивость (>20%) практически ко всем антисинегнойным антибиотикам, за исключением полимиксина. В последние годы, по данным исследования ЭРГИНИ, частота штаммов ацинетобактерий, устойчивых к карбапенемам, возросла в несколько раз и превысила 50%, при этом традиционно сохраняется очень высокая (>80%) устойчивость к цефалоспоринам III–IV поколений и фторхинолонам.
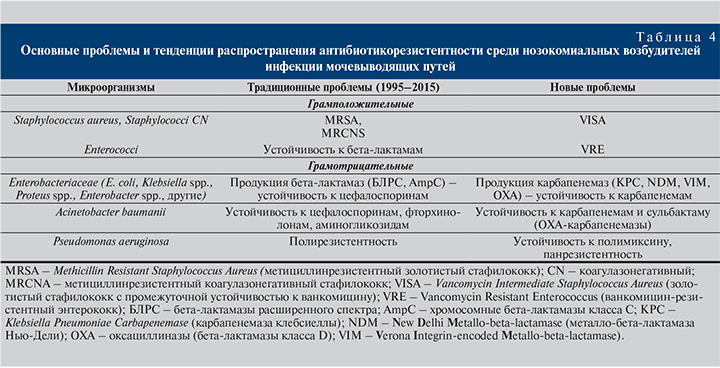
Стафилококки, устойчивые к оксациллину (MRSA, MRCNS), в течение последних 20 лет доминируют в наших ЛПУ, и их доля стабильно превышает чувствительные к оксациллину стафилококки. Положительный момент, однако, заключается в сохранении высокой чувствительности Enterococcus faecalis к ампициллину и другим бета-лактамам, нитрофуранам, фторхинолонам. Enterococcus faecium характеризуется природной устойчивостью к бета-лактамным антибиотикам, однако штаммы, устойчивые к ванкомицину, не получили широкого распространения в ЛПУ нашей страны по сравнению с Северной Америкой и Западной Европой. Основные проблемы и тенденции распространения антибиотикорезистентных нозокомиальных уропатогенов приведены в табл. 4. Более подробно механизмы антибиотикорезистентности нозокомиальных уропатогенов и возможности антибактериальной терапии приведены в разделе «Антимикробная терапия».
Клиническая картина
Клинические проявления нозокомиальной инфекции МВП достаточно разнообразны: от бессимптомной бактериурии и/или лейкоцитурии до клинически манифестной инфекции с выраженным синдромом системной воспалительной реакции, бактериемией, уросепсисом.
В отличие от внебольничных инфекций, в большинстве случаев нозокомиальные инфекции МВП протекают без отчетливой клинической симптоматики и сопровождаются только бактериурией и/или лейкоцитурией, которые исчезают после удаления мочевого катетера. Исследования показывают, что только в 10–32% случаев катетер-ассоциированной бактериурии у госпитализированных пациентов имеются клинические симптомы инфекции и лабораторные признаки системной воспалительной реакции (Chenoweth C.E., Saint S., 2011; Saint S., Chenoweth C.E., 2003).
При наличии у пациента мочевого катетера инфекцию МВП трактуют как катетер-ассоциированную. Это оправданно с позиций как понимания патогенеза развития инфекции и возможностей профилактики, так и особенностей микробиологической диагностики и тактики антибактериальной терапии. В большинстве случаев катетер-ассоциированной инфекции в процесс вовлекаются нижние отделы МВП (цистит, уретрит) с соответствующей клинической симптоматикой – тяжесть/дискомфорт внизу живота, дизурия, учащенное мочеиспускание. В небольшой доле случаев (от 1 до 7%) в процесс вовлекаются верхние отделы с симптомами, характерными для пиелонефрита, — лихорадкой с ознобами, интоксикацией, болями в пояснице, лейкоцитозом с нейтрофилезом и/или сдвигом формулы влево, увеличением С-реактивного белка (Saint S., Chenoweth C.E., 2003; Warren J.W., 1987). Однако в некоторых исследованиях приводится более высокая доля пиелонефрита в структуре нозокомиальных инфекций МВП – от 21 до 49% (Bjerklund-Johansen T.E., 2007; Яковлев С.В. и соавт., 2014). По данным исследования ЭРГИНИ (Yakovlev S.V. et al., 2014; Яковлев С.В. и соавт., 2014), доля пиелонефрита в структуре нозокомиальных инфекций МВП составила в среднем 49%, причем у пациентов с мочевым катетером в ОРИТ и отделении неврологии она была ниже (27–38%) по сравнению с пациентами в отделениях терапии и урологии (55–86%), у большинства из которых постоянного мочевого катетера не было (см. табл. 1).
Клинически крайне важно в каждом случае появления признаков инфекции МВП у госпитализированных пациентов проводить дифференциальную диагностику для исключения вовлечения в процесс верхних отделов мочевых путей, так как это существенно влияет на тактику антибактериальной терапии.
В редких случаях нозокомиальных инфекций нижних МВП в патологический процесс могут вовлекаться половые органы с развитием эпидидимита, простатита, абсцесса предстательной железы. Однако риск данных осложнений имеется в большей степени при длительно стоящих мочевых катетерах (>2 нед) и у пациентов с предшествующей патологией половых органов.
Важной особенностью нозокомиальных инфекций МВП часто служит скудность клинической симптоматики (или вообще ее отсутствие) у пациентов. Это относится прежде всего к лицам пожилого возраста, особенно с тяжелой коморбидностью (застойная сердечная недостаточность, декомпенсированный сахарный диабет, дисциркуляторная энцефалопатия), больным с инсультом головного мозга, спинальной травмой с нарушением функции тазовых органов, политравмой с переломом костей таза. Также закономерно отсутствие клинических симптомов мочевой инфекции у пациентов в ОРИТ, находящихся в сопоре/коме. У таких больных необходимо тщательно мониторировать состояние и лабораторные показатели для диагностики мочевой инфекции.
Следует помнить, что у перечисленных выше групп пациентов нозокомиальная инфекция МВП может дебютировать с атипичной симптоматикой (Дворецкий Л.И., Яковлев С.В., 2008; Poisson S.N., 2010): внезапным нарушением сознания, падением, отказом от еды, декомпенсацией функции сердца в отсутствие острой коронарной патологии, нарушением функции кишечника, снижением гемоглобина в отсутствие кровотечений. Эти симптомы могут быть единственным проявлением мочевой инфекции, поэтому необходимо проведение обследования для исключения прежде всего этой патологии. Также все случаи развития острой почечной недостаточности, не соответствующей клинической ситуации, или прогрессирования ХПН требуют обследования для исключения мочевой инфекции.
Следует помнить, что в 15–25% случаев катетер-ассоциированной бактериурии с клиническими симптомами инфекции отмечается транзиторная бактериемия, причем не только при наличии пиелонефрита (Van Nieuwkoop C., 2010; Horcajada J.P., 2013). Эти данные свидетельствуют о необходимости исследования гемокультуры при всех клинически манифестных нозокомиальных инфекциях МВП, так как они требуют особой тактики антибактериальной терапии. Примечательно, что почки и мочевыводящие пути в 11–40% случаев служат источником нозокомиальных ангиогенных инфекций (Fortin E., 2012; Lark R.I., 2000; Chang R., 2011). При бессимптомной бактериурии частота бактериемии значительно реже – от 0,4 до 3,9% (Chenoweth C.E., 2014).
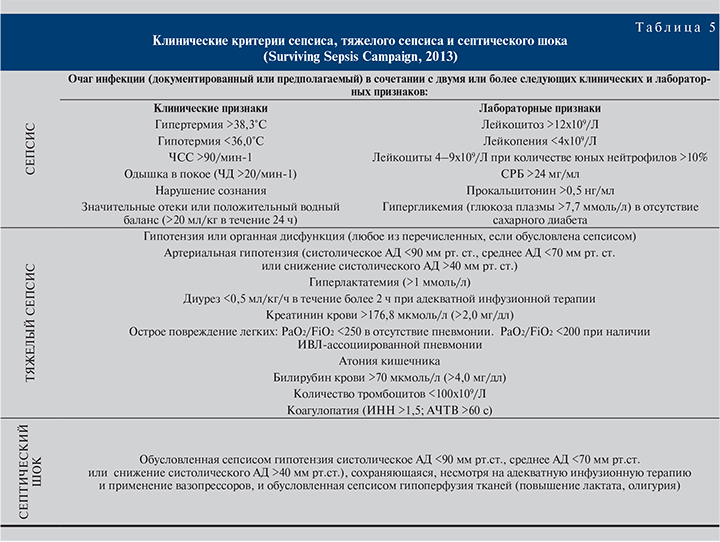
Выявление бактериемии при нозокомиальной инфекции МВП не подразумевает однозначной трактовки данной ситуации в пользу уросепсиса, хотя формально в соответствии с современными критериями (American College of Chest Physicians, 1992; De La Rosa G.D. , 2008) этот диагноз может быть применен. Более правильно обсуждать диагноз уросепсиса в соответствии с современными рекомендациями Surviving Sepsis Campaign (Dellinger P.R., 2013), особенно при наличии критерия «тяжелый сепсис» и существования признаков органной дисфункции и/или повышения уровня прокальцитонина свыше 2 нг/мл (табл. 5).
Клиническая диагностика
Общие подходы к диагностике нозокомиальных инфекций МВП принципиально не отличаются от таковых при внебольничных инфекциях. Диагноз инфекций нижних МВП (цистит, уретрит) ставится в основном на основании клинической картины: частое и болезненное мочеиспускание, позывы на мочеиспускание, дискомфорт или болезненность внизу живота; возможна макрогематурия. Системная воспалительная реакция при инфекции нижних отделов МВП нехарактерна. При возникновении системной воспалительной реакции в виде гектической лихорадки с ознобом, лейкоцитоза, увеличения С-реактивного белка и прокальцитонина необходимо прежде всего исключить пиелонефрит Диагностический минимум обследования при выявлении клинических признаков инфекции МВП у госпитализированных пациентов включает общий анализ мочи с микроскопией осадка, общий анализ крови с исследованием лейкоцитарной формулы, исследование в крови мочевины, креатинина, С-реактивного белка, микробиологическое исследование мочи и крови, УЗИ почек.
Клиницистам следует помнить, что в ряде случаев у определенных категорий пациентов (пожилые, пациенты в ОРИТ с нарушенным сознанием, больные с инсультом, спинальной травмой, тяжелой коморбидной патологией) нозокомиальные инфекции МВП, включая пиелонефрит и даже случаи, осложненные бактериемией, могут протекать со скудной клинической симптоматикой, иногда бессимптомно или проявляться симптомами поражения других органов (см. раздел «Клиническая картина»). Во всех случаях неясной лихорадки, нарушения сознания, падений, отказа от пищи, кишечной непроходимости, повышения креатинина в крови, а также ухудшения течения основного заболевания у госпитализированных пациентов необходимо проведение тщательного обследования, в первую очередь для исключения инфекции МВП. У пациентов с поражением спинного мозга появление таких симптомов, как мышечная спастичность, автономная дисрефлексия, тревожность, позволяют заподозрить инфекцию МВП.
При проведении эпидемиологических и клинических исследований в качестве критериев диагностики нозокомиальных инфекций МВП в настоящее время принято использовать критерии Центра по контролю заболеваемости США (CDC) 2008 г. (Horan T.C., 2008). Согласно CDC, следует выделять инфекцию МВП и бессимптомную бактериурию.
Критерии CDC нозокомиальной инфекции МВП. Наличие как минимум одного из следующих критериев.
- У пациента имеется по крайней мере один признак или симптом, который не может быть объяснен другой причиной: лихорадка выше 38°С, учащенное мочеиспускание, позывы на мочеиспускание, дизурия или боли в надлобковой области. Выявлен рост не более двух клинически значимых микроорганизмов в количестве ≥105 КОЕ/мл.
- У пациента имеются по крайней мере два признака или симптома, которые не могут быть объяснены другими причинами: лихорадка выше 38°С, учащенное мочеиспускание, позывы на мочеиспускание, дизурия или боли в надлобковой области. Кроме того, имеется один признак из следующих:
- при исследовании мочи с помощью диагностических полосок (Dipsticks) положительная реакция на лейкоциты и нитриты;
- пиурия;
- выявлены микроорганизмы при окраске по Граму нецентрифугированной мочи;
- в двух последовательных пробах мочи выявлен рост одного и того же клинически значимого микроорганизма (грамотрицательные бактерии или Staphylococcus saprophyticus) в количестве ≥102КОЕ/мл; выявлен рост одного уропатогена (грамотрицательные бактерии или Staphylococcus saprophyticus) в количестве ≤105 КОЕ/мл у пациента, получающего потенциально эффективный антибиотик направленного действия;
- врачебный диагноз инфекции МВП;
- врач назначил надлежащую терапию по поводу инфекции МВП.
Критерии CDC бессимптомной бактериурии. Имеется как минимум один из следующих критериев:
- У пациента имеется уретральный катетер, установленный в течение 7 дней перед посевом мочи. Выявлен рост не более двух микроорганизмов в количестве ≥105 КОЕ/мл, и у пациента отсутствуют симптомы инфекции – лихорадка выше 38°С, учащенное мочеиспускание, позывы на мочеиспускание, дизурия или боли в надлобковой области.
- У пациента не было уретрального катетера, установленного в течение 7 дней перед посевом мочи. Получено два положительных посева мочи с выделением одного и того же микроорганизма в количестве ≥105 КОЕ/мл, при этом в каждой пробе было не более двух микроорганизмов. У пациента отсутствуют симптомы инфекции – лихорадка выше 38°С, учащенное мочеиспускание, позывы к мочеиспусканию, дизурия или боли в надлобковой области.
Следует отметить определенную условность данных критериев. Критерии CDC позволяют диагностировать только клинически манифестную нозокомиальную инфекцию МВП. В случаях с малосимптомной или атипичной клинической картиной нозокомиальных мочевых инфекций, которые обсуждались выше, использование перечисленных критериев может приводить к гиподиагностике инфекций.
Микробиологическая диагностика
Микробиологическая диагностика нозокомиальных инфекций МВП предполагает обнаружение в клиническом материале (моча, кровь) возбудителей инфекционного процесса. К настоящему времени сложились достаточно четкие представления о патогенности отдельных видов микроорганизмов и этиологической структуре инфекций МВП (Сидоренко С.В., Яковлев С.В., 2003). Это позволяет избегать излишних материальных и временных затрат на выделение и изучение всех возможных микроорганизмов. Соответственно, для проведения эффективной диагностики и целенаправленного поиска микроорганизма-возбудителя врач-бактериолог должен получить точную информацию о клиническом диагнозе и источнике получения материала для исследования. При этом результат исследования полностью зависит от правильности взятия материала, его транспортировки и хранения.
Исследование мочи. Частое использования в стационаре мочевых катетеров существенно затрудняет диагностику инфекций МВП и интерпретацию полученных микробиологических данных. Необходимо помнить, что мочевые катетеры даже при соблюдении максимальных мер асептики и антисептики практически неизбежно колонизуются госпитальной микрофлорой. В одних случаях инфицирование при этом может не сопровождаться клинической симптоматикой (бессимптомная бактериурия), в других колонизованный катетер может быть источником инфекции нижних или верхних отделов МВП, а также уросепсиса.
Следует придерживаться того правила, что при заборе мочи для бактериологического исследования у пациента с мочевым катетером необходимо заново катетеризировать мочевой пузырь с использованием нового стерильного катетера.
При невозможности осуществления такого подхода мочу для анализа отбирают путем пункции катетера с соблюдением всех требований асептики. Недопустим отбор мочи для анализа из резервуаров для сбора мочи.
В сложных для интерпретации и диагностики случаях для получения мочи, гарантированно не контаминированной микрофлорой дистальных отделов МВП, необходимо проводить надлобковую пункцию мочевого пузыря.
Условия хранения и транспортировки мочи от момента ее получения и до начала исследования (проведения первичного посева) должны, с одной стороны, обеспечить сохранение жизнеспособности всех находящихся в биоматериале бактерий, с другой – предотвратить их размножение.
В подавляющем большинстве случаев при хранении и транспортировке в течение 2 ч при комнатной температуре качественный и количественный состав бактерий в моче не меняется. Вполне очевидно, что выдерживать указанный срок возможно только при наличии в ЛПУ микробиологической лаборатории. Для хранения и транспортировки мочи в пределах лечебного учреждения необходимо использовать стерильные контейнеры, исключающие контаминацию как образца, так и окружающей среды. При задержке транспортировки в бактериологическую лабораторию собранной мочи на несколько часов (например, если материал был взят в ночные часы до начала антибактериальной терапии) образец в стерильном контейнере должен быть помещен в холодильник при температуре от +2 до +6°С.
При невозможности выдерживать двухчасовой интервал хранения и транспортировки (например, при отправке в бактериологическую лабораторию другого учреждения) необходимо использовать транспортные среды. Коммерческие транспортные среды позволяют сохранять количественный и качественный состав микрофлоры в моче в течение 24 ч, а в ряде случаев и 48 ч (см. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России, 2012).
Оценка клинической значимости микроорганизмов, выделенных из мочи, часто представляет собой сложную проблему. Основным ориентиром при этом должны быть количественные данные о степени обсемененности мочи. Традиционным критерием значимости считается концентрация микроорганизмов в моче 105 КОЕ/мл и выше. Тем не менее в ряде случаев и существенно меньшие концентрации (103–104 КОЕ/мл) следует рассматривать как значимые при выделении типичного уропатогена и наличии симптомов инфекции МВП (Сидоренко С.В., Яковлев С.В., 2003). Однако в отсутствие симптомов инфекции и забора мочи из уретрального катетера в качестве диагностически значимого количества микроорганизмов следует считать величину 105 КОЕ/ил и выше.
Концентрации микроорганизмов в моче менее 103 КОЕ/мл следует признавать как не имеющие диагностического значения. Выделение из одной пробы мочи более трех микроорганизмов надо трактовать как контаминацию.
Вторым важным моментом в интерпретации результатов бактериологического исследования мочи служит оценка клинической значимости выделенного микроорганизма, особенно в ситуациях, когда выделяется более одного вида.
Следующие микроорганизмы, выделенные из мочи, следует расценивать как вероятные возбудители нозокомиальных инфекций МВП:
- Enterobacteriaceae (E. coli, Klebsiella spp., Proteus spp., Enterobacter spp., Citrobacter spp., Morganella morganii, Serratia marcescens, Providencia spp.);
- Pseudomonas aeruginosa и другие неферментирующие грамотрицательные бактерии (Acinetobacter spp., Stenotrophomonas maltophilia);
- Enterococcus faecalis или Enterococcus faecium;
- Staphylococcus saprophyticus.
Следующие микроорганизмы не относятся к типичным уропатогенам, но могут рассматриваться как потенциальные возбудители нозокомиальных мочевых инфекций при наличии мочевого катетера и отсутствии другой альтернативы:
- Staphylococcus aureus;
- другие коагулазонегативные стафилококки;
- Pseudomonas spp.
Выделение таких микроорганизмов, как Enterococcus spp. (кроме E. faecalis и E. faecium), Streptococcus spp., Bacillus spp., Corynebacterium spp., Burkholderia cepacia, следует трактовать как контаминацию, не имеющую клинического значения при уроинфекциях.
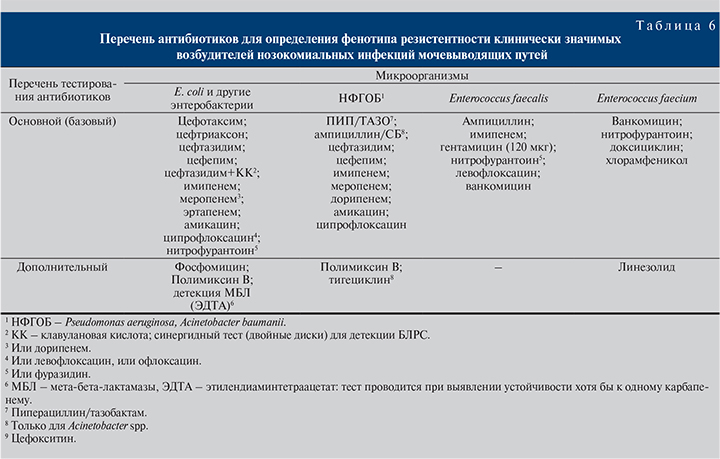
Важным этапом микробиологической диагностики нозокомиальных инфекций МВП служит определение чувствительности выделенных уропатогенов к антибактериальным препаратам. Не вдаваясь в детали технического проведения исследования, остановимся на клинических вопросах перечня тестируемых антибиотиков для полноценного описания фенотипа резистентности возбудителя нозокомиальной мочевой инфекции. Это необходимо для правильного определения возможных механизмов антибиотикорезистентности, адекватного назначения антибактериальной терапии.
Перечень тестируемых антибиотиков определяется несколькими факторами:
- списком применяемых в ЛПУ антибиотиков (формуляр);
- локальной ситуацией с уровнем антибиотикорезистентности уропатогенов и доминирующими механизмами их устойчивости;
- локальными рекомендациями по терапии нозокомиальных мочевых инфекций.
Такой подход служит конкретным примером интеграции лечения пациентов с нозокомиальными инфекциями МВП. Препараты антибиотиков, входящих в перечень тестирования чувствительности, следует определять коллегиально с участием врача-бактериолога, клинического фармаколога, уролога и заведующего ОРИТ и согласовывать с заведующим аптекой ЛПУ.
Оптимальный перечень тестируемых антибиотиков для определения чувствительности выделенных нозокомиальных уропатогенов приведен в табл. 6.
Исследование крови. В современных условиях использование питательных сред лабораторного приготовления для выделения гемокультуры следует признавать неадекватным. Коммерческие питательные среды с визуальной регистрацией бактериального роста обеспечивают более высокую диагностическую чувствительность по сравнению со средами лабораторного приготовления, однако стандартом диагностики бактериемии должно быть использование анализаторов с автоматической регистрацией роста бактерий и соответствующих коммерческих питательных сред (флаконов), несмотря на их значительную стоимость (см. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России, 2012). Флаконы комплектуются системами для заполнения кровью непосредственно из вены при венепункции, что минимизирует риск контаминации.
Наиболее сложная проблема при диагностике бактериемий заключается в дифференцировке истинных и ложноположительных результатов, связанных с контаминацией питательных сред микрофлорой кожных покровов в процессе венепункции. Вероятность контаминации питательных сред существенно снижается при выделении для забора крови специально обученного персонала и жестком соблюдении правил обработки кожных покровов. Использование для местной дезинфекции кожи растворов этилового спирта недостаточно эффективно (!).
При использовании препаратов повидон-йода необходима экспозиция до 2 мин, при использовании настойки йода необходимое время экспозиции снижается до 30 с. Оптимальный и быстрый эффекты обеспечивает обработка кожи 0,5%-ным спиртовым раствором хлоргексина (Сидоренко С.В., Яковлев С.В., 2003).
Наибольшую чувствительность и специфичность при диагностике бактериемии удается получить при посеве венозной крови в два набора флаконов. Обычно рекомендуется проводить венепункцию двух вен с интервалом не более 30 мин. Выделение одного и того же возбудителя из двух флаконов свидетельствует о его клинической значимости. Выделение возбудителя из флаконов, заполненных только из одной вены, свидетельствует о контаминации.
Приводимые в некоторых публикациях рекомендации по получению крови для выделения гемокультуры на высоте лихорадки или из артерии необоснованы (см. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России, 2012). Кровь для выделения гемокультуры следует брать до начала антибактериальной терапии (!).
Введение даже одной дозы антибиотика существенно снижает вероятность получения положительного результата.
Если пациент получает антибиотики, следует стремиться отбирать кровь через максимальный промежуток времени после введения антибиотика, оптимально – утром непосредственно перед введением очередной дозы (ночной интервал между введениями обычно самый большой).
После заполнения флакона кровью его необходимо как можно быстрее поместить в прибор для инкубации и детекции бактериального роста. При задержке начала исследования в несколько часов (при заборе крови в ночные часы) флакон с гемокультурой следует хранить при комнатной температуре (не в холодильнике!).
Лечение
Проведение рациональной антибактериальной терапии невозможно без современных знаний об этиологии инфекционных заболеваний и антибиотикорезистентности их возбудителей. На практике это означает необходимость выявления микробиологическими методами этиологического агента инфекции и оценки его антибиотикочувствительности. Только после этого можно обсуждать выбор оптимального антибактериального препарата.
Однако в практической медицине ситуация не так проста и даже самые современные микробиологические методики часто не в состоянии дать клиницисту быстрый ответ или даже вообще уточнить возбудителя заболевания. В этом случае на помощь приходят знания о наиболее вероятных этиологических агентах конкретных нозологических форм, спектре природной активности антибиотиков и уровне приобретенной резистентности к ним в данном регионе и конкретном стационаре. Последнее представляется наиболее важным при планировании антибактериальной терапии в стационаре, где отмечается наиболее высокий уровень приобретенной резистентности, а недостаточная оснащенность микробиологических лабораторий и низкий уровень стандартизации исследований по оценке антибиотикочувствительности не позволяют сформировать реальное представление об эпидемиологической ситуации в медицинском учреждении и разработать взвешенные рекомендации по лечению.
При планировании антибиотикотерапии следует учитывать возросший уровень резистентности возбудителей нозокомиальных инфекций. В обязательном порядке следует учитывать основные тенденции резистентности наиболее важных возбудителей нозокомиальных инфекций при выборе антибиотика для конкретного больного, а также при разработке программ эмпирической антибактериальной терапии в стационаре.
Показанием к назначению антибиотика служит документированная или предполагаемая бактериальная инфекция МВП. Наличие отдельных симптомов системной воспалительной реакции (лихорадка, лейкоцитоз, нейтрофилез, увеличение СОЭ, С-реактивного белка) не всегда свидетельствует о бактериальном воспалении и не во всех случаях требует обязательного назначения антимикробного препарата. Точно так же как и выделение условно-патогенных микроорганизмов из мочи при наличии мочевого катетера, не всегда говорит об инфекционном процессе и требует оценки их клинической значимости. При решении вопроса о целесообразности назначения антимикробного препарата необходимо эту концепцию сформулировать в истории болезни с указанием причины назначения антибиотика, обоснования выбора режима антибактериальной терапии (препарат, доза, кратность) и планируемой длительности лечения (см. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России, 2012).
Выделение бактерий из мочи без клинических признаков инфекции (бессимптомная бактериурия) в большинстве случаев не требует назначения антибиотиков, так же как и бессимптомная пиурия. Профилактическое назначение антибиотиков не показано как при установке катетера, так и при его замене.
Длительная катетеризация мочевого пузыря также не обосновывает профилактического назначения антибиотиков. Не показано местное введение антибиотиков или антисептиков (в уретру, катетер или мочевой пузырь) с целью профилактики или лечения катетер-ассоциированной мочевой инфекции, поскольку эффективность данной методики не доказана, а риск формирования устойчивых микроорганизмов высок (Tenke P., 2008; Hooton T.M., 2010; Grabe M., 2012).
Профилактическое назначение антибиотиков при нозокомиальной бессимптомной бактериурии (в том числе катетер-ассоциированной) показано для:
- беременных (7 дней);
- пациентов, которым предстоит операция на органах мочеполовой системы (2–3 дня).
В указанных ситуациях возможно назначение с профилактической целью пероральных антибиотиков – нутрофуранов (нитрофурантоин, фуразидин), цефалоспоринов II–III поколений (цефиксим, цефтибутен, цефуроксим аксетил) или несистемных фторхинолонов (норфлоксацин, ломефлоксацин), однако последние противопоказаны беременным.
Риск развития инвазивного кандидоза на фоне антибактериальной терапии нозокомиальных инфекций МВП у пациентов без специфических факторов риска (нейтропения на фоне применения цитостатиков, трансплантация кроветворных стволовых клеток или солидных органов) невысок, поэтому рутинная первичная антифунгальная профилактика не рекомендуется. Выделение Candida spp. из мочи у пациента без факторов риска инвазивного кандидоза1 не служит обоснованием назначения антифунгального препарата (см. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России, 2012).
Эмпирическая терапия. Для достижения адекватности антибактериальной терапии рекомендуется разработка в ЛПУ рекомендаций по эмпирическому выбору антимикробных препаратов при нозокомиальных инфекциях МВП.
Под адекватной антибактериальной терапией конкретного пациента следует понимать, что:
- выбранный режим антимикробной терапии охватывает всех потенциальных возбудителей инфекции МВП (энтеробактерии+энтерококки+стафилококки, а в особых ситуациях, таких как длительная катетеризация мочевого пузыря, продолжительное нахождение в ОРИТ, также и синегнойная палочка);
- при выборе антибактериального препарата учтен риск полирезистентных возбудителей;
- антибиотик назначен в адекватной дозе с учетом вероятного возбудителя и локализации инфекции (цистит, пиелонефрит, простатит).
Назначение адекватной эмпирической терапии с наибольшей вероятностью должно обеспечить достижение клинического эффекта. Следует отметить, что все рекомендации по планированию эмпирической антибактериальной терапии нозокомиальных инфекций МВП будут в достаточной степени условными, так как этиологическая структура возбудителей нозокомиальных инфекций и уровень их устойчивости к антибиотикам могут существенно различаться в разных стационарах и даже в лечебных отделениях одного стационара.
При сравнительном анализе данных, полученных в разных регионах мира (Россия, США, Европа, Азия), наряду со сходными тенденциями по увеличению и распространению антибиотикорезистентных возбудителей нозокомиальных мочевых инфекций можно найти существенные межрегиональные различия (Яковлев С.В., 2014; Ahmed N.H., 2014; Hidron A.I., 2008; Ghadiri H., 2012). Эти различия существенно влияют на рекомендации по эмпирической терапии. Поэтому адекватно планировать лечение больных нозокомиальными инфекциями МВП можно, только исходя из локальных микробиологических данных о превалирующих возбудителях и их антибиотикорезистентности в конкретном ЛПУ. Причем такие рекомендации необходимо регулярно пересматривать (каждые 6–12 мес).
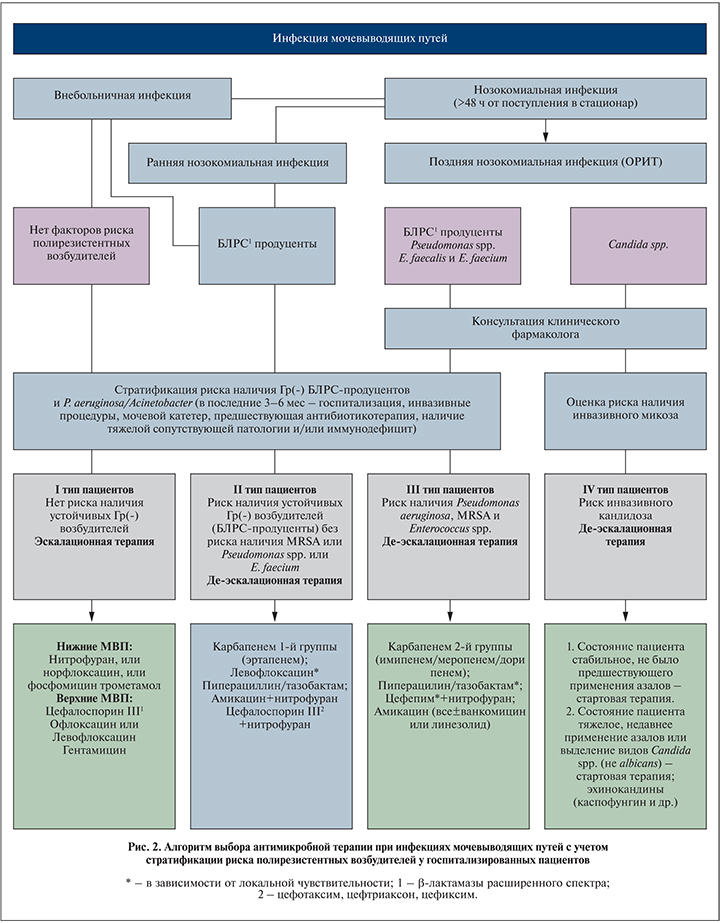
В то же время общие принципы по эмпирической антибактериальной терапии довольно подробно изложены в Российских национальных рекомендациях (см. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России, 2012). Примерный алгоритм эмпирического выбора антибиотика при инфекции МВП с учетом стратификации пациентов по риску антибиотикорезистентных возбудителей приведен на рис. 2.
Целенаправленная (этиотропная) терапия. Кажущаяся простота выбора антибиотика для лечения пациентов с инфекциями МВП при наличии результата бактериологического исследования с антибиотикограммой не исключает ряда проблем, приводящих к неправильной трактовке полученных результатов и ошибкам в назначении антибактериальной терапии.
Во-первых, критерии чувствительности микроорганизмов к антибиотикам в настоящее время постоянно пересматриваются и уточняются и можно найти существенные различия в оценке чувствительности/резистентности даже в рекомендациях двух наиболее авторитетных организаций по лабораторным микробиологическим стандартам – Американской CLSI и Европейской EUCAST.
Во-вторых, отечественные микробиологические лаборатории в настоящее время работают по методическим рекомендациям 2004 г. (МУК 4.2.1890–04), в основу которых положены микробиологические критерии чувствительности CLSI 2003 г., которые давно морально устарели и не позволяют правильно трактовать устойчивость многих микроорганизмов и, соответственно, не позволяют прогнозировать эффективность антимикробной терапии. В настоящее время в США используются лабораторные стандарты CLSI 2012 г., а в Европе – более прогрессивные стандарты EUCAST 2013 г. В-третьих, даже современные микробиологические критерии чувствительности не позволяют правильно выявлять все механизмы устойчивости, в частности карбапенемазы. И наконец, с помощью наиболее широко используемого бактериологическими лабораториями метода определения чувствительности микроорганизмов к антибиотикам – диско-диффузионного – не всегда можно получать правильный результат. Например, правильная оценка чувствительности стафилококков к ванкомицину возможна только с помощью количественного определения МПК (Е-тест), а оценка зон задержки роста при диско-диффузионном методе не позволяет выявлять штаммы со сниженной чувствительностью к ванкомицину.
Учитывая приведенные выше аргументы, клиницистам необходимо понимать в общих чертах основные механизмы устойчивости микроорганизмов к антибиотикам, уметь правильно интерпретировать антибиотикограмму и выбирать наиболее адекватный антибиотик в каждой конкретной ситуации.
В этой ситуации очень важна интеграция врачей разных специальностей. В частности, в сложных клинических ситуациях, случаях инфекций, вызванных поли- и панрезистентными бактериями, урологам и другим клиницистам целесообразно обсуждать проблему с врачами – клиническими фармакологами и микробиологами.
Энтеробактерии. В этиологической структуре нозокомиальных инфекций МВП ведущая роль принадлежит грамотрицательным микроорганизмам. Именно при этих инфекциях наблюдаются наибольшие сложности в выборе адекватного режима антибиотикотерапии, что обусловлено множественными и сложными механизмами резистентности возбудителей и формированием полирезистентности в процессе проведения антибиотикотерапии. Проблема осложняется тем, что в рутинной лабораторной практике часто не удается выявлять резистентность in vitro, а также приводить в соответствие исследования чувствительности in vitro и клинический эффект терапии.
В современной клинической практике наибольшие проблемы, связанные с антибиотикорезистентностью, вызывают грамотрицательные микроорганизмы семейства энтеробактерий и неферментирующих бактерий. Полирезистентность именно этих возбудителей в большинстве случаев лежит в основе неадекватной эмпирической терапии в ОРИТ.
В исследовании АСЭТ, проведенном в 15 городах РФ, было показано, что в 44% случаев причиной неадекватной стартовой эмпирической терапии нозокомиальных инфекций в ОРИТ были энтеробактерии, устойчивые к цефалоспоринам III поколения, в 21 и 18% – полирезистентные P. aeruginosa и A. baumanii (Яковлев С.В. , 2006).
Представители семейства Enterobacteriaceae играют важнейшую роль при нозокомиальных инфекциях МВП (70–85% случаев инфекций). В это семейство входит несколько сотен видов микроорганизмов, но при инфекциях МВП наибольшее значение имеют около 10, среди которых следует выделить E. coli, Klebsiella spp., Proteus spp., Enterobacter spp. У энтеробактерий имеется ряд факторов вирулентности, способствующих адгезии к клеткам эпителия мочевого пузыря и других отделов МВП, повреждающих эукариотические клетки и индуцирующих синтез провоспалительных цитокинов.
Антибиотиками выбора для лечения пациентов с урогенитальными инфекциями, вызванными энтеробактериями, служат бета-лактамные антибиотики. Однако в последние годы эффективность этих препаратов была серьезно скомпрометирована из-за широкого распространения устойчивых к ним штаммов энтеробактерий. Устойчивость энтеробактерий к бета-лактамам опосредуется четырьмя основными механизмами (ферментативная инактивация, изменение мишени для антибиотика – пенициллинсвязывающих белков, утрата пориновых каналов в микробной стенке с нарушением проникновения антибиотика в клетку, активация эффлюксных помп в микробной клетке).
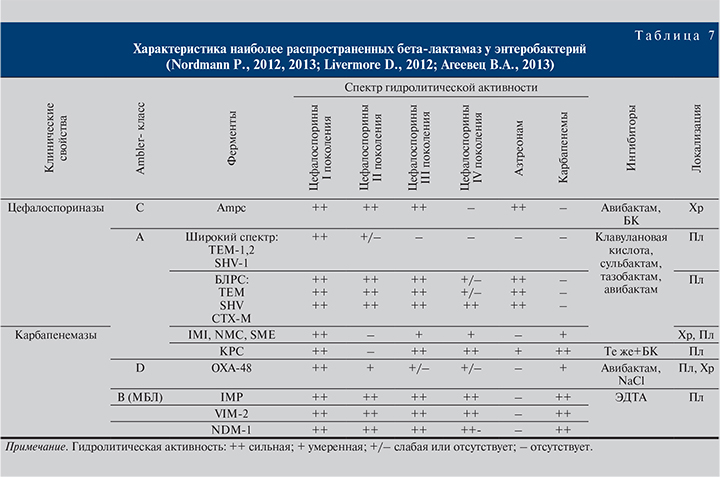
Наибольшее клиническое значение среди этих факторов имеет ферментативный гидролиз бета-лактамного кольца бета-лактамазами. При всем многообразии различных бета-лактамаз необходимо выделить несколько групп, имеющих наибольшее практическое значение. Клинически важно выделять бета-лактамазы, содержащие в активном центре молекулы атома цинка (металло-бета-лактамазы), и сериновые бета-лактамазы, локализацию генов, кодирующих синтез бета-лактамаз (хромосомная или плазмидная), спектр гидролитической активности ферментов и чувствительность их к ингибиторам бета-лактамаз (табл. 7).
Наиболее широкое распространение в стационарах нашей страны получили энтеробактерии, продуцирующие бета-лактамазы расширенного спектра (БЛРС). БЛРС локализуются на плазмидах и гидролизуют большинство бета-лактамных антибиотиков – пенициллины, цефалоспорины всех поколений и азтреонам. Кроме того, микроорганизмы, продуцирующие БЛРС, часто устойчивы к другим классам антибиотиков, включая аминогликозиды и фторхинолоны. Таким образом, энтеробактерии, продуцирующие БЛРС, можно определенно отнести к полирезистентным бактериям. Благодаря плазмидной локализации генов распространение БЛРС среди возбудителей инфекционных болезней человека, и прежде всего возбудителей нозокомиальных инфекций, приняло угрожающий характер.
Продуцентами БЛРС могут быть различные энтеробактерии, но наиболее часто они определяются у Klebsiella spp., Escherichia coli, Proteus mirabilis. Плазмидная локализация позволяет легко передавать эти ферменты другим энтеробактериям, что объясняет госпитальные вспышки инфекций, вызванных БЛРС-продуцирующими бактериями. Штаммы энтеробактерий, продуцирующие БЛРС, наиболее распространены в отделениях интенсивной терапии, неонатальной реанимации, термической травмы, трансплантации, а в последние годы все чаще выявляются и в других отделениях.
Практические сложности связаны с тем, что стандартные методы оценки антибиотикочувствительности часто не выявляют этот механизм резистентности. Поэтому при выделении энтеробактерий (прежде всего Klebsiella spp. или E. coli), устойчивых in vitro к одному из тестируемых цефалоспоринов III поколения, предполагается резистентность ко всем другим цефалоспоринам, включая цефепим. Сниженная чувствительность in vitro хотя бы к одному из тестируемых цефалоспоринов III поколения служит косвенным признаком продукции БЛРС.
Дополнительным аргументом в пользу продукции БЛРС служит увеличение диаметра зоны подавления роста микроорганизмов в агаре ≥5 мм при добавлении к диску с цефтазидимом диска, содержащего клавулановую кислоту. Однако практически важно, что присутствие у Klebsiella spp. хромосомных AmpC бета-лактамаз маскирует наличие БЛРС, так как первые не чувствительны к ингибиторам и подтверждающий фенотипический метод дает ложноотрицательный результат.
Механизм устойчивости госпитальных штаммов энтеробактерий, связанный с продукцией БЛРС, имеет большое клиническое значение. В многочисленных исследованиях показано, что летальность достоверно выше при инфекциях, вызванных БЛРС-продуцирующими бактериями.
Следует учитывать, что устойчивость штаммов Klebsiella spp. или E. coli – продуцентов БЛРС к цефалоспоринам III поколения часто ассоциируется с резистентностью к фторхинолонам и гентамицину, иногда – к амикацину. Активность in vitro и клиническую эффективность в отношении этих микроорганизмов могут сохранять ингибитор-защищенные бета-лактамы (пиперациллин/тазобактам, цефоперазон/сульбактам), однако наиболее надежным компонентом антибактериальной терапии служат карбапенемы, при назначении которых наблюдается наименьший риск летального исхода. Клинически значимых различий между карбапенемами в отношении БЛРС не выявлено, хотя более высокую активность in vitro проявляют меропенем и дорипенем. Другие ингибитор-защищенные бета-лактамы (ампициллин+сульбактам, амоксициллин+клавулановая кислота, амоксициллин+сульбактам) не рассматриваются как адекватные и надежные средства для лечения пациентов с нозокомиальными инфекциями МВП, вызванными продуцентами БЛРС, даже при чувствительности к этим препаратам in vitro.
Следует отметить, что при лечении инфекций, вызванных БЛРС-продуцирующими энтеробактериями, не следует назначать цефалоспорины IV поколения (цефепим, цефпиром), даже при чувствительности к ним возбудителей in vitro.
Эта рекомендация вызвана наличием инокулюм-эффекта, который ослабляет активность антибиотика в отношении доминирующей в РФ БЛРС типа CTX-M. Наиболее надежными антибиотиками в этих ситуациях служат карбапенемы, в качестве альтернативы возможно применение пиперациллина+тазобактама. В то же время широкое использование карбапенемов в качестве средств стартовой эмпирической терапии опасно в плане селекции штаммов энтеробактерий, продуцирующих карбапенемазы, что ранее считалось казуистикой, однако такие штаммы получили в последние годы распространение в России.
К сожалению, самый активный в отношении БЛРС ингибитор-защищенный бета-лактам – цефоперазон+сульбактам – не может быть рекомендован при инфекциях МВП, так как имеет внепочечный путь элиминации и не создает в моче терапевтических концентраций. По той же причине не может быть рекомендован при мочевых инфекциях высокоактивный в отношении БЛРС тигециклин. Из других альтернатив лечения нозокомиальных инфекций, вызванных БЛРС-продуцентами, можно рассматривать фосфомицин для парентерального применения. В отношении БЛРС-продуцирующей E. coli высокую активность проявляют нитрофураны, однако их область применения ограничена только инфекциями нижних отделов МВП; в отношении Klebsiella spp. и Proteus mirabilis активность нитрофуранов существенно хуже. При катетер-ассоциированных нозокомиальных инфекциях МВП, вызванных полирезистентной кишечной палочкой, устойчивой к цефалоспоринам и фторхинолонам, назначение нитрофуранов выглядит логичным и обоснованным (Яковлев С.В., 2014).
В настоящее время выросла значимость проблемы резистентности энтеробактерий к карбапенемам. Устойчивые к карбапенемам энтеробактерии, такие как K. pneumoniae, Enterobacter spp., выявлялись еще с середины 1990-х гг., однако они не получили широкого распространения. В начале XXI в. в стационарах Нью-Йорка и других городов Восточного побережья США стали выявляться штаммы K. pneumoniae, продуцирующие бета-лактамазы класса А, способные гидролизовать карбапенемы (KPC бета-лактамазы). В последующем эти карбапенемазы распространились в другие регионы мира и в некоторых странах стали доминирующими (Греция, Турция) (Walsh T.R., 2010).
В 2008 г. у K. pneumoniae и E. coli, выделенных в Индии и Пакистане, выявили новые бета-лактамазы (NDM-1), относящиеся к классу В и проявляющие устойчивость к карбапенемам. Их называют металло-бета-лактамазы, так как активный центр фермента имеет атом Zn++, в отличие от других бета-лактамаз содержащих серин. Очень быстро эти бета-лактамазы распространились на территории Великобритании и сейчас также выявляются в других европейских странах (Kumarasamy K.K., 2010).
С практических позиций очень важно при выявлении устойчивости энтеробактерий к карбапенемам дифференцировать карбапенемазы данных двух групп, так как это определяет тактику антибактериальной терапии. Следует отметить, что энтеробактерии, продуцирующие карбапенемазы, обычно проявляют устойчивость к большинству антибиотиков и это создает серьезные проблемы в назначении адекватной терапии (Livermore D.M., 2011). Среди продуцентов карбапенемаз возможна вариабельная чувствительность к тигециклину, полимиксину В, азтреонаму, фосфомицину и цефепиму. Бактериологическим лабораториям следует учитывать распространение карбапенемаз среди энтеробактерий и быть готовыми к их детекции (Tsakris A., 2010).
Карбапенемазы группы D (в основном OXA-48) проявляют невысокий уровень устойчивости к карбапенемам – значения минимальной подавляющей концентрации (МПК) обычные или в диапазоне чувствительности (2–4 мкг/мл) либо немного повышены (8–16 мкг/мл), тогда как «дикие» штаммы, как правило, характеризуются значительно более низкими МПК (0,01–0,5 мкг/мл). Это практически важно, так как назначение карбапенемов в больших дозах (4–6 г/сут) позволяет достигать эрадикации энтеробактерий с повышенными МПК (4–8 мкг/мл).
Более того, эрадикация штаммов с более высокими МПК (16–32 мкг/мл) может быть достигнута при применении максимальных доз карбапенемов с оптимизацией их введения в виде продленных 3-часовых инфузий, что было показано при фармакодинамическом моделировании и клинических исследованиях (Filho L.S., 2007). В настоящее время продленные инфузии официально разрешены для двух карбапенемов – меропенема (3-часовая инфузия) и дорипенема (4-часовая инфузия).
Кроме того, важно, что OXA-карбапенемазы, как и карбапенемазы класса А (KPC), чувствительны к ингибиторам бета-лактамаз, т.е. добавление ингибитора бета-лактамаз к карбапенему сопровождается снижением МПК, что также повышает вероятность достижения клинического эффекта (Yigit H., 2003). Поэтому при выявлении устойчивости энтеробактерий к карбапенемам может быть рекомендован комбинированный режим терапии – карбапенем и ингибитор-защищенный бета-лактам, например меропенем 4–6 г/сут+пиперациллин [тазобактам] в дозе 13,5–18 г/сут или ампициллин [сульбактам] в дозе 12 г/сут. Также возможно назначение тигециклина, к которому обычно сохраняют чувствительность энтеробактерии, однако он характеризуется не очень хорошей пенетрацией в мочу и поэтому вряд ли может быть использован в режиме монотерапии.
В случае инфекций, вызванных продуцентами металло-бета-лактамаз, эффективность карбапенемов сомнительна (МПК повышаются значительно), кроме того, в отношении этих бета-лактамаз неактивны ингибиторы. Режимы лечения при таких инфекциях не отработаны. Обсуждаются комбинации полимиксина В, тигециклина, фосфомицина, азтреонама, однако необходимы клинические исследования для более обоснованных рекомендаций по лечению. Некоторые карбапенемазы слабо гидролизуют ряд цефалоспоринов II и III поколений, однако клиническое значение этого феномена неясно.
Синегнойная палочка. Pseudomonas aeruginosa – частый возбудитель нозокомиальных инфекций МВП, особенно в отделениях реанимации и интенсивной терапии. Благодаря способности существовать во влажной среде P. aeruginosa контаминирует разнообразные растворы (в том числе и дезинфектанты), оборудование и поверхности. Из-за широкого распространения P. aeruginosa в госпитальной среде происходит быстрая колонизация слизистых оболочек и кожных покровов пациентов. С практических позиций при выделении P. aeruginosa у пациента с мочевым катетером важно отличать инфекцию от колонизации, так как последняя происходит достаточно быстро: в течение 2–3 дней после постановки мочевого катетера этот микроорганизм, как правило, начинает выделяться из мочи (Pollack M., 1995). Показано, что риск развития инфекций, вызванных P. aeruginosa, повышается при нахождении в ОРИТ, постановке мочевого катетера, нейтропении, применении антибиотиков широкого спектра, системных глюкокортикоидов.
P. aeruginosa обладает многочисленными факторами вирулентности, причем мощным индуктором системной воспалительной реакции служит липополисахарид этого микроорганизма. Для P. aeruginosa характерны различные механизмы устойчивости – гиперпродукция хромосомных бета-лактамаз класса С и металлоэнзимов класса В, снижение проницаемости клеточной стенки для антибиотиков (утрата пориновых каналов), активное выведение препарата из клетки (эффлюкс). В то же время продукция БЛРС у этого микроорганизма отмечается редко.
Вследствие наличия у P. aeruginosa различных факторов вирулентности синегнойная инфекция потенциально опасна и обычно характеризуется тяжелым, иногда молниеносным течением. Вследствие наличия у P. aeruginosa различных механизмов устойчивости нередки случаи выделения штаммов этого микроорганизма с множественной устойчивостью к большинству, а иногда ко всем антибиотикам. Поэтому лечение инфекций, вызванных P. aeruginosa, достаточно сложно и малоэффективно без адекватного микробиологического контроля, учитывая плохо прогнозируемую чувствительность этого микроорганизма. Характерной особенностью P. aeruginosa служит быстрое формирование устойчивости к антибиотикам, что диктует необходимость применения максимальных их доз и назначения комбинированной терапии.
Природную активность в отношении синегнойной палочки проявляют многие антибиотики: пенициллины (пиперациллин/тазобактам), цефалоспорины (цефтазидим, цефепим), карбапенемы [дорипенем, меропенем, имипенем, аминогликозиды (амикацин, гентамицн, тобрамицин, нетилмицин), полимиксин В. Из фторхинолонов клинически значимой активностью в отношении P. aeruginosa обладают два из них – ципрофлоксацин и левофлоксацин (частично норфлоксацин). Активность цефепима и цефтазидима примерно одинаковая. Природная активность ципрофлоксацина немного выше по сравнению с левофлоксацином. Однако высокий уровень приобретенной резистентности госпитальных штаммов этого микроорганизма существенно ограничивает спектр потенциально эффективных препаратов. Наблюдаются выраженные вариации в частоте устойчивости P. aeruginosa к различным антибиотикам между стационарами. Чувствительность P. aeruginosa к антипсевдомонадным антибиотикам в каждом конкретном случае предсказать сложно. Практически не отмечается резистентности P. aeruginosa только к полимиксину, однако этот антибиотик служит средством крайнего резерва из-за высокой токсичности, в частности нефротоксичности.
Рекомендации по лечению инфекций, вызванных P. aeruginosa, можно представить только на основании локальных эпидемиологических данных о чувствительности доминирующих в лечебном отделении штаммов синегнойной палочки к антибиотикам.
В обобщенном виде тактические вопросы антибактериальной терапии псевдомонадных инфекций можно сформулировать следующим образом.
- При лечении инфекций, вызванных госпитальными штаммами P. aeruginosa, антибиотики следует назначать в максимальной разрешенной дозе.
- В случае выявления полирезистентных штаммов целесообразна комбинированная терапия (антисинегнойный бета-лактам+аминогликозид+антисинегнойный фторхинолон).
- Комбинация аминогликозида с бета-лактамным антибиотиком не сопровождается увеличением клинической эффективности, но ограничивает формирование устойчивости P. aeruginosa.
- При чувствительности синегнойной палочки к антибиотикам разных групп лечение целесообразно проводить антипсевдомонадным цефалоспорином или пенициллином, а карбапенемы и фторхинолоны резервировать как средства 2-й линии.
- Карбапенемы не следует назначать, если P. aeruginosa проявляет чувствительность к антибиотикам других групп из-за риска селекции полирезистентных штаммов.
Энтерококки. Характеризуются низкой вирулентностью. У здорового человека колонизируют кишечник, могут определяться в полости рта и на коже промежности. В пределах рода Enterococcus выделяют более 10 видов микроорганизмов, большинство из которых редко встречаются при нозокомиальных инфекциях у иммунокомпетентных пациентов. Наибольшее значение при мочевых инфекциях имеют два микроорганизма – Enterococcus faecalis (85–90%) и Enterococcus faecium (10–15%). У энтерококков есть несколько факторов вирулентности, определяющих их патогенность при инфекциях МВП. К важнейшим из них относятся цитолизин, субстанция агрегации, желатиназа, внеклеточный супероксид и внеклеточный поверхностный протеин.
Современные представления о патогенезе нозокомиальных энтерококковых инфекций МВП предполагают последовательное развитие двух процессов. На первом этапе кишечник пациентов, попавших в стационар, колонизируется госпитальными штаммами энтерококков, обладающими факторами вирулентности, что обеспечивает таким микроорганизмам определенные селективные преимущества. Передача и распространение госпитальных штаммов осуществляются через руки медицинского персонала, значительную роль играют также медицинские приборы и оборудование (манжеты тонометров, стетоскопы, электроды и т.д.).
Если же пациенты подвергаются интенсивной антибактериальной терапии, то энтерококки получают дополнительные селективные преимущества за счет элиминации из кишечника обычной чувствительной к антибиотикам микрофлоры. На этом фоне в результате снижения противоинфекционной резистентности или применения инвазивных процедур (например, катетеризации мочевого пузыря) у части пациентов происходит развитие клинически выраженных инфекционных процессов (Сидоренко С.В., Яковлев С.В., 2003). Нозокомиальные инфекции МВП, вызываемые энтерококками, развиваются как спорадически, так и в виде вспышек.
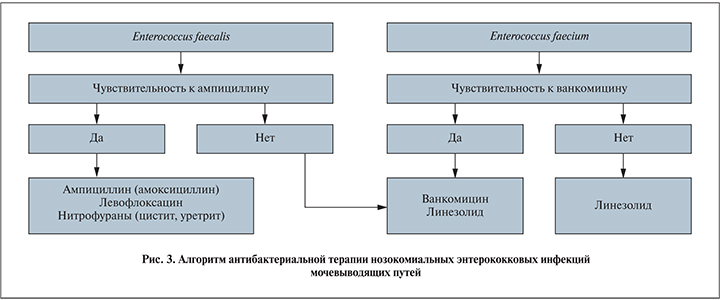
Большинство штаммов E. faecalis чувствительно к ампициллину, который может быть препаратом выбора при этой инфекции (иногда рекомендуют в комбинации с гентамицином, однако клинического подтверждения более высокой эффективности комбинации не получено). В качестве ступенчатой терапии при долечивании пациентов можно использовать амоксициллин после парентерального ампициллина. Ингибитор-защищенные аминопенициллины (ампициллин+сульбактам, амоксициллин+клавулановая кислота, амоксициллин+сульбактам) не имеют преимуществ по сравнению с ампициллином, так как продукция бета-лактамаз у энтерококков регистрируется крайне редко.
Более того, при лечении энтерококковых инфекций важным фактором служит адекватность режима дозирования антибиотика – для ампициллина суточная доза должна быть не ниже 8 г. Бета-лактамные антибиотики более широкого спектра (имипенем, меропенем, пиперациллин+тазобактам) не имеют преимуществ по сравнению с ампициллином против энтерококков. Цефалоспорины природно не активны в отношении энтерококков. Одинаковая с ампициллином клиническая эффективность при инфекциях, вызванных E. faecalis, прогнозируется при применении левофлоксацина (рис. 3).
При инфекциях нижних отделов МВП могут быть назначены нитрофураны, устойчивость к которым среди энтерококков минимальная.
Устойчивые к ампициллину E. faecalis в настоящее время следует считать устойчивыми ко всем бета-лактамным антибиотикам, даже несмотря на возможную чувствительность in vitro. В этих ситуациях следует использовать ванкомицин или линезолид.
E. faecium природно не чувствителен к бета-лактамным антибиотикам. При инфекциях, вызванных E. faecium, целесообразно использовать ванкомицин (иногда рекомендуют комбинировать с гентамицином). При катетер-ассоциированных инфекциях нижних отделов МВП возможно назначение нитрофуранов при документированной к ним чувствительности (чувствительность проявляют от 60 до 90% штаммов E. faecium). Высокой клинической эффективностью при энтерококковых инфекциях, в том числе в случае штаммов, устойчивых к ванкомицину, обладает линезолид. Однако концентрации линезолида в моче не очень высокие, но при инфекции почек его применение выглядит обоснованным.
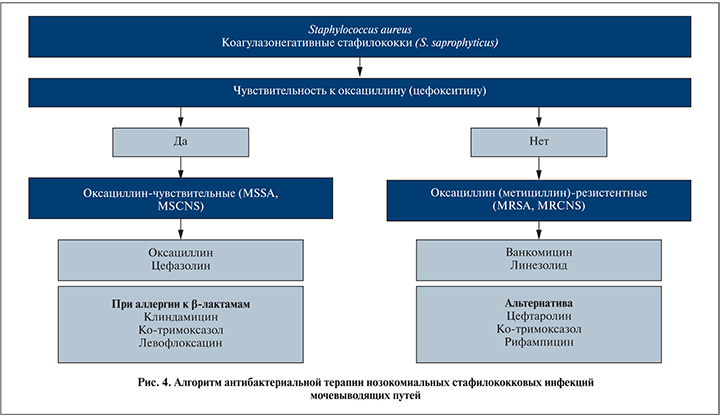
Стафилококки. В отличие от нозокомиальных инфекций других локализаций, при инфекциях МВП наибольшее значение имеют коагулазонегативные стафилококки (в большей степени Staphylococcus saprophyticus), в гораздо меньшей степени – S. aureus, причем выделение последнего из мочи всегда требует оценки его клинической значимости. Основной механизм резистентности стафилококков связан с продукцией бета-лактамаз (пенициллиназ), разрушающих природные и некоторые полусинтетические пенициллины (ампициллин, карбенициллин, пиперациллин/тазобактам). Этот механизм устойчивости стафилококков опосредован плазмидами и часто ассоциируется также с устойчивостью к макролидным антибиотикам, тетрациклинам, хлорамфениколу и некоторым другим препаратам. В то же время пенициллиназостабильные пенициллины (оксациллин), ингибиторзащищенные пенициллины (амоксициллин/клавулановая кислота, ампициллин+сульбактам, пиперациллин+тазобактам), цефалоспорины и карбапенемы устойчивы к гидролизу этими ферментами.
В настоящее время большинство штаммов стафилококков продуцирует бета-лактамазы (более 90%). В связи с этим при выделении стафилококков из мочи следует безусловно предполагать их устойчивость к бензилпенициллину и незащищенным полусинтетическим пенициллинам, кроме оксациллина.
Другой механизм устойчивости S. aureus и коагулазонегативных стафилококков связан с продукцией измененного пенициллинсвязывающего белка (PSP2a).
В этом случае наблюдается устойчивость к метициллину (оксациллину), а также ко всем другим бета-лактамным антибиотикам. Такие штаммы называют MRSA (Methicillen-Resistant Staphylococcus Aureus), или MRCNS (Methicillin-Resistant Coagulase-Negative Staphylococcus). Хотя в некоторых случаях in vitro оксациллин- или метициллин-резистентные стафилококки проявляют чувствительность к некоторым бета-лактамам, в клинической практике, как правило, эти препараты неэффективны. Поэтому при выделении стафилококка, устойчивого к оксациллину, подразумевается его устойчивость ко всем другим бета-лактамам (пенициллинам, цефалоспоринам, карбапенемам).
Важно, что часто у этих штаммов стафилококков наблюдается ассоциированная устойчивость к аминогликозидам, макролидам, линкозамидам, тетрациклинам. Частично в отношении MRSA и MRCNS сохраняют активность ко-тримоксазол (90–95% штаммов чувствительны), рифампицин (40–60%), фторхинолоны (30–50%), однако их клиническая эффективность при таких инфекциях плохо изучена, по крайней мере в монотерапии.
Факторы риска инфекций, вызванных MRSA, включают нахождение в ОРИТ, предшествующую госпитализацию и антибиотикотерапию (фторхинолоны, цефалоспорины III поколения), наличие внутрисосудистых катетеров, назофарингеальное носительство MRSA, контакт с пациентами, инфицированными MRSA (Clark N.M., 2003).
С практических позиций при определении программы терапии стафилококковых инфекций важно получение результата из микробиологической лаборатории о чувствительности стафилококка к оксациллину. При высеве чувствительных штаммов препаратом выбора служит оксациллин (рис. 4), альтернативными средствами – цефалоспорины I поколения (цефазолин, цефалексин), при аллергии к бета-лактамам – клиндамицин или левофлоксацин.
Важно подчеркнуть, что цефалоспорины III поколения, ципрофлоксацин, ванкомицин не могут рассматриваются как адекватные антибиотики против чувствительных к оксациллину стафилококков, даже при чувствительности к ним in vitro. Хотя ванкомицин в течение многих лет рассматривался как препарат выбора при MRSA-инфекциях, он характеризуется низкой бактерицидной антистафилококковой активностью и в случае оксациллинчувствительных стафилококков уступает по эффективности антистафилококковым пенициллинам (M.J. Rybak, 2009).
При устойчивости к оксациллину необходимо дополнительное исследование на чувствительность к ванкомицину, линезолиду, рифампицину, ко-тримоксазолу, клиндамицину, левофлоксацину. Устойчивость стафилококков к оксациллину сопровождается устойчивостью ко всем бета-лактамным антибиотикам, кроме цефтобипрола медокарила и цефтаролина фосамила, которые имеют определенное сродство к пенициллинсвязывающим белкам 2А-типа. Адекватными антибиотиками для лечения MRSA- и MRCNS-инфекций служат ванкомицин, линезолид, цефтаролина фосамил, хотя последние два не имеют в инструкции официального одобрения для лечения инфекций МВП. Следует подчеркнуть, что при чувствительности MRSA и MRCNS in vitro к ко-тримоксазолу, левофлоксацину эти антибиотики могут обсуждаться как альтернативные средства, хотя их клиническая эффективность документирована только при инфекциях кожи и мягких тканей; в случае MRSA-бактериемии или инфекции МВП их клиническая эффективность не изучена. Также дискутабелен вопрос о возможности применения рифампицина при MRSA- и MRCNS-инфекциях в режиме монотерапии.
Основным препаратом для лечения MRSA- и MRCNS-инфекций в течение многих лет был ванкомицин (в некоторых странах также доступны тейкопланин и телаванцин), хотя он не рассматривался как оптимальный антибиотик из-за низкой природной антистафилококковой активности и плохой тканевой пенетрации. В последние годы отмечено появление стафилококков со сниженной чувствительностью к ванкомицину и значениями МПК 2 мкг/мл, причем в некоторых регионах эти штаммы становятся доминирующими. Повышение МПК MRSA 2 мкг/мл (в пределах микробиологической чувствительности) сопровождается снижением клинической эффективности ванкомицина (Stevens D.L., 2006; Moise-Broder P.A., 2004).
В XXI в. становится актуальным выявление стафилококков с промежуточной устойчивостью к ванкомицину (так называемые VISA-штаммы), что ассоциируется с клинической неэффективностью ванкомицина (Neoh H., 2007).
Дополнительные сложности прогнозирования эффективности ванкомицина заключаются в том, что классический диско-диффузионный метод определения чувствительности микроорганизмов к антибиотикам не позволяет выявлять стафилококки со сниженной чувствительностью к ванкомицину и VISA-штаммам (Sader H.S., 2006). Следовательно, для правильного определения чувствительности стафилококков к ванкомицину необходимо использование бактериологическими лабораториями метода серийных микроразведений или Е-тесты.
Таким образом, в современных условиях знание основных тенденций антибиотикорезистентности возбудителей нозокомиальных инфекций МВП определяет выбор адекватных программ целенаправленной и эмпирической антибактериальной терапии. С учетом обсужденных наиболее важных механизмов резистентности грамотрицательных возбудителей нозокомиальных инфекций можно сформулировать рациональные рекомендации по выбору антибактериального препарата для целенаправленной или этиотропной терапии. Исходя из этих рекомендаций можно проводить планирование эмпирической антибактериальной терапии нозокомиальных инфекций МВП.
Профилактика
Основные меры профилактики нозокомиальных катетер-ассоциированных инфекций МВП достаточно четко сформулированы с позиций доказательной медицины в основополагающих документах и практических рекомендациях США и Европы (Hooton T.M., 2010; Tenke P., 2008; Grabe M., 2012; Lo E., 2008).
В России также можно привести два документа, в которых достаточно адекватно представлена эта проблема (Национальная концепция профилактики инфекций, связанных с оказанием медицинской помощи, 2012; Стратегия и тактика применения антимикробных средств в лечебных учреждениях России: Российские национальные рекомендации, 2012).
Основные наиболее важные положения этих документов приведены ниже.
Комплекс мероприятий по профилактике нозокомиальных инфекций МВП включает следующее.
- Прерывание миграции бактерий в мочевыводящие пути.
- Применение катетеризации мочевого пузыря по абсолютным показаниям; ежедневный анализ необходимости продления катетеризации и при возможности удаление катетера.
- Применение катетеров минимально допустимых размеров из биоинертных материалов.
- Разработка стандартов противоинфекционной защиты процедуры и выполнение в строгом соответствии с ними катетеризации мочевого пузыря, смены и опорожнения мочеприемников с уделением особого внимания обработке рук.
- Надежная фиксация мочевого катетера и обеспечение свободного тока мочи.
- Использование закрытых дренажных систем.
- Проведение ежедневного ухода за периуретральной областью у катетеризированных пациентов.
- Использование индивидуальных контейнеров для опорожнения мочеприемника у каждого пациента.
- Минимальная продолжительность катетеризации мочевого пузыря и дренирования МВП.
- Профилактическое назначение антибиотиков не показано как при установке катетера, так и при его замене вследствие низкой эффективности и риска селекции полирезистентной микрофлоры.
- Не рекомендуется местное введение антибиотиков или антисептиков в мочеиспускательный канал, мочевой катетер или мочевой пузырь с целью профилактики или лечения катетер-ассоциированной мочевой инфекции из-за недоказанной эффективности данных мероприятий и высокого риска селекции полирезистентных микроорганизмов. Обучение медицинского персонала стандартам проведения катетеризации и ухода за катетерами, пациентами.
- Для предупреждения перекрестного инфицирования и суперинфицирования катетеризированных пациентов, у которых из мочи выделяется особо опасная полирезистентная флора (карбапенемазы, панрезистентная P. aeruginosa, ванкомицинрезистентные энтерококки), необходима изоляция таких пациентов.



