Введение. В настоящее время в мире отмечается отчетливая тенденция снижения количественных и качественных характеристик спермы человека [1]. Демографические показатели во многих странах мира свидетельствуют об увеличении частоты инфертильного состояния мужчин, достигающей 30–50% [2].
В связи с этим одной из ключевых проблем урологии является мужское бесплодие, обусловленное нарушением репродуктивной функции мужчин и снижением фертильности сперматозоидов.
С внедрением современных вспомогательных репродуктивных технологий (ВРТ) стало возможным деторождение от мужчин, страдающих бесплодием. Однако для применения этих технологий необходимо использовать только здоровые, жизнеспособные сперматозоиды. Клетки, запрограммированные на гибель путем апоптоза, не пригодны для оплодотворения, так как такой материал не может быть использован для строительства нового организма [3, 4].
Апоптоз – механизм, посредством которого реализуется генетическая программа гибели клеток, в том числе и половых клеток, в процессе сперматогенеза. С помощью апоптоза в сперматогенезе регулируется численность половых клеток, происходит селективная элиминация гамет с аномальной морфологией, биохимическими функциями или повреждениями ДНК, хотя о полном удалении патологических сперматозоидов говорить нельзя [5].
В норме апоптоз не должен затрагивать эякуляторные сперматозоиды, так как их предназначение – не выполнение функции в пределах определенного срока, а формирование нового организма, продолжение жизни. Однако ряд авторов описывают присутствие маркеров апоптоза у эякуляторных сперматозоидов: экстернализацию фосфатидилсерина (ФС), увеличение активности каспаз, фрагментацию ДНК, Fas-экспрессию, но природа и роль этих маркеров апоптоза до сих пор не известны [6–11].
Такие сперматозоиды могут быть подвижными, морфологически полноценными и визуально ничем не отличаться от нормальных, но процесс апоптоза вызывает в клетках необратимые изменения, в частности разрушение их ДНК [12].
Учитывая вышесказанное, традиционных показателей спермограммы не всегда бывает достаточно в оценке мужской фертильности. В связи с этим особую актуальность приобретает исследование маркеров апоптоза сперматозоидов для расширения доказательной базы некоторых параметров спермы и определения качества половых клеток, а на основании этого создание новых методов диагностики нарушений фертильности.
Одно из самых ранних биохимических изменений, происходящих в клетке, подвергшейся апоптозу, – это реорганизация клеточной мембраны, в результате чего на ее поверхность начинают экспрессироваться некоторые молекулы, например ФС, чего в норме не происходит. Фосфатидилсерин – фосфолипид, который в процессе апоптоза локализуется на клеточной поверхности (экстернализация ФС) и формирует один из специфических сигналов для распознавания апоптотической клетки [13–15].
Некоторые исследователи пытались выявить взаимосвязь между маркерами апоптоза (экстернализацией ФС, фрагментацией ДНК, экспрессией Fas-антигена и т.д.) у эякуляторных сперматозоидов и традиционными параметрами спермы, рекомендованными к исследованию ВОЗ (морфологией сперматозоидов, концентрацией, подвижностью) [12, 16–18]. Однако эти данные носят довольно противоречивый характер, корреляция обнаружена не во всех работах, что диктует необходимость расширения исследований в этом направлении.
Целью данного исследования было выявить взаимосвязь между экстернализацией ФС как раннего маркера апоптоза и функционально-морфологическими нарушениями сперматозоидов у бесплодных мужчин для последующей оценки влияния апоптоза на фертильность сперматозоидов.
Материалы и методы. В исследовании приняли участие 78 субфертильных, состоящих в бесплодном браке более 1 года, и 18 здоровых фертильных мужчин в возрасте от 25 до 48 лет. От всех мужчин было получено информативное согласие на проведение исследований.
Субфертильные мужчины были разделены на группы в соответствии с выявленным нарушением в спермограмме [19]: олигозооспермия (n=10); астенозооспермия (n=32); тератозооспермия (n=22); олигоастенотератозооспермия (ОАТ) (n=14).
Сбор эякулятов осуществляли после 72 ч сексуального воздержания. Каждый эякулят после разжижения разделяли на две части: одну часть использовали для анализа физико-химических и функционально-морфологических параметров, другую – для выявления экстернализации ФС.
 Измерение показателей стандартной спермограммы – концентрации, подвижности, жизнеспособности и морфологии сперматозоидов – проводили в соответствии с рекомендациями и нормативами ВОЗ 5-го издания от 2010 г. [19], согласно которым все исследованные нами эякуляты были разделены на фертильные и субфертильные.
Измерение показателей стандартной спермограммы – концентрации, подвижности, жизнеспособности и морфологии сперматозоидов – проводили в соответствии с рекомендациями и нормативами ВОЗ 5-го издания от 2010 г. [19], согласно которым все исследованные нами эякуляты были разделены на фертильные и субфертильные.
Для выявления экстернализации ФС отмытые от семенной плазмы фосфатно-солевым буфером (pH=7,4) сперматозоиды (1×106) инкубировали при температуре 37°С в течение 10 мин с аннексином-V (АnV), коньюгированным с флуорохромом (АnV–FITC), и йодистым пропидием PI («Becton Dickinson»), согласно инструкции изготовителя. Мазки исследовали на флуоресцентном микроскопе под иммерсионным объективом ×100 [13, 20].
Статистическую обработку полученных данных выполняли с использованием программы EXСEL-2007. О достоверности различий судили по величине t-критерия Стьюдента. Данные представляли в виде М±m, различия между показателями считали достоверными при р<0,05. Для оценки взаимосвязи исследуемых показателей использовали коэффициент корреляции (r) Пирсона.
Результаты. Живые сперматозоиды не связывают AnV и непроницаемы для катионного красителя PI. При флуоресцентной микроскопии их расценивали как (AnV-/PI-)-сперматозоиды. Некротические клетки не связывают AnV, но проницаемы для PI, их расценивали как (AnV-/PI+)-сперматозоиды.
Нарушение фосфолипидной асимметрии в динамике развития апоптоза соответствует начальным этапам фрагментации ДНК и конденсации хроматина (ранний апоптоз) и предшествует потере проницаемости мембраны для PI. На этой стадии апоптотические сперматозоиды связывают AnV, но, как и живые клетки, не проницаемы для PI. Поздняя фаза апоптоза сопровождается не только нарушением мембранной асимметрии и связыванием AnV, но и резким увеличением проницаемости мембраны для PI.
В эякулятах всех обследованных мужчин были идентифицированы два вида АnV-связывающих сперматозоидов: (AnV+/PI-)- и (AnV+/PI+)-сперматозоиды, что соответствовало ранней и поздней стадиям апоптоза соответственно.
Было выявлено, что у фертильных мужчин доля сперматозоидов с признаками экстернализации ФС составила в среднем 16%, из которых 10,1±0,4% были (AnV+/PI-)-сперматозоиды.
У субфертильных мужчин общее количество сперматозоидов с признаками экстернализации ФС было достоверно больше, чем у фертильных мужчин (р<0,01), и составило в среднем почти 40%, из которых 17,8±1,1% оказались (АnV+/PI-)-сперматозоидами, а 21,6±1,0% – (АnV+/PI+)-сперматозоидами. Причем выявлено, что у субфертильных мужчин процентное содержание в эякулятах (AnV+/PI+)-сперматозоидов (поздний апоптоз) коррелировало с процентным содержанием (АnV+/PI-)-сперматозоидов (ранний апоптоз; r=0,7, р<0,001).
Было проведено сравнение содержания сперматозоидов с экстернализацией ФС в эякулятах мужчин с разными формами субфертильности. Для этого субфертильных мужчин разделили на группы в зависимости от показателей спермограммы: пациенты с олиго-, астено-, тератоспермией и с ОАТ. Все обследованные группы мужчин достоверно различались между собой по концентрации, содержанию живых, аномальных и активно подвижных сперматозоидов. Однако не удалось выявить статистически значимых различий (р>0,05) в содержании (AnV+)-сперматозоидов в эякулятах пациентов с разными формами субфертильности.
Анализ связи между процентным содержанием в эякулятах субфертильных мужчин (AnV+)-сперматозоидов и физико-химическими показателями эякулята – объемом, вязкостью и временем разжижения, не выявил достоверной корреляции (р>0,05).
Также не установлено корреляции между количеством (AnV+)-сперматозоидов в эякуляте и возрастом субфертильных мужчин (р>0,05). Однако этот результат имеет отношение только к данному исследованию, так как все обследованные нами субфертильные мужчины – молодые люди в возрасте от 25 до 48 лет (в среднем 33,5±0,7 года).
В качестве функционально-морфологических критериев качества спермы были выбраны концентрация, подвижность и количество морфологически измененных форм сперматозоидов, в том числе и сперматозоидов с цитоплазматической каплей, поскольку этот критерий крайне редко используется при оценке количества сперматозоидов атипичной формы и, соответственно, редко обсуждается.
Выявлена достоверная положительная корреляция между количеством (AnV+/PI+)-сперматозоидов и концентрацией сперматозоидов (r=0,49; р<0,001); подвижность сперматозоидов отрицательно коррелировала с содержанием в эякуляте (АnV+/PI+)-клеток (r= -0,37; р<0,001); отмечена положительная корреляция между количеством (АnV+/PI+)-клеток и содержанием в эякуляте патологических форм сперматозоидов (r=0,3; р<0,01); обнаружена положительная корреляция между количеством окрашенных АnV клеток – (АnV+/PI-)- и (АnV+/PI+)-клетками – и наличием в эякуляте сперматозоидов с цитоплазматической каплей (r=0,23, р<0,05; r=0,47, р<0,001 соответственно).
Не установлено корреляции между содержанием в эякуляте (АnV+/PI-)-клеток и основными параметрами спермы.
Было проведено расширенное цитологическое исследование с целью выявления различных форм дефектов сперматозоидов (патология головки, шейки, хвоста). Выявлена положительная корреляция между процентным содержанием в эякулятах субфертильных мужчин (АnV+/PI+)-сперматозоидов с дефектами головки (r=0,45, р<0,01), средней части (r=0,3, р<0,05) и дефектами хвоста (r=0,45, р<0,01).
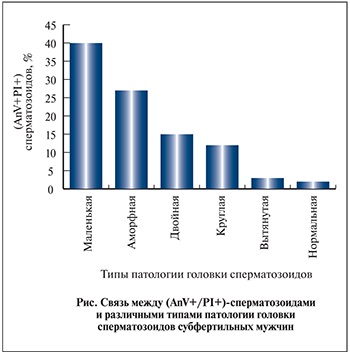
Самая сильная корреляция наблюдалась с патологией головки и хвоста. Большинство (АnV+/PI+)-сперматозоидов имело атипичную форму головки – в основном маленькую и аморфную.
В группах всех обследованных субфертильных мужчин наиболее встречаемыми атипичными формами были сперматозоиды с маленькими и аморфными головками (см. рисунок).
Самый большой процент (АnV+/PI+)-сперматозоидов с двойными, круглыми и вытянутыми головками был в группах с тератоспермией и ОАТ, так как в этих группах было пять мужчин с мономорфными атипичными головками: два со 100%-ными круглыми (главным образом двойными), два со 100%-ными круглыми и один со 100%-ными вытянутыми.
Необходимо отметить, что, согласно полученным данным, среди сперматозоидов с нормальной морфологией редко встречались клетки, связывающие АnV.
Обсуждение. Результаты проведенного исследования выявили различия не только в процентном содержании (AnV+)-сперматозоидов, но и в процентном содержании (АnV+/PI-)- и (АnV+/PI+)-сперматозоидов в эякулятах у фертильных и субфертильных мужчин.
У фертильных мужчин из общего количества (AnV+)-сперматозоидов больший процент приходился на долю живых (АnV+/PI-)-сперматозоидов с признаками раннего апоптоза. У субфертильных мужчин при большем количестве сперматозоидов с признаками экстернализации ФС, чем у фертильных мужчин, доли (АnV+/PI-)- и (АnV+/PI+)-клеток были примерно одинаковыми.
Наши данные сопоставимы с результатами ранних исследований с использованием подобного подхода, выявивших, что у мужчин с нарушениями фертильности апоптотические клетки могут находиться в более поздних стадиях апоптоза. Также было отмечено, что содержание сперматозоидов с признаками апоптоза в эякулятах у субфертильных пациентов значительно выше, чем у мужчин с нормозооспермией [9, 21].
Обнаруженные различия в процентном содержании (AnV+)-сперматозоидов в эякулятах у фертильных и субфертильных мужчин позволят дополнить диагностический арсенал, используемый при выявлении причин нарушения мужской фертильности. Полученные данные могут представлять интерес при подготовке спермы для ВРТ.
Полученные результаты о корреляции количества (AnV+/PI+)-сперматозоидов субфертильных мужчин с концентрацией, подвижностью и дефектами морфологии сперматозоидов демонстрируют неблагоприятное воздействие процесса апоптоза на качество спермы.
Положительная корреляция между числом (AnV+/PI+)-клеток и концентрацией сперматозоидов противоречит некоторым ранним сообщениям [9, 21]. Противоречивые результаты о связи концентрации сперматозоидов и количеством гамет с нарушением фосфолипидной асимметрии и проницаемости мембраны можно расценить как компенсаторную реакцию усиления сперматогенеза в ответ на увеличение доли нежизнеспособных сперматозоидов.
Экстернализация ФС, выявленная при помощи аннексина-V, вероятно, произошла еще в период сперматогенеза, и окрашенные АnV-клетки – как раз те, которые должны были быть устранены в сперматогенезе в процессе апоптоза, но по каким-то причинам механизмы апоптоза не были закончены либо были отложены, либо функционировали неправильно – «абортивний апоптоз» [22].
Положительная корреляция между количеством окрашенных АnV-клеток и наличием в эякуляте сперматозоидов с цитоплазматической каплей (признаком незрелых форм сперматозоидов) также говорит в пользу теории «абортивного апоптоза».
Однако нами не было обнаружено корреляции между содержанием в эякуляте клеток в ранних стадиях апоптоза, т.е. (АnV+/PI-)-клеток, и основными параметрами спермы, что говорит о том, что качество спермы затрагивается только на последней стадии апоптоза, когда происходит не только изменение архитектоники мембраны сперматозоида, но и фрагментация ДНК [10, 12, 23].
Таким образом, продемонстрирована связь между нарушением фосфолипидной асимметрии цитоплазматической мембраны, связанной с перемещением ФС на ее внешнюю сторону, и функционально-морфологическими измненениями сперматозоидов у бесплодных мужчин, что позволяет считать экстернализацию ФС фактором, снижающим фертильность сперматозоидов.
Результаты исследования также подтверждают, что присутствие сперматозоидов с маркером апоптоза – экстернализацией ФС в эякуляте – является нормальным физиологическим явлением, однако количественное содержание таких сперматозоидов зависит от патофизиологического состояния мужчины. Возможно, апоптоз является конечным результатом различных патологических состояний и нарушения регуляции систем контроля за сперматогенезом.



