Введение. Прогрессивный рост заболеваемости доброкачественной гиперплазией предстательной железы (ДГПЖ) ставит ее в ряд важнейших медицинских и социальных проблем. Демографические исследования ВОЗ свидетельствуют о росте населения планеты в возрасте старше 60 лет, причем его темпы существенно опережают рост численности населения, что делает эту проблему еще более актуальной [1, 2]. Ее клинические проявления имеют место у 34% мужчин в возрасте 40–49 лет, у 67% – 50–59, у 77% – 60–69 и у 83% – старше 70 лет [3–5].
Оперативному лечению подвергаются свыше 40% мужчин старше 50 лет, и доля таких пациентов растет в связи с общемировой тенденцией старения населения. В настоящее время в России открытая аденомэктомия составляет 27,2% операций, трансуретральная резекция простаты – 27,8% всех операций по поводу ДГПЖ [6–8]. Несмотря на совершенствование техники оперативных вмешательств, частота осложнений продолжает расти [9].
Одной из причин смерти больных после аденомэктомии являются тромбогеморрагические осложнения (как интра-, так и послеоперационные), которые развиваются с частотой, достигающей 50%, обусловливают неудовлетворительные результаты лечения, увеличение продолжительности послеоперационного периода и в ряде случаев – летальный исход. Их профилактика должна начинаться в предоперационном периоде [10–13]. Частота тромбозов при открытой аденомэктомии достигает 30–63% от всех хирургических вмешательств. На долю трансуретральной резекции приходится 5–10%.
Более 30% тромбозов развивается интраоперационно. Согласно патологоанатомическим данным, тромбоэмболия легочной артерии развивается у 0,6–6% больных урологического профиля и в структуре послеоперационной летальности занимает второе место [14].
Несмотря на многочисленные разработки по снижению количества геморрагических осложнений, данная проблема остается актуальной.
 Цель исследования: улучшить результаты оперативного лечения пациентов с ДГПЖ путем снижения частоты тромбогеморрагических осложнений в послеоперационном периоде.
Цель исследования: улучшить результаты оперативного лечения пациентов с ДГПЖ путем снижения частоты тромбогеморрагических осложнений в послеоперационном периоде.
Материалы и методы. В основу работы положены результаты обследования 169 больных ДГПЖ без осложнений и с осложненной острой задержкой мочи (ОЗМ), которым проведено оперативное лечение в клинике урологии РУДН на базе ГКБ № 29 им. Н. Э. Баумана в 2011–2014 гг. Больным основной группы (86 [50,9%] человек) вместе с традиционными методами предоперационной подготовки (бинтование нижних конечностей эластичными бинтами или использование компрессионного трикотажа во время операции и в послеоперационном периоде в сочетании с применением фраксипарина в профилактических дозах) провели внутривенное лазерное облучение крови (ВЛОК). Контрольную группу составили 83 (49,1%) пациента, которым проводили традиционную профилактику.
В основной группе ДГПЖ осложнилась острой задержкой мочеиспускания у 35 (20,7%) больных, в контрольной – у 34 (20,1%). Пациентам с ОЗМ при поступлении установили уретральный катетер Folеy 16–18 Сh, после чего назначили α-адреноблокаторы (тамсулозин 0,4) и антибиотики широкого спектра действия перорально (фторхинолоны, цефалоспорины). Катетер удалили на 3-и сутки, после чего пациентов с восстановившимся мочеиспусканием выписали домой и в плановом порядке провели оперативное лечение ДГПЖ. Пациентам с неразрешившейся задержкой выполнили троакарную цистостомию и также выписали домой с последующей плановой госпитализацией для проведения второго этапа оперативного лечения. В отношении всех пациентов собрали анамнез, провели клинические, лабораторные и инструментальные методы исследования.
 Морфофункциональное состояние тромбоцитов оценили с помощью аппаратно-программного комплекса БИОНИ (АПК БИОНИ) методом компьютерной цитоморфометрии. Исследования провели на базе МОНИКИ им. М. Ф. Владимирского. В ходе изучения тромбоцитов выделили 4 основных морфологических типа в популяции живых клеток, характеризующих ту или иную степень их активации в зависимости от варианта их формы, характера рельефа поверхности, наличия псевдоподий, их числа и величины, которые соответствуют формам клеток, полученных при электронной микроскопии [15]. Плоские округлые клетки с гладкой или складчатой поверхностью – «гладкие» и «рифленые» дискоциты соответствовали I типу. Ко II морфологическому типу тромбоцитов были отнесены клетки округлой или неправильной формы с гладкой или складчатой поверхностью и 1–3 короткими (меньше диаметра клетки) отростками-псевдоподиями, являющимися выростами поверхностной мембраны. Клетки, имевшие около 2–5 длинных (больше диаметра клетки) отростков, представляли III тип и отличались большим многообразием форм: от плоских дисков до клеток неправильной формы. Тромбоциты неправильной формы с неровной бугристой поверхностью, большим количеством отростков различной длины и многочисленными вакуолями были отнесены к IV морфологическому типу – дегенеративно-измененным клеткам (рис. 1).
Морфофункциональное состояние тромбоцитов оценили с помощью аппаратно-программного комплекса БИОНИ (АПК БИОНИ) методом компьютерной цитоморфометрии. Исследования провели на базе МОНИКИ им. М. Ф. Владимирского. В ходе изучения тромбоцитов выделили 4 основных морфологических типа в популяции живых клеток, характеризующих ту или иную степень их активации в зависимости от варианта их формы, характера рельефа поверхности, наличия псевдоподий, их числа и величины, которые соответствуют формам клеток, полученных при электронной микроскопии [15]. Плоские округлые клетки с гладкой или складчатой поверхностью – «гладкие» и «рифленые» дискоциты соответствовали I типу. Ко II морфологическому типу тромбоцитов были отнесены клетки округлой или неправильной формы с гладкой или складчатой поверхностью и 1–3 короткими (меньше диаметра клетки) отростками-псевдоподиями, являющимися выростами поверхностной мембраны. Клетки, имевшие около 2–5 длинных (больше диаметра клетки) отростков, представляли III тип и отличались большим многообразием форм: от плоских дисков до клеток неправильной формы. Тромбоциты неправильной формы с неровной бугристой поверхностью, большим количеством отростков различной длины и многочисленными вакуолями были отнесены к IV морфологическому типу – дегенеративно-измененным клеткам (рис. 1).
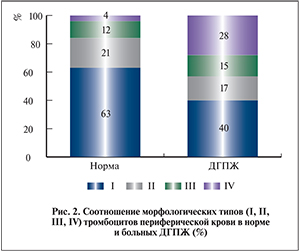
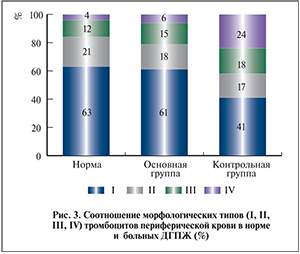
Гладкие и рифленые дискоциты являются так называемыми формами покоя. Тромбоциты II–III типов, отличающиеся появлением отростков различного числа и длины, а также изменением их формы, связанной с перестройкой цитоскелета и структуры грануломера, проявляют внешние признаки функциональной активности. Клетки IV типа – тромбоциты, исчерпавшие свой функциональный потенциал. Известно, что в нормальных условиях 63% тромбоцитов представлено клетками «покоя», 21% – тромбоцитами с низким уровнем активации (II тип), 12% – высокоактивированными клетками с длинными отростками-«антеннами» (III тип), 4% – дегенеративно-измененными (IV тип) [16]. Морфометрию тромбоцитов провели при поступлении, перед операцией и через две недели после операции.
Всем пациентам выполнили УЗИ предстательной железы. Измерили пиковую скорость (Vmax) и конечную диастолическую скорость кровотока (Vmin), скорость венозного кровотока, которая характеризует состояние тонуса венул, вен и наличие венозного полнокровия органов малого таза, в том числе предстательной железы, рассчитывали качественные показатели, такие как индекс пульсативности (PI) и индекс резистивности (RI). После клинико-лабораторного обследования всем пациентам без ОЗМ выполнили чреспузырную аденомэктомию или трансуретральную резекцию аденомы предстательной железы. Выбор метода оперативного лечения зависел от объема предстательной железы и характера роста аденоматозных узлов. В 1-е, 3-и, 7-е сутки и через 2 нед после операции провели клинический осмотр, выполнили клинический анализ крови, биохимический анализ крови, общий анализ мочи, исследовали коагулограмму.
Внутривенное лазерное облучение крови осуществлено с помощью полупроводникового аппарата «АЗОР» и световодных насадок (мощность излучения – 2 мВт, длина волны – 0,63 мкм). Время экспозиции составило 45 мин однократно в течение 7 сут для пациентов перед плановым оперативным лечением и в течение 3 сут для таковых с ОЗМ на фоне дренирования мочевого пузыря. Среди сопутствующих заболеваний у пациентов обеих групп чаще всего встречались ишемическая болезнь сердца, гипертоническая и варикозная болезнь нижних конечностей. По сопутствующим заболеваниям пациенты были распределены по группам примерно одинаково. Доброкачественная гиперплазия предстательной железы часто сопровождается хроническими воспалительными заболеваниями почек и нижних мочевых путей. Хронический пиелонефрит диагностирован у 21 (12,4%) больного, хронический простатит – у 79 (46,7%).
Статистический анализ проводился в пакете программ STАTISTIСА 10. При обработке результатов использовались как параметрические, так и непараметрические методы. Если закон распределения соответствовал нормальному закону, применяли параметрические методы, в противном случае использовались непараметрические методы.
Зависимость между двумя количественными переменными исследовалась с помощью корреляционного анализа с определением коэффициента корреляции Пирсонa.
Анализ двух независимых и зависимых (парных) выборок проводился на основании t-критерия Стьюдента с определением уровня значимости р-критерия. Однофакторный дисперсионный анализ применялся при сравнении средних значений для трех и более выборок. Определялся уровень значимости р-критерия наименьшей значимой разности (НЗР).
Правило проверки статистической значимости взаимосвязи между качественными переменными простое – если уровень значимости р меньше, чем 0,05, взаимосвязь статистически значима, если р больше, чем 0,05, результат считался статистически не значимым.
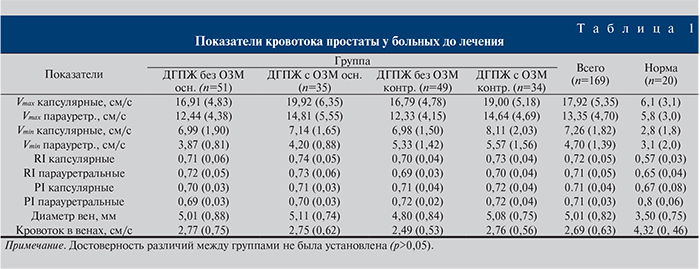
Результаты. С помощью трансректальной ультразвуковой допплерографии установлено, что у пациентов всех групп имелись изменения кровотока в сосудах предстательной железы. У мужчин основной и контрольной групп без ОЗМ Vmax в капсулярных артериях составила 16,91±4,83 и 16,79±4,78 см/с, у больных ОЗМ – 19,92±6,35 и 19,00±5,18 соответственно. Данный показатель кровотока в парауретральных артериях в основной и контрольной группах пациентов без ОЗМ был увеличен в 2 раза и составил 12,44±4,38 и 12,33±4,15 см/с соответственно. У 13 (15,1%) пациентов основной группы и 8 (9,5%) – контрольной Vmax превысила 25 см/с. При анализе Vmin в капсулярных артериях у больных ДГПЖ без ОЗМ в обеих группах нами отмечено ее возрастание в 2,5 раза по сравнению с нормой. В основной группе она составила 6,99±1,90 см/с в контрольной – 6,98±1,50, при этом у 13 (15,1%) пациентов основной группы и 16 (19,3%) – контрольной она была увеличена в 5 раз. У пациентов с ОЗМ Vmin была выше в 3 раза и составила 7,14±1,65 и 8,11±2,03 см/с соответственно. У 8 (9,3%) пациентов основной группы и у 5 (6%) – контрольной она достигла 15 см/с. Показатель Vmin в парауретральных артериях по сравнению с нормой был увеличен в 1,5 раза у пациентов без ОЗМ и почти в 2 раза – с ОЗМ. В основной группе у пациентов без ОЗМ она составила 3,87±0,81 см/с, в контрольной – 5,33±1,42.
У больных ОЗМ основной и контрольной групп она составила 4,20±0,88 и 5,57±1,56 см/с соответственно.
У всех мужчин при поступлении определено повышение средних показателей RI, причем он был значительно выше у пациентов с ОЗМ. У пациентов с ДГПЖ без ОЗМ в основной и контрольной группах средний RI составил 0,71±0,06 и 0,70±0,04 в капсулярных и 0,72±0,05 и 0,69±0,03 в парауретральных артериях соответственно. При ОЗМ RI увеличивался до 0,74±0,05 в капсулярных артериях и до 0,73±0,06 – в парауретральных. Также было отмечено повышение PI у больных ДГПЖ без ОЗМ в основной и контрольной группах до 0,70±0,03 и 0,71±0,04 в капсулярных и до 0,69±0,03 и 0,72±0,02 в парауретральных артериях соответственно. У пациентов с ОЗМ PI в капсулярных и парауретральных артериях был увеличен до 0,72±0,04. У 24 (27,9%) пациентов основной группы с ОЗМ, 11 (12,8%) пациентов без ОЗМ и 19 (22,9%) пациентов контрольной группы с ОЗМ и у 8 (9,6%) без ОЗМ было зафиксировано расширение вен простатического венозного сплетения более 5 см. Кровоток в венах был замедлен, причем у 2 пациентов основной группы с ОЗМ и у 1 пациента контрольной группы с ОЗМ кровоток вообще не определялся (табл. 1).
В результате исследования установлено, что морфометрические показатели циркулирующих тромбоцитов, определяемые экспресс-методом в режиме реального времени, служат объективными и информативными критериями оценки состояния клеточного звена гемостаза. В группе больных ДГПЖ доли тромбоцитов I, II, III и IV типов составили соответственно 40, 17, 15 и 28% (рис. 2).
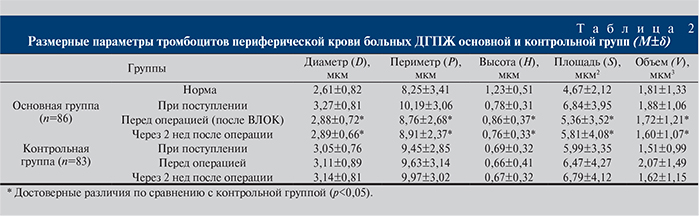
Анализ витальных размерных параметров фазовых портретов тромбоцитов показал, что при поступлении у всех пациентов средние в популяции диаметр, периметр, площадь и объем циркулирующих клеток превышали нормальные значения на 20, 18, 30 и 2% соответственно. Диаметр циркулирующих клеток при поступлении больных ДГПЖ обеих групп составил 3,20±0,81 мкм, периметр – 9,94±3,01 мкм, площадь – 6,56±3,77 мкм2, объем – 1,71±0,98 мкм3. Фазовая высота тромбоцитов, отражавшая состояние тромбоцитарного грануломера, была снижена на 42% и составила 0,71±0,31 мкм (р<0,05). Важно отметить, что фазовая высота позволяет оценивать полноценность гранулярного аппарата (реакция выброса активированного тромбоцита отражается снижением фазовой высоты клетки) (табл. 2).
После обследования пациентам выполнили оперативное лечение. Чреспузырная аденомэктомия выполнена 67 (39,6%) пациентам, из них 36 (21,3%) пациентам основной группы и 31 (18,3%) – контрольной, трансуретральная резекция простаты проведена 102 (60,4%) мужчинам, из них 50 (29,6%) – основной группы и 52 (30,8%) – контрольной.

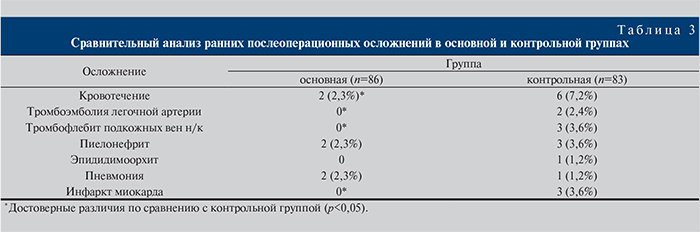
Послеоперационные осложнения были зарегистрированы у 25 (14,8%) из 169 больных, причем чаще – у прооперированных контрольной группы (р<0,05). В структуре ранних осложнений наиболее частыми были кровотечения (4,7%), тромботические (3%) и воспалительные (эпидидимоорхит, пиелонефрит [3,6%]) осложнения. В ближайшем послеоперационном периоде пиелонефрит наблюдался у 2 (2,3%) пациентов основной группы и у 3 (3,6%) – контрольной. Послеоперационное кровотечение в ближайшем послеоперационном периоде отмечено у 2 (2,3%) пациентов основной группы и у 6 (7,2%) – контрольной (р<0,05), во всех случаях его удалось ликвидировать консервативными мерами (табл. 3).
Следует подчеркнуть, что эти осложнения отмечались у пациентов с исходно высокими показателями скоростей кровотока в сосудах предстательной железы. Тромбоэмболия легочной артерии диагностирована у 2 (2,4%) пациентов контрольной группы, госпитализированных в реанимационное отделение.
В пред- и послеоперационном периодах нами были обнаружены определенные различия в динамике показателей коагулограммы у оперированных больных основной и контрольной групп. В послеоперационном периоде статистически значимые изменения (р<0,001) коснулись практически всех показателей коагулограммы. При этом у пациентов основной группы доминировали признаки сдвигов в сторону нормокоагуляции.
 Так, отмечена положительная динамика уровня фибриногена. При поступлении в основной группе уровень фибриногена составил 3,39±1,23 г/л, после ВЛОК – 2,96±0,93 г/л. В контрольной группе различий между уровнем фибриногена при поступлении и перед операцией не установлено (3,08±0,98 и 3,10±0,98 г/л). Исходный уровень МНО у пациентов основной группы составил 0,99±0,23, после ВЛОК – 1,03±0,20, через 2 нед – 1,05±0,19 (р<0,001). У пациентов контрольной группы исходный уровень МНО составил 1,03±0,21, перед операцией – 1,02±0,20.
Так, отмечена положительная динамика уровня фибриногена. При поступлении в основной группе уровень фибриногена составил 3,39±1,23 г/л, после ВЛОК – 2,96±0,93 г/л. В контрольной группе различий между уровнем фибриногена при поступлении и перед операцией не установлено (3,08±0,98 и 3,10±0,98 г/л). Исходный уровень МНО у пациентов основной группы составил 0,99±0,23, после ВЛОК – 1,03±0,20, через 2 нед – 1,05±0,19 (р<0,001). У пациентов контрольной группы исходный уровень МНО составил 1,03±0,21, перед операцией – 1,02±0,20.
К 7-м суткам отмечена тенденция к нормокоагуляции и повышение МНО до 1,07±0,17. Содержание РФМК у пациентов основной группы после курса ВЛОК снизилось с 4,09±0,64 до 3,77±0,21 мг/100 мл (р<0,001). В контрольной группе показатель РФМК при поступлении составил 3,96±0,61 мг/100мл, не претерпев существенных изменений в динамике предоперационного наблюдения. Показатель тромбинового времени при поступлении был снижен до 15,08±3,76 с, после проведения ВЛОК несколько вырос – до 16,61±2,81 с (р<0,001). Таким образом, результаты исследования коагулограммы позволяют говорить о позитивном влиянии ВЛОК, что проявлялось в сохранении устойчивой тенденции сдвигов показателей гемокоагуляции в сторону нормокоагуляции.
Таким образом, исследования динамики коагулограмм показали, что наиболее резкие изменения в системе гемостаза гиперкоагуляционного характера наступили на 3–4-е сутки после операции. На 7–8-е сутки послеоперационного периода активность коагулирующей системы крови снижается, а потенциал противосвертывающей и фибринолитической активности повышается. В результате проведенной предоперационной подготовки у больных основной группы отмечены предупреждения развития гиперкоагуляционных расстройств.
При оценке кровотока в сосудах простаты после ВЛОК нами отмечено снижение среднего показателя Vmax в капсулярных артериях у пациентов без ОЗМ до 10,35±3,57 см/с, с ОЗМ – до 12,85±4,87 см/с, в парауретральных артериях у пациентов основной группы без ОЗМ в 2 раза – с 12,44±4,38 до 6,54±2,19 см/с, в группе пациентов с ОЗМ – с 14,81±5,55 до 8,99±3,84 см/с.
Отмечено снижение среднего показателя Vmin в капсулярных артериях в 1,5 раза у пациентов без ОЗМ до 4,02±1,45 см/с, с ОЗМ до 3,37±0,75 см/с. В контрольной группе данные показатели оставались высокими. Однако в группе пациентов с ОЗМ отмечено некоторое снижение данных показателей после установки уретрального катетера, что связано с уменьшением отека на фоне восстановления пассажа мочи (табл. 4).
RI в капсулярных артериях больных без ОЗМ основной группы после курса ВЛОК уменьшился в 1,5 раза и составил 0,61±0,04, в парауретральных артериях больных без ОЗМ снизился с 0,72±0,05 до 0,66±0,06, у пациентов с ОЗМ – с 0,73±0,06 до 0,67±0,05. В контрольной группе данный показатель больных без ОЗМ и с ОЗМ составил – 0,70 (0,042) и 0,68 (0,043) соответственно (р=0,00034 – выявлено статистически значимое различие). У пациентов основной группы без ОЗМ и с ОЗМ отмечено снижение среднего значения диаметра вен парапростатической клетчатки до 3,38 (0,81) и 4,62 (0,75) соответственно (до лечения 5,01 [0,88] и 5,11[0,74]) и повышение среднего значения скорости кровотока до 3,66 (0,44) и 3,55 (0,37) соответственно.

Анализ витальных размерных параметров фазовых портретов тромбоцитов продемонстрировал, что у пациентов основной группы, которым в предоперационном периоде проводили ВЛОК, средние в популяции диаметр, периметр, объем и площадь циркулирующих клеток снизились на 12, 14, 9 и 22% соответственно, фазовая высота увеличилась на 10%, что указывает на нормализацию морфофункционального состояния клеток. При оценке тромбоцитов периферической крови пациентов основной группы перед операцией зарегистрировано снижение количества активных тромбоцитов в циркулирующей популяции и повышение содержания тромбоцитов I типа (клеток «покоя»). Это свидетельствует о подавлении агрегационной и адгезивной способности тромбоцитов (рис. 3).
У пациентов основной группы после проведения ВЛОК диаметр тромбоцитов снизился с 3,27±0,81 до 2,88±0,72 мкм и сохранялся на том же уровне через 2 нед после операции (2,89±0,66 мкм). В контрольной группе мы наблюдали повышение диаметра тромбоцитов после оперативного лечения до 3,14±0,81 мкм, в то время как при поступлении и перед операцией данный показатель составил 3,05±0,76 и 3,11±0,89 мкм соответственно. Также нами отмечена положительная динамика периметра тромбоцитов в основной группе. При поступлении данный показатель составил 10,19±3,06 мкм, а после проведения сеансов ВЛОК – 8,76±2,68 мкм, а через 2 нед после операции – 8,91±2,37 мкм. У пациентов контрольной группы периметр был больше нормы в среднем на 14% и перед операцией составил 9,63±3,14 мкм, после операции наблюдалась отрицательная динамика и увеличение этого показателя до 9,97±3,02 мкм.
При анализе площади тромбоцитов у пациентов основной группы после курса ВЛОК нами отмечено снижение этого показателя с 6,84±3,95 до 5,36±3,52 мкм2, после операции данный показатель составил 5,81±4,08 мкм2 (табл. 5).
При оценке динамики высоты, показателя, отражающего оптическую плотность внутриклеточного вещества тромбоцита, нами установлено достоверное увеличение его после проведения курса ВЛОК пациентам основной группы с 0,78±0,31 до 0,86±0,37 мкм.
В контрольной группе данный показатель находился при поступлении, перед и после операции достоверно не отличался – 0,69±0,32 мкм, 0,66±0,41 и 0,67±0,32 мкм соответственно.
Заключение. Комплексная предоперационная подготовка должна включать спектр диагностических и лечебных мероприятий, проведение которых целесообразно начинать уже с момента поступления больного в стационар. Любое послеоперационное осложнение служит результатом реализации цепи взаимосвязанных патологических процессов. Важными этапами являются полноценная диагностика и предоперационная подготовка, определение возможных рисков и вероятности развития осложнений. Анализ результатов исследования демонстрирует факт поддержания нормокоагуляции в течение 2 нед послеоперационного периода, улучшения показателей кровотока в сосудах предстательной железы на фоне ВЛОК. Полученные результаты свидетельствуют о возможности включения методики ВЛОК в комплекс предоперационной подготовки на этапах хирургического лечения ДГПЖ, а также у пациентов с ОЗМ на фоне дренирования мочевого пузыря. Комплексная предоперационная подготовка способствует улучшению результатов оперативного лечения пациентов с ДГПЖ за счет снижения тромбогеморрагических осложнений. Перспективой дальнейшей разработки темы сужит изучение взаимодействия свертывающей и противосвертывающей систем у пациентов старческого возраста с доброкачественной гиперплазией предстательной железы в зависимости от сопутствующих заболеваний.



