Введение. Опухоли яичка являются наиболее частой формой солидного рака у молодых мужчин. Примерно 95% случаев тестикулярного рака представлено герминогенными опухолями яичка (ГОЯ), среди которых выделяют семиномный и несеминомный герминогенный тестикулярный рак. Семиномы обычно проявляются в возрасте примерно 35 лет, средний возраст манифестации несемином – 25 лет. В течение последних двух десятилетий в мире показан 70%-ный рост заболеваемости этим типом рака [1]. Хотя семиномы и несеминомы, возникающие в молодом возрасте, имеют повышенный метастатический потенциал, они отличаются чувствительностью к комбинированной химиотерапии, в том числе к цисплатину, и лучевому лечению, поэтому на их долю приходится только 70 смертей в год в Великобритании и 350 – в США [2]. Однако у таких пациентов могут возникать побочные эффекты системного противоопухолевого лечения, такие как хроническая усталость, сердечно-сосудистые заболевания, метаболический синдром, бесплодие и даже развитие вторичной опухоли [3]. В связи с этим ранняя диагностика и проведение эффективного лечения имеют первостепенное значение.
К сожалению, ранняя диагностика ГОЯ затруднена из-за отсутствия симптомов и информативных скрининговых маркеров. В настоящее время в качестве эффективного метода диагностики выступает биопсия семенников с последующим морфологическим и иммуногистохимическим анализами [4].
Источником ГОЯ служат эмбриональные клетки различной степени дифференцировки; появление опухолей этого типа напрямую связано с формированием пула мужских половых клеток и гаметогенезом.
Существует гипотеза, согласно которой формирование ГОЯ начинается в раннем эмбриогенезе, является составной частью синдрома тестикулярной дисгенезии (СТД) [5]. Эта гипотеза предполагает, что крипторхизм, микролитиаз, гипоспадия, проблемы сперматогенеза и ГОЯ являются проявлением нарушения развития яичек во время раннего эмбриогенеза. В результате этих нарушений происходит блокирование процесса дифференцировки некоторых первичных половых клеток (ППК)/гоноцитов, в результате чего эти зародышевые клетки сохраняют свой эмбриональный профиль во взрослом организме [6]. Причина этого блока развития пока не известна, но существует предположение, будто это обусловлено сочетанием генетических и эпигенетических факторов, а также влиянием факторов окружающей среды [7].
Роль генетических факторов в развитии ГОЯ подтверждается существованием семейного накопления и наследственных форм ГОЯ. Примерно 1,4% всех ГОЯ имеют семейный анамнез, у сыновей и братьев больных риск развития опухолей повышается более чем в 10 раз [8].
В результате проведенных полногеномных ассоциативных исследований идентифицированы гены, которые участвуют в эмбриональном развитии ткани яичек и сперматогенезе, ассоциированные с развитием ГОЯ. Состояние некоторых однонуклеотидных полиморфизмов этих генов связано с развитием СТД и приводит к значительному повышению риска развития ГОЯ [9].
Цель исследования: определить роль генетических факторов у пациентов с ГОЯ.
Материалы и методы. Исследование проведено на ДНК, полученной из лимфоцитов периферической крови 73 пациентов с ГОЯ (34 семиномы, 39 несеминомы) и 97 фертильных мужчин в возрасте 25–45 лет (контроль). Генотипирование пациентов по полиморфизмам генов KITLG (rs995030, rs1508595), SPRY4 (rs4624820, rs6897876) и BAK1 (rs210138) проводили методом ПЦР-ПДРФ [10].
Статистическую обработку результатов выполняли с использованием программы Prism 6 (GraphPad Prism version 6.0). Сопоставляли частоту встречаемости полиморфных аллельных вариантов и генотипов исследуемых генов в группе пациентов с ГОЯ и в группе контроля. Тест на соответствие выборки равновесию Харди–Вайнберга проводили с использованием метода χ2 (α=0,05, df=1), анализ ассоциаций – путем расчета показателя отношения шансов (OR – odds ratio) с 95% доверительным интервалом (95% CI). Ассоциацию заболевания и аллельного варианта (генотипа) определяли с помощью точного двустороннего критерия Фишера (F), критерия χ2 (c коррекцией Йейтса на непрерывность выборки), df=2 (общая модель наследования) либо критерия Манна–Уитни (MWt), сравнивая распределение генотипов и аллелей по каждому полиморфизму.
Сравнение частот встречаемости сочетаний генотипов проводили с использованием точного двустороннего критерия Фишера. Для всех использованных критериев статистически значимыми считали различия при р≤0,05.
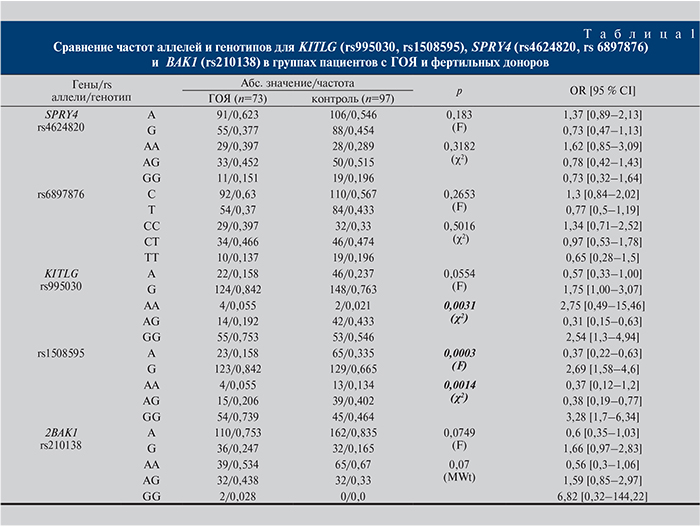
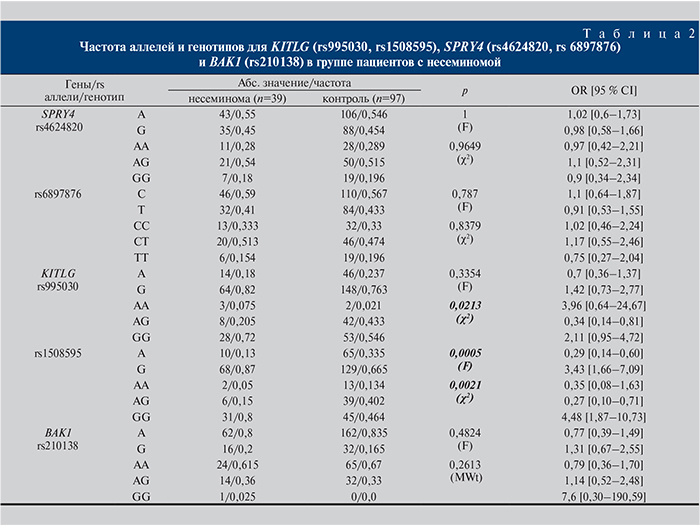
Результаты. Результаты определения частот аллелей и генотипов KITLG (rs995030, rs1508595), SPRY4 (rs4624820, rs6897876) и BAK1 (rs210138) представлены в табл. 1–4.
Статистически значимая ассоциация с развитием ГОЯ выявлена для rs1508595 гена KITLG (р=0,0003 для аллеля G, р=0,0014 для генотипа GG), для rs995030 (р=0,0031 для генотипа GG; см. табл. 1). При сравнении частот аллелей и генотипов других генов мы не выявили статистически значимых различий между группами ГОЯ и контроля.

При сравнении пациентов с семиномой и фертильных мужчин группы контроля статистически значимые различия выявлены для SPRY4 rs4624820 (р=0,0226 для A и р=0,04 для AA), для KITLG rs995030 (р=0,0375 для G и р=0,0282 для GG), для KITLG rs1508595 (р=0,0306 для G), для BAK1 rs210138 (р=0,0329 для G и р=0,0219 для GG).
При сравнении пациентов с несеминомным раком и фертильных мужчин статистически значимые различия установлены только для гена KITLG rs1508595 (р=0,0005 для G и р=0,0021 для GG).
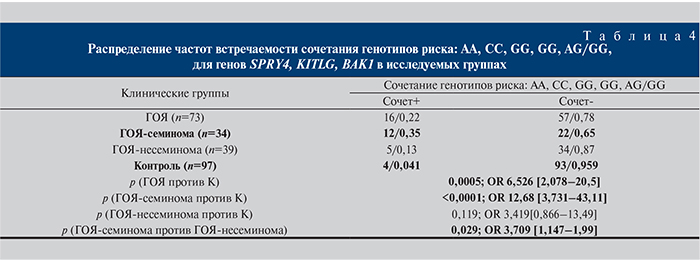
Сравнение частот аллелей и генотипов исследуемых генов у пациентов с семиномой и несеминомным раком не выявило статистически значимых различий. Однако мы определили статистически значимые различия этих групп при исследовании сочетания генотипов по трем генам (р=0,029; OR= 3,709 [1,147–11,99]).
Генотипы AA для SPRY4 (rs4624820), CC для SPRY4 (rs6897876), GG для KITLG (rs995030), GG для KITLG (rs1508595) и GG для BAK1 (rs210138) по результатам полногеномного исследования ассоциаций и по полученным нами данным связаны с высоким риском развития ГОЯ [9]. При анализе BAK1 (rs210138) в наших выборках генотип GG удалось выявить только у двух пациентов с ГОЯ, поэтому в качестве генотипа высокого риска мы рассматривали генотипы GG и AG.
Нами показано, что сочетание генотипов по трем генам повышает риск развития ГОЯ в 6,5 раз (p=0,0005; OR=6,526 [2,078–20,5]), а риск развития семиномы – более чем в 12 раз (p<0,0001; OR=12,68 [3,731–43,11]).
Обсуждение. Известно, что для развития ГОЯ необходимо сочетание определенных генетических факторов, полученных от родителей, а также внешних и внутренних средовых факторов. Даже при семейных формах ГОЯ наследственные мутации в генах, которые могут определять их развитие, довольно редки. При обследовании семей с наследственными формами ГОЯ в нескольких случаях были выявлены полиморфные варианты гена PDE11A (2q31.2), наличие которых обусловливает отсутствие экспрессии этого белка в ткани яичек у носителей и может являться причиной семейных опухолей [8]. В связи с этим при развитии ГОЯ в качестве генетических причин могут выступать аллельные состояния генов, характеризующиеся определенными полиморфными вариантами ДНК (SNPs).
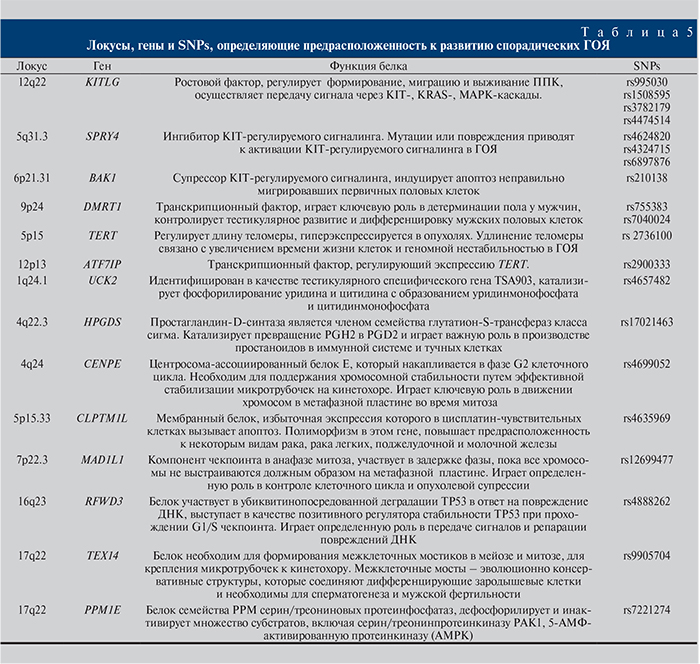
В табл. 5 представлены сведения о 14 генах, ассоциированных с развитием ГОЯ [9, 11,12,13], выявленных в ходе исследований полногеномных ассоциаций (GWAS).
Как видно из табл. 5, одни из этих генов имеют отношение к эмбриональному развитию тестикулярной ткани и сперматогенезу, другие – участвуют в процессе опухолеобразования, некоторые гены служат необходимым звеном в регуляции митотического и мейотического клеточного деления. Аллельные состояния этих генов являются генетическими факторами, которые могут влиять на формирование гонад в эмбриональном периоде их развития.
В нашем исследовании мы изучали гены KITLG, SPRY4 и BAK1, которые участвуют в дифференцировке, миграции и выживании ППК, и подтвердили их значение в развитии ГОЯ и особенно семиномы.
В настоящее время принята модель развития ГОЯ, учитывающая действие генетических и различных этиологических факторов, участвующих в процессе формирования опухоли яичка [7]. В качестве внешних факторов и факторов микроокружения, связанных с риском развития опухоли, рассматриваются три большие группы. Одна группа связана с состоянием материнского организма в процессе беременности, пренатальные факторы, к которым относятся гипертензия у матери, преэклампсия, курение в период беременности. Ко второй группе относят перинатальные факторы, такие как крипторхизм, гипоспадия, низкая или, напротив, высокая масса плода при рождении. В третью группу включены постнатальные факторы, связанные с образом жизни: позднее начало пубертатного периода, бесплодие, работа на вредных предприятиях, влияние хлорсодержащих соединений.
Все эти факторы в сочетании с генетическими и эпигенетическими составляющими могут приводить к нарушению формирования тестикулярной ткани, дифференцировки, миграции и выживания половых клеток. Из половых клеток с нарушенным нормальным развитием формируются районы внутриканальцевой герминогенно-клеточной неоплазии, в которых накопление соматических повреждений в генах, ассоциированных с канцерогенезом, приводит к формированию carcinoma in situ. Для развития ГОЯ большое значение имеют последующие соматические нарушения таких генов, как KRAS, BRAF, KIT и др., или хромосомных перестроек, особенно часто в опухолевом материале выявляют изменения 12-й хромосомы. Дополнительный материал 12р появляется в результате перестройки или амплификации небольшого района короткого плеча 12-й хромосомы. В этом районе расположены гены, участвующие в канцерогенезе, экспрессия которых усиливается в результате увеличения дозы генов, связанной с появлением дополнительного хромосомного материала. С одной стороны, это гены KRAS и циклин D2 (CCND2), связанные со злокачественной трансформацией и пролиферацией клеток. С другой стороны, это расположенные в данном районе гены STELLA, NANOG, EDR1, GDF3, связанные с поддержанием стволового потенциала клеток и их плюрипотентных свойств [14]. В результате накопления определенного спектра молекулярно-генетических изменений неоплазия трансформируется в карциному, обусловливая появление герминогенно-клеточных опухолей [15].
Нами показано, что определенные аллели SPRY4 (rs4624820), KITLG (rs995030, rs1508595) и BAK1 (rs210138) статистически значимо ассоциированы с развитием семиномы, а при их сочетании риск развития семиномы повышается более чем в 12 раз.
А. Ferlin и соавт. при исследовании аллельных вариантов одного гена KITLG (rs995030 и rs4471514) в семиномах и несеминомах получил подобные результаты [16]. Кроме того, мы выявили статистически значимые различия в частотах сочетания аллелей высокого риска в семиномах и несеминомах (p=0,029; OR 3,709 [1,147–11,99]), что позволяет предположить различный вклад исследуемых генов в патогенез этих типов ГОЯ. Предшественниками для семиномы служат недифференцированные первичные половые клетки (ППК), для несеминомы – ППК с большей степенью дифференцировки (в случае эмбриональной карциномы), эмбриональные клетки разной степени дифференцировки (в случае тератомы) или экстраэмбриональные клетки (в случае хориокарциномы из желточного мешка). Возможно, аллельное состояние исследуемых нами генов KITLG , SPRY4 и BAK1 играет большую роль на самых ранних этапах дифференцировки ППК, а при развитии несеминомы в более дифференцированных клетках важную роль начинают играть другие гены.
Заключение. Исследование генетических факторов, ассоциированных с развитием ГОЯ, позволяет понять молекулярный патогенез опухоли, выявить его значимые этапы. начать разработку новых подходов к диагностике и лечению. Хотя определение генотипов высокого риска у нормальных индивидуумов не является однозначным показателем развития ГОЯ, генотипирование пациентов, имеющих клинические проявление СТД, такие как крипторхизм, микролитиаз яичка, бесплодие, обусловленное генетическими факторами, позволяет выявлять и осуществлять мониторинг пациентов, у которых риск развития ГОЯ значительно повышен. Для некоторых из этих состояний существует лечение, которое необходимо провести до пубертатного периода, чтобы снизить риск. Например, раннее оперативное лечение крипторхизма позволяет снижать риск бесплодия и развитие ГОЯ. Комплексное генетическое исследование генотипов, ассоциированных с ГОЯ у пациентов из клинических групп, может служить дополнительным критерием при формировании групп риска, их мониторинга и разработки подходов к семейному консультированию и лечению, что является основой предсказательной медицины.



