Введение. В последние годы отмечается устойчивый рост заболеваемости раком почки. У 60–70% больных диагностируют локализованную форму заболевания [1–6]. Локализованный рак почки стадии T1 и T2 все чаще становится показанием к резекции почки [3, 7–11].
Открытая резекция почки при опухолях размером менее 4 см в настоящее время является общепризнанным стандартом оперативного лечения и по мере совершенствования лапароскопической технологии все чаще выполняется лапароскопическим доступом [3]. Из современных методик хирургического лечения опухолей почки, включающих радикальную нефрэктомию, резекцию почки, радиочастотную абляцию, органосохраняющие операции предпочтительны ввиду высокого риска развития острого снижения почечной функции в 25,8% случаев и последующим возникновением хронической почечной недостаточности у 40,8% больных, перенесших радикальную нефрэктомию [12].
 Резекция почки, выполненная как из лапароскопического, так и из открытого доступа, осуществима только при условии адекватного гемостаза в операционной ране для визуального контроля за хирургическим краем. Предотвращение кровотечения, как правило, достигается путем выделения сосудистой ножки с последующим пережатием en-block или изолированным выделением и пережатием почечной артерии или ее сегментов. Мобилизация отдельных сегментов почечной артерии – трудоемкий и кропотливый процесс, во многом зависящий от анатомических особенностей и не всегда позволяющий добиваться ожидаемого результата. Полное выключение почечного кровотока пережатием почечной артерии или всей сосудистой ножки чревато ишемическими повреждениями почечной паренхимы, несмотря на стремление к минимизации времени тепловой ишемии [13, 14].
Резекция почки, выполненная как из лапароскопического, так и из открытого доступа, осуществима только при условии адекватного гемостаза в операционной ране для визуального контроля за хирургическим краем. Предотвращение кровотечения, как правило, достигается путем выделения сосудистой ножки с последующим пережатием en-block или изолированным выделением и пережатием почечной артерии или ее сегментов. Мобилизация отдельных сегментов почечной артерии – трудоемкий и кропотливый процесс, во многом зависящий от анатомических особенностей и не всегда позволяющий добиваться ожидаемого результата. Полное выключение почечного кровотока пережатием почечной артерии или всей сосудистой ножки чревато ишемическими повреждениями почечной паренхимы, несмотря на стремление к минимизации времени тепловой ишемии [13, 14].
Предложен ряд способов резекции почки без тепловой ишемии. Один из них – проведение операции в условиях пониженного до 65 мм рт.ст. артериального давления, что позволяет выполнять резекцию почки без пережатия почечных сосудов с минимальной геморрагией [15]. При этом закономерна гипоперфузия жизненно важных органов, что делает этот метод небезопасным. Ряд авторов [16] предлагает беззажимный метод резекции почки, который неизменно сопровождается обильным кровотечением из раны паренхимы почки, ухудшающим визуальный контроль за краем резекции. Также предложена методика селективного выделения и клипирования артерий третьего или четвертого порядка, питающих опухоль [17]. Такие операции сопряжены со значительными техническими трудностями, возникающими при выделении сегментарных артерий, и зачастую невыполнимы из-за анатомических особенностей строения почки и ее сосудов. Предложена методика наложения гемостатического зажима на паренхиму почки [18], использование которого удобно лишь при определенных полярных расположениях опухолей.
 Ching-Chia Li и соавт. [19] предложили методику постоянной эмболизации почечной артерии для профилактики кровотечения при резекции почки. G. Simone и соавт. [20] представили 7-летний опыт лапароскопических резекций почек с суперселективной трансартериальной эмболизацией и пришли к выводу, что рентген-хирургическое пособие не допускает снижения функции почек до критического уровня и значительно упрощает выполнение лапароскопической резекции почек, обеспечивает превосходный контроль за опасными кровотечениями.
Ching-Chia Li и соавт. [19] предложили методику постоянной эмболизации почечной артерии для профилактики кровотечения при резекции почки. G. Simone и соавт. [20] представили 7-летний опыт лапароскопических резекций почек с суперселективной трансартериальной эмболизацией и пришли к выводу, что рентген-хирургическое пособие не допускает снижения функции почек до критического уровня и значительно упрощает выполнение лапароскопической резекции почек, обеспечивает превосходный контроль за опасными кровотечениями.
Используя эмболизирующие агенты в виде спиралей, микрогранул и других материалов, можно добиться надежного гемостаза в зоне оперативного интереса, но объем некротизированной паренхимы в этом случае будет несколько больше, чем требуется. Так, в работе L. D’Urso и соавт. [21] из 23 суперселективных трансартериальных эмболизаций в 3 случаях получили объем ишемизированной области больше, чем требовалось.
Целью исследования было применить методику суперселективной баллонной эмболизации сегментарных ветвей почечной артерии для интраоперационного гемостаза при резекции почки, пораженной новообразованием.
Материалы и методы. Лапароскопическая резекция почки с суперселективной баллонной эмболизацией за период с октября 2015 по сентябрь 2016 г. выполнена 11 пациентам. Средний возраст прооперированных составил 56,8 (от 29 до 72) года среди них 3 мужчин и 8 женщин.
В 5 наблюдениях опухоль локализовалась справа, в 6 – слева; в 7 случах был поражен нижний сегмент, в 1 – верхний, в 3 – средний. Размер новообразования варьировался от 0,9 до 3,8 см, составив в среднем 1,9 см. Всем больным в предоперационном периоде выполнены рутинные исследования: УЗИ мочевыделительной системы, мультиспиральная компьютерная томография (МСКТ) с контрастным усилением, реносцинтиграфическое исследование, раздельная оценка почечной функции. Степень сложности предполагаемой резекции почки оценивали по шкале R.E.N.A.L. на основании данных МСКТ – оценка в среднем составила 5,1 балла, что соответствует легкой степени резектабельности опухоли.
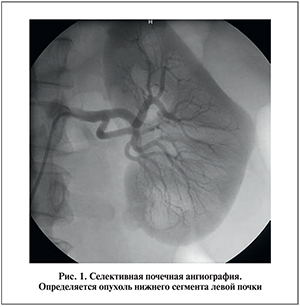
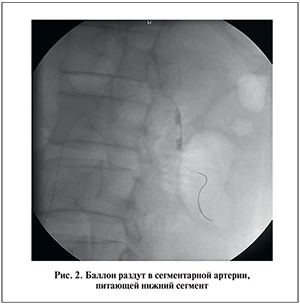
Методика лапароскопической резекции почки с суперселективной баллонной эмболизацией. Проводили стандартную предоперационную подготовку. Непосредственно перед операцией в условиях рентгеноперационной выполняли селективную почечную ангиографию (рис. 1). В бедренную артерию устанавливали гайд-катетер (мы обычно использовали стандартный катетер JR4.0). Выполняли селективную почечную ангиографию по стандартной методике. Оценивали архитектонику почечных сосудов, локализацию и размер патологического образования. Определяли артерии, питающие сегмент паренхимы, несущей опухоль. Диаметр сегментарных или долевых артерий измеряли для точного подбора размера окклюзирующего баллона и его конфигурации. Затем в выбранную сегментарную артерию заводили микропроводник, по которому устанавливали эндоваскулярный баллон и раздували введением контрастного вещества (рис. 2). Для эмболизации мы применяли эндоваскулярные баллон-катетеры, используемые для коронарной баллонной ангиопластики с баллонами продолговатой и округлой форм, диаметром 1,25–3,5 мм и длиной 10–20 мм.
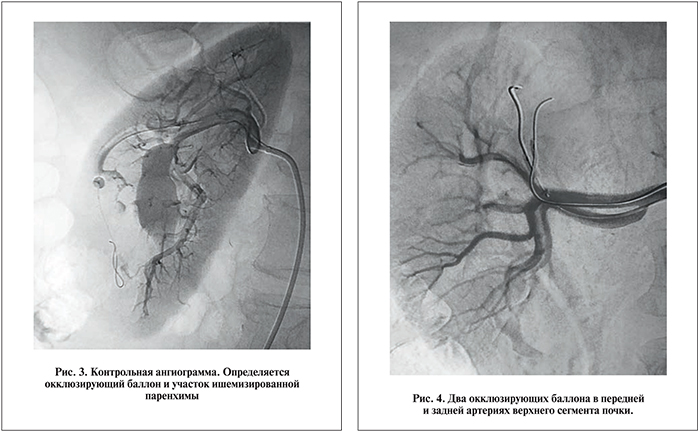
 В ряде случаев предпочтительнее использование баллонов шаровидной формы ввиду особенностей архитектоники сосудистого русла – нередко отсутствие прямого участка артерии, куда невозможно или затруднительно установить продолговатый баллона. Далее установленный в необходимом месте баллон раздували под рентгеноскопическим контролем под давлением от 8 до 20 атмосфер. Выполняли контроль расширенного баллона в сегментарной артерии почки. При контрольной ангиографии оценивали качество эмболизации и объем ишемизированной паренхимы (рис. 3). В случае сложного кровоснабжения интересующего участка паренхимы проводили суперселективную эмболизацию нескольких питающих артерий (рис. 4). Мы использовали этот прием в отношении 2 пациентов с верхне- и нижнесегментарной локализацией образований, питающихся за счет передних и задних ветвей сегментарных артерий. После завершения рентгенхирургического этапа больного немедленно переводили в эндохирургическую операционную, оснащенную стандартным лапароскопическим оборудованием для 2-го этапа операции.
В ряде случаев предпочтительнее использование баллонов шаровидной формы ввиду особенностей архитектоники сосудистого русла – нередко отсутствие прямого участка артерии, куда невозможно или затруднительно установить продолговатый баллона. Далее установленный в необходимом месте баллон раздували под рентгеноскопическим контролем под давлением от 8 до 20 атмосфер. Выполняли контроль расширенного баллона в сегментарной артерии почки. При контрольной ангиографии оценивали качество эмболизации и объем ишемизированной паренхимы (рис. 3). В случае сложного кровоснабжения интересующего участка паренхимы проводили суперселективную эмболизацию нескольких питающих артерий (рис. 4). Мы использовали этот прием в отношении 2 пациентов с верхне- и нижнесегментарной локализацией образований, питающихся за счет передних и задних ветвей сегментарных артерий. После завершения рентгенхирургического этапа больного немедленно переводили в эндохирургическую операционную, оснащенную стандартным лапароскопическим оборудованием для 2-го этапа операции.
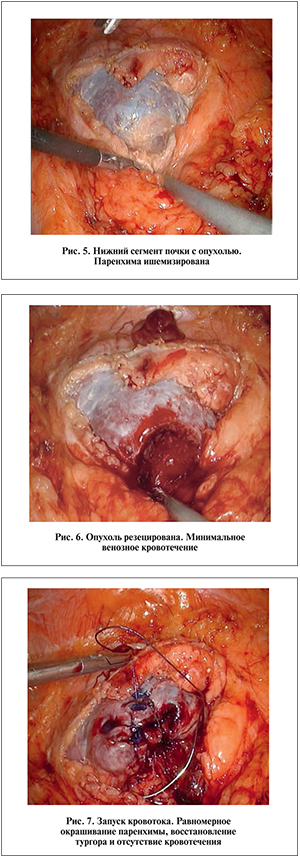
Под эндотрахеальным наркозом иглой Вереша ниже пупка формировали карбоксиперитонеум до 12 мм рт.ст., выше пупка параректально на стороне поражения устанавливали троакар 10 мм для оптики, в подвздошной области –троакар 12 мм, в подреберье и параректально ниже пупка –троакары 5 мм для манипуляторов. Поворачивали пациента на бок. Вскрывали брюшину по линии Тольда, выполняли стандартный трансперитонеальный доступ к поверхности почки (рис. 5). Выделяли участок поверхности почки с опухолью и ножницами осуществляли резекцию образования, отступя на 5 мм от края последней. Незначительное венозное кровотечение из почечной паренхимы аспирировали электроотсосом (рис. 6).
После резекции патологического образования на края паренхимы накладывали непрерывные стягивающие швы с дополнительной фиксацией лигатур клипсами. Кровоток запускали немедленно после наложения гемостатических швов на паренхиму путем стравливания окклюзирующего баллона под эндовизуальным контролем. При этом оценивали равномерность кровонаполнения ишемизированных участков, наличие геморрагий, тургор паренхимы (рис. 7). При необходимости накладывали дополнительные гемостатические швы на паренхиму почки. Операцию заканчивали дренированием паранефрального пространства силиконовым дренажом, заведенным через троакар 12 мм на 2–3 дня.
Пациентов активизировали на 3-и сутки, при этом в раннем послеоперационном периоде требовалась минимальная консервативная терапия: анальгетики, гемостатики, антибиотикопрофилактика, стандартная для лапароскопических вмешательств на органах забрюшинного пространства.
Результаты и обсуждение. По результатам послеоперационного гитологического исследования у 4 пациентов диагностирован светлоклеточный вариант почечно-клеточного рака, у 3 – папиллярный, у 3 – ангиомиолипома, у 1 – лимфангиома.
Селективная почечная ангиография, выполненная непосредственно перед операцией при участии оперирующего уролога, не представляет трудностей для подготовленной рентгенхирургической бригады, дает дополнительную информацию о размере и локализации образования, наличии дополнительных почечных сосудов. Кроме того, уролог имеет возможность выбрать сегментарные или долевые артерии для последующей эмболизации для получения минимально требуемой ишемии почки, достаточной для бескровной ее резекции.
На цифровых ангиограммах с высоким разрешением можно измерить точный диаметр интересующего сосуда, его протяженность для подбора оптимального размера и формы окклюзирующего баллона (шаровидный или продолговатый). В своей работе мы использовали стандартные баллонные обтураторы, применяемые для коронарной баллонной ангиопластики, диаметром от 1,25 до 3,5 мм. При контрольном контрастировании почечных сосудов четко визуализируется ишемизированный сегмент почечной паренхимы, тогда как кровоснабжение остальной части почки при этом совершенно не страдает. Рентгенхирургический этап в среднем занимал 55 (от 30 до 65) мин. Пациенты никакого субьективного дискомфорта при проведении данной процедуры не испытывали, показатели гемодинамики были стабильными на протяжении всей манипуляции.
Лапароскопический этап методики отличался меньшей трудоемкостью, так как не было необходимости в выделении сосудистой ножки почки. Обнажение из прилегающей паранефральной клетчатки участка поверхности почки с образованием никаких технических трудностей не представляло. При крупных опухолях размером более 3 см в 2 случаях мы использовали мануально-ассистированную методику лапароскопической резекции. В паранефральной клетчатке, прилежащей к зоне оперативного интереса, отмечен небольшой стекловидный отека, характерный для ишемических нарушений. Поверхность почки вокруг опухоли имела темный цвет вследствие прекращения артериального кровотока с отчетливой демаркационной линией. Резекцию с отступом на 5 мм от края опухоли осуществляли под визуальным контролем, используя лапароскопические ножницы, зону незначительного венозного кровотечения осушивали вакуум-аспиратором или марлевыми турундами, получая полный контроль за краем резекции. Ни в одном случае не было вскрытия просвета коллекторной системы почек ввиду кортикального расположения опухоли и небольших размеров, что подтверждает степень сложности по шкале R.E.N.A.L. Результаты контрольного экспресс-гистологического исследования хирургического края подтверждали радикальность резекции почки – ни в одном случае край резекции не содержал атипичных клеток. На края раны почки накладывали стягивающие паренхиму швы нитью V-Lock 3/0 на атравматической игле с кривизной ½ с дополнительной фиксацией швов биодеградируемыми клипсами Hem-o-lock small.
После ушивания раны почки осуществляли запуск кровотока путем стравливания баллона открытием клапана. Видеоэндоскопический контроль за этой процедурой позволяет удостовериться в надежности гемостаза раны паренхимы, оценить качество кровоснабжения ишемизированного очага, а кроме того, при необходимости, наложить дополнительные гемостатические швы. Однако в наших наблюдениях такой необходимости не возникло. Средний обьем кровопотери составил 50 мл. Продолжительность лапароскопического этапа сократилась со 150 до 60 мин, в среднем составив 104,3 мин. В целом на весь процесс хирургического лечения – от начала селективной почечной ангиографии до ушивания лапароскопических ран уходило в среднем 168,5 мин. Среднее время ишемии почечной паренхимы составило 112,5 (от 90 до 150) мин, что связано с выполнением разных этапов операции в разных операционных. Учитывая суперселективность эмболизации, ишемическим изменениям подвергался минимальный участок паренхимы, окружавший опухоль. Использование гибридной операционной, безусловно, сократит время, затрачиваемое на всю операцию в целом, и самое главное – уменьшит продолжительность тепловой ишемии, в идеале сведя к минимуму повреждение почечной паренхимы за счет окклюзионного прекращения кровотока непосредственно перед этапом резекции образования. Использование окклюзирующего баллона, в отличие от постоянной эмболизации микрогранулами, спиралями или иными эмболизирующими агентами, позволяет минимизировать ишемическое повреждение интактной паренхимы вокруг резецированной опухоли, вместе с тем предоставляя совершенно сухое поле края резекции для полноценного контроля.
В послеоперационном периоде всем больным выполнено контрольное УЗИ почек на 3–4-е сутки. Оценивали размеры почек, толщину паренхимы, состояние чашечно-лоханочной системы и наличие патологических образований в паранефральном пространстве. Во всех случаях констатировали отсутствие патологических образований в паранефральном пространстве, неизменность чашечно-лоханочной системы и размеров почек.
Заключение. Предлагаемая методика суперселективной баллонной эмболизации ветвей почечной артерии позволяет достигать временной ишемии не всего органа, а непосредственно того сегмента почечной паренхимы, в котором расположено опухолевидное образование. При этом функциональное состояние интактной паренхимы не страдает, рентгенконтролируемая эндоваскулярная окклюзия сегментарной или долевой артерии надежно перекрывает кровоток, не допуская массивного неконтролируемого кровотечения. Сохранение кровотока интактной паренхимы служит важным фактором предотвращения острого повреждения почек при выполнении органосохраняющих операций. Отсутствие необходимости выделения сосудов почки для последующего их пережатия позволяет выполнять лапароскопическую резекцию почки эндохирургам среднего уровня, не прибегая к помощи высококлассных специалистов экспертного класса.



