Введение. Почечно-клеточный рак регистрируют с частотой 3% в общей популяции населения и у 4,6% больных после пересадки почки, при этом заболевание развивается преимущественно в собственных почках и лишь 10% случаев приходится на рак в трансплантированной почке (ТП) [1]. Так, в Университетском госпитале Святого Луи в Париже из 2050 больных, которым выполнена трансплантация почки с 2002 по 2006 г., рак в ТП диагностирован у 7 (0,34%) пациентов [2]. Срок от пересадки почки до обнаружения опухоли в ТП варьируется от 9 мес до 29 лет [3, 4]. Опухоли в ТП могут быть «донорскими», метастатическими от реципиента (например, лимфома) образованиями de novo. Считается, что рак, развившийся в ТП, менее агрессивный, чем развившийся в собственных почках [5].
Исторически сложилось, что трансплантатэктомия является методом выбора в хирургическом лечении больных с опухолью в ТП, что связано с высоким риском прогрессирования заболевания на фоне иммуносупрессивной терапии, при этом смертность в популяции пациентов, возвратившихся на диализ после потери функции трансплантата, статистически значимо выше [6].
 В последнее десятилетие появляется все больше публикаций, демонстрирующих эффективность органсохраняющего лечения при локализованной форме рака Т1–Т2 у больных ТП. Наиболее обширное исследование, включившее 43 пациента, провели X. Tillou и соавт. в 2014 г. Этим больным выполнена открытая резекция ТП по поводу образования менее 4 см в диаметре. В течение периода наблюдения (в среднем 35 мес) после операции 41 респондент имел удовлетворительную функцию ТП, не было данных за рецидив или прогрессирование рака [5].
В последнее десятилетие появляется все больше публикаций, демонстрирующих эффективность органсохраняющего лечения при локализованной форме рака Т1–Т2 у больных ТП. Наиболее обширное исследование, включившее 43 пациента, провели X. Tillou и соавт. в 2014 г. Этим больным выполнена открытая резекция ТП по поводу образования менее 4 см в диаметре. В течение периода наблюдения (в среднем 35 мес) после операции 41 респондент имел удовлетворительную функцию ТП, не было данных за рецидив или прогрессирование рака [5].
Впервые об успешно проведенной лапароскопической резекции ТП с опухолью сообщили V. Font и соавт. в 2009 г. [7]. J. Kaouk и соавт. из Кливленда в 2011 г. выполнили робот-ассистированную лапароскопическую резекцию ТП по поводу образования 7 см в диаметре [8].
Приводим собственное клиническое наблюдение.
П а ц и е н т Б. 46 лет поступил в плановом порядке в отделение нефрологии и патологии трансплантированной почки ГКБ № 52 г. Москвы 04.07.2016 в связи с дисфункцией ТП для коррекции иммуносупрессивной терапии.
Из анамнеза известно, что в 1997 г. диагностирована терминальная стадия хронической почечной недостаточности (ТХПН) в исходе хронического гломерулонефрита, начато лечение перитонеальным диализом, которое проводилось в течение 3 мес. 22.04.1997 выполнена аллогенная трансплантация почки в правую подвздошную область. Иммуносупрессивная терапия на момент осмотра: метипред 4 мг ежедневно, биорал 225 мг в сутки.
Объективно: состояние удовлетворительное. Сознание ясное. Кожные покровы физиологической окраски, влажные. Периферических отеков нет. Температура тела – 36,6°С. Аускультативно над легкими дыхание везикулярное, хрипов нет; ЧДД – 18 в 1 мин. Тоны сердца ясные, ритм правильный, АД– 140/70 мм рт.ст., ЧСС – 77 в 1 мин. Живот равномерно участвует в акте дыхания, мягкий, не вздут, безболезненный при пальпации. В правой подвздошной области определяется трансплантированная почка, не увеличенная, безболезненная, тугоэластической консистенции. Перитонеальных симптомов нет. Печень не увеличена; селезенка, почки не пальпируются. Мочевой пузырь при пальпации не определяется. Наружные половые органы не изменены. Мочеиспускание не нарушено. Макрогематурии нет. Per rectum: предстательная железа не увеличена, плотноэластической консистенции, безболезненная, срединная бороздка выражена, слизистая прямой кишки смещаема, кал коричневого цвета.
Лабораторные данные: эр. 4,14×1012/л, Hb 131 г/л, тромбоциты 346×109/л, л. 10,4×109/л, глюкоза 4,77 ммоль/л, общий белок 74,9 г/л, мочевина 9,9 ммоль/л, креатинин 185,57 мкмоль/л, С-реактивный белок 0,09 МЕ/мл, калий 4,2 ммоль/л, натрий 137 ммоль/л. Коагулограмма: МНО 1,14, АЧТВ 27,9 с, протромбиновое время 14,7 с. ЭКГ: ритм синусовый. ЭОС резко отклонена влево. Неполная блокада передней ветви левой ножки пучка Гиса, ЧСС 70 в 1 мин. При рентгенологическом исследовании органов грудной клетки патологических изменений в легких не выявлено.
Данные УЗИ почек, почечного трансплантата, мочевого пузыря: почки в типичном месте. Контуры их нечеткие, ровные. Размеры правой почки 56×17 мм, левой почки 54×27 мм. Паренхима резко истончена. Чашечно-лоханочная система не расширена. Дополнительных образований в проекции паренхимы почек и почечных синусов, а также в проекции надпочечников не выявлено. Почечный трансплантат размером 126×43 мм. Паренхима толщиной 13,6 мм. Чашечно-лоханочная система не расширена. В области верхнего сегмента визуализируется изоэхогенное образование размером до 31,3×18,8 мм и несколько анэхогенных округлых образований размером до 9,4 мм. Мочевой пузырь объемом 250 мл, в области дна справа визуализируется фиксированное гиперэхогенное образование 6×3 мм с акустической эхотенью (лигатурный камень в области артифициального устья мочеточника).
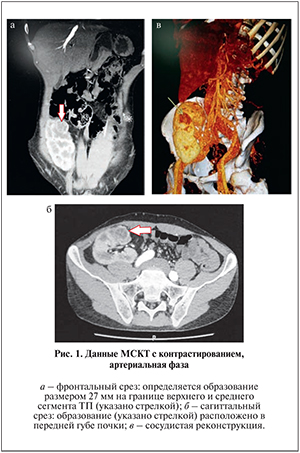
Мультиспиральная компьютерная томография (МСКТ) с внутривенным контрастированием: в среднем сегменте почечного трансплантата определяется округлое объемное образование диаметром 27 мм, выраженно, неоднородной структуры, деформирующее наружный контур трансплантата, негомогенно (преимущественно по периферии), интенсивно накапливает контрастное вещество (рис. 1). Сосуды почечной ножки интактны, анастомозированы с наружными подвздошными сосудами. Также в паренхиме трансплантата определяются гиподенсные очажки (по типу гамартом) до 10 мм в диаметре. Чашечно-лоханочная система не деформирована, не расширена. В устье мочеточника у внутренней стенки мочевого пузыря имеется пристеночное обызвествление. Регионарные лимфоузлы не увеличены.
На базе полученных данных поставлен диагноз: основной: хронический гломерулонефрит; осложнения: терминальная стадия хронической почечной недостаточности, состояние после аллогенной трансплантации трупной почки от 22.04.1997, состояние на постоянной иммуносупрессивной терапии, дисфункция почечного трансплантата, рецидив ХПН I ст., артериальная гипертензия III стадии, 3-й степени, риск 4; сопутствующие заболевания: рак почечного трансплантата T1aN0M0, кисты трансплантата, лигатурный конкремент мочевого пузыря.
Проведен консилиум с участием нефролога, онколога и уролога. Учтя молодой возраст пациента, удовлетворительную функцию трансплантата, размер опухоли 27 мм, ее локализацию преимущественно в области коркового слоя почки, отсутствие данных за метастазы в лимфоузлы и отдаленные органы, решено выполнить органосохраняющую операцию в объеме лапароскопической резекции ТП. С больным проведена беседа о том, что это первый опыт подобного вмешательства, пациент также информирован о возможной конверсии в открытое пособие, о вероятности трансплантатэктомии, получено согласие на операцию.
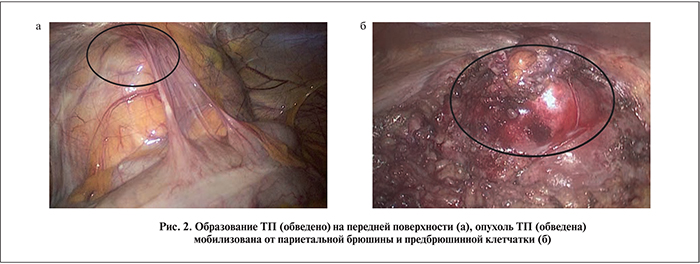
Вмешательство выполнено под тотальной внутривенной анестезией с ИВЛ. Больной уложен в положение Тренделенбурга с наклоном операционного стола влево, мочевой пузырь дренирован уретральным катетером Фолея 18 Сh. Использовано четыре лапароскопических порта. Три установлены в левой боковой области живота: 1 – 10 мм для видеокамеры в мезогастральной области по среднеключичной линии, 2 – 10 мм для ультразвукового скальпеля Harmonic в эпигастральной области по окологрудинной линии, 3–5 мм в гипогастральной области по среднеключичной линии для зажима. Четвертый порт 5 мм для хирургического отсасывателя установлен в правой эпигастральной области по среднеключичной линии. При обзорной лапароскопии мы не столкнулись со спаечным процессом, несмотря на перитонеальный диализ в анамнезе; в правой подвздошной области забрюшинно определялась ТП, визуализировано образование, располагавшееся по передней поверхности на границе верхнего и среднего сегментов почки (рис. 2, а).
 Первым этапом с помощью Harmonic выполнена мобилизация восходящего отдела толстого кишечника, передней поверхности ТП в области образования, иссечена париетальная брюшина и предбрюшинная клетчатка (рис. 2, б).
Первым этапом с помощью Harmonic выполнена мобилизация восходящего отдела толстого кишечника, передней поверхности ТП в области образования, иссечена париетальная брюшина и предбрюшинная клетчатка (рис. 2, б).
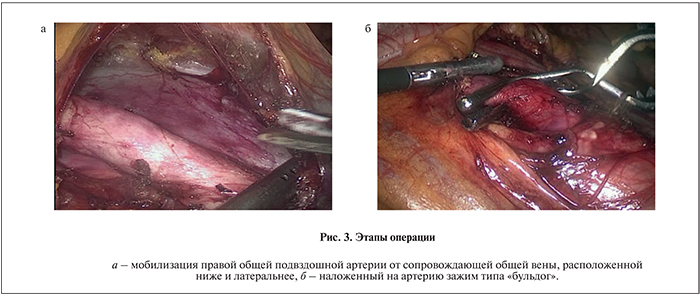
Далее определено местоположение promontorium, с отступлением от него выше на 3–4 см и правее, забрюшинно визуализирована пульсация правой общей подвздошной артерии. В бессосудистой зоне рассечена париетальная брюшина. Проведена мобилизация артерии с использованием Harmonic и «тупым» путем от правой общей подвздошной вены, на артерию наложен зажим типа «бульдог» (рис. 3).
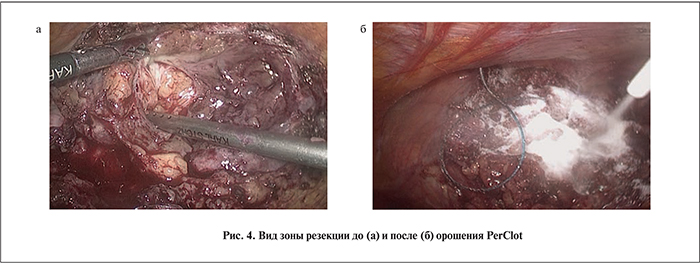
После прекращения кровотока в ТП, что подвержено отсутствием пульсации на правой бедренной артерии, проведена резекция ТП с опухолью «холодными» ножницами, с отступлением от края образования 5 мм. Рана почки (рис. 4, а) ушита непрерывным обвивным швом нитью V-loc. Дополнительный гемостаз проведен путем орошения зоны резекции полисахаридным гемостатическим средством PerClot через дополнительный прокол передней стенки живота непосредственно над почкой (рис. 4, б).
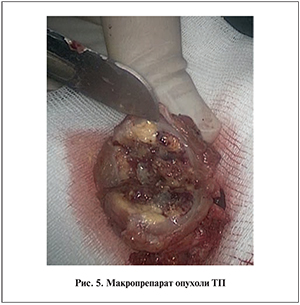
Зажим с артерии снят через 28 мин. Кровотечения не было. Макропрепарат эвакуирован с помощью эндоскопического контейнера. При макроскопическом осмотре опухолевый узел хорошо был отграничен от ткани почки коллабированной фиброзированной тканью, т.е. псевдокапсулой, макроскопически хирургический край отрицательный. На разрезе опухоль ярко-желтого цвета, отмечались области некроза, кровоизлияний (рис. 5). Брюшная полость дренирована одним силиконовым дренажом, установленным в полость малого таза.
Гистологическое заключение: светлоклеточный почечно-клеточный рак с очагами кровоизлияний. По периферии опухоли определяется зрелая волокнистая соединительная ткань. Вне опухоли артерии, артериолы с резко утолщенными стенками за счет склероза и гиалиноза. Умеренный отек стромы. Тотальный склероз клубочков. В окружающей строме вокруг клубочков и канальцев в корковом и мозговом слое умеренно выраженная лимфоидная инфильтрация. Сосуды, капилляры неравномерно полнокровны. В строме мозгового вещества выраженное разрастание соединительной ткани. Канальцы разных размеров с эозинофильным веществом в просветах с формированием картины «щитовидной почки».
Время операции составило 115 мин, интраоперационная кровопотеря – 50 мл. Пациент экстубирован на операционном столе, активизирован через сутки, тогда же удален и уретральный катетер. По страховому дренажу в первые сутки отошло 50 мл серозно-геморрагического отделяемого, в последующие дни – следы, в связи с чем после выполнения УЗИ брюшной полости и подтверждения отсутствия свободной жидкости, дренаж удален на 3-и сутки. В раннем послеоперационном периоде отмечена субфебрильная температура в течение 3 дней, лейкоцитоз до 15,9∙109/л. Через сутки после операции зафиксировано повышение уровня креатинина крови до 329 мкмоль/л, мочевины – до 18,9 мкмоль/л, которые постепенно снижались, составив на 6-е сутки 151 и 8,6 ммоль/л соответственно. Проводилась антибактериальная (эртапенем), гастропротективная (омепразол), нефропротективная (лозартан), гипотензивная, инфузионная, иммуносупрессивная (циклоспорин 225 мг в сутки, преднизолон 5 мг в сутки) терапия. Пациент выписан на амбулаторное лечение на 7-е сутки после операции в удовлетворительном состоянии.
Обсуждение. При определении возможности проведения лапароскопической резекции ТП полезная информация может быть получена с помощью МСКТ с ангиографией, которая показывает взаимоотношение ТП с окружающими органами, точную локализацию и размеры опухоли, положение магистральных сосудов относительно почки.
Основные сложности при выполнении лапароскопической резекции ТП с опухолью возникают при мобилизации почки и почечной артерии из-за выраженного спаечно-рубцового процесса, но этих трудностей можно избежать. При локализации опухолевого узла на передней, обращенной в сторону брюшной полости поверхности нет необходимости в мобилизации всей почки – достаточно освободить только сегмент с образованием от париетальной брюшины и предбрюшинной клетчатки. Поскольку органы малого таза, нижние конечности устойчивы к непродолжительной ишемии, остановка кровотока в ТП возможна путем наложения зажима или турникета не на почечную, а на общую подвздошную артерию, как правило свободную от рубцовой ткани. При мобилизации общей подвздошной артерии необходимо иметь в виду, что существует риск травмы сопровождающей вены, которая на фоне карбоксиперитонеума становится коллабированной.
В процессе ушивания зоны резекции мы столкнулись с трудностями при сопоставлении краев раны, что, видимо, обусловлено отсутствием мобильности почки на фоне спаечного процесса. Вероятно, необходимо более широкое освобождение поверхности ТП в месте локализации образования (на 3–4 см от края опухоли) до проведения этапа резекции, так как выполнение мобилизации после удаления опухолевого узла чревато декапсуляцией почки (в почечном трансплантате декапсуляция происходит легче) и развитием кровотечения.
Заключение. Органосохраняющее лечение показано больным с опухолью стадии Т1–Т2, отсутствием метастазов в лимфатических узлах, отдаленных органах, удовлетворительной функцией трансплантата. Лапароскопическая резекция ТП с опухолью со всеми преимуществами лапароскопической хирургии особенно актуальна для больных, находящихся в иммуносупрессии. Наиболее подходящими кандидатами, на наш взгляд, являются пациенты, у которых образование расположено по передней поверхности, преимущественно в корковом слое, не распространяется в синус. Такие аспекты, как отключение кровотока в почке путем пережатия общей подвздошной артерии, парциальная мобилизация почки только в области локализации опухоли, делают лапароскопический доступ технически осуществимым.



