Актуальность. Возрастающий уровень летальности и полиэтиологичность патологии делают лечение хронической почечной недостаточности (ХПН) одной из самых актуальных проблем современной медицины. Несмотря на то что трансплантация почки имеет более чем полувековую историю и на протяжении этого периода был накоплен колоссальный опыт, касающийся модернизации хирургической техники, консервации органов, совершенствования и оптимизации протоколов иммуносупрессии, а также послеоперационного ведения пациентов, «листы ожидания» на выполнение оперативного вмешательства во всем мире неуклонно увеличиваются [1, 2]. Ключевой проблемой современной трансплантологии являются прогрессирующий дефицит донорских органов, сложность их доставки, трудность поиска иммунологически совместимых органов и пожизненное назначение иммуносупрессивной терапии [3–5]. Наличие вышеописанных трудностей требует решения, позволяющего устранять как этические, так и иммунологические проблемы трансплантологии, что способствовало развитию современной тканевой инженерии почки, приоритетным направлением которой является разработка биоинженерных каркасов с последующим заселением их аутологичными клетками различных линий. На сегодняшний день в мире существует несколько лабораторий, занимающихся созданием тканеинженерных конструкций (ТИК) почки.
Так, E. Ross и соавт. [6] разработали несколько протоколов децеллюляризации почек крысы детергент-энзиматическим методом путем перфузии через почечную артерию комбинаций различных концентраций Triton X-100 (0,5; 3; 6 и 10 %) с 4%-ным дезоксихолатом натрия, а также 4%-ным SDS. Оба предложенных протокола позволили эффективно удалить клеточный материал, почки приобрели прозрачность при сохранении характерной архитектоники базальной мембраны. C. Liu и соавт. [7] получили бесклеточный матрикс почки крысы путем ретроградной перфузии почечных артерий растворами 1% SDS и 1% TritonX-100. Особенностью указанного протокола помимо изменения концентраций детергентов стало изменение скорости перфузии и общего времени воздействия децеллюляризирующих растворов до 64 ч.
Отсутствие клеток на каркасе верифицировали рутинными гистологическими методами и анализом ультраструктурной архитектоники матрикса. P. Baptista и соавт. [8] разработали перфузионную систему для создания естественных 3D-каркасов с интактной сосудистой сетью не только для почки, но и для других паренхиматозных органов, например печени и поджелудочной железы. Сосуды нативной почки канюлировали, для перфузии использовали растворы TritonX-100 и гидроокись аммония в деионизированной воде. В результате проведенной децеллюляризации получен каркас почки с сохранной сосудистой сетью; окрашивание гематоксилином и эозином, а также иммуногистохимическое окрашивание на содержание коллагена, ламинина и фибронектина подтвердили сохранность архитектоники нативного органа и содержание белков внеклеточного матрикса (ВКМ).
J. J. Song и соавт. [9] децеллюляризировали почку крысы путем введения через почечную артерию 1%-ного раствора SDS под контролем перфузионного давления. В результате эксперимента был получен ацеллюлярный матрикс, сохраняющий архитектонику нативной ткани и белки ВКМ. Указанный каркас заселяли эпителиальными и эндотелиальными клетками сначала статически, а затем перфузионно в биореакторе. После культивирования в условиях in vitro указанная конструкция была ортотопически пересажена крысе. По данным авторов, ТИК успешно функционировала без признаков кровотечения или тромбозов сосудистой сети трансплантата. Однако указанная конструкция все же имела ряд недостатков. Так, уровень гломерулярной фильтрации был ниже, чем в нативных почках, также снижалась фракционная реабсорбция электролитов, что свидетельствовало о функциональной незрелости тканеинженерной почки [9].
Таким образом, неспособность природных материалов полностью воспроизводить сложную структуру ВКМ привела к необходимости использовать децеллюляризированные каркасы нативных органов, полученных от доноров, либо матриксы, изготовленные из полимерных материалов и полностью воспроизводящие структуру нативного органа. Каркасы, полученные путем децеллюляризации, имеют большую биосовместимость и вызывают меньшую, чем синтетические полимеры, реакцию со стороны иммунной системы.
Применение объемных 3D-каркасов позволяет эффективно рецеллюляризировать матрикс различными типами клеток, а следовательно, получать почечную ткань, способную выполнять свои физиологические функции [10]. Однако даже функционирующие в условиях in vitro и in vivo каркасы не лишены недостатков, что оставляет пути для разработки более эффективных и одновременно щадящих способов децеллюляризации. Длительность протоколов, агрессивные детергенты, стремление получить бесклеточный матрикс, иногда в ущерб сохранности компонентов ВКМ, делают поиск оптимальных протоколов с комплексной оценкой качества каркасов весьма актуальным.
Целью исследования стала разработка нового протокола получения децеллюляризированного матрикса почки на модели мелкого лабораторного животного с последующей комплексной оценкой полученного каркаса.
Материалы и методы
Эксплантация почек и подготовка органов к децеллюляризации
Для разработки протоколов децеллюляризации почки использовано 15 крыс-самцов линии Wistar (Раппалово, Санкт-Петербург) массой 200±50 г. Манипуляции на животных проводили на базе лаборатории фундаментальных исследований в области регенеративной медицины Кубанского государственного медицинского университета в соответствии с Принципами ухода за лабораторными животными и Руководством по уходу и использованию лабораторных животных (США, 2001) после одобрения протокола исследования локальным этическим комитетом (протокол № 21/1). Животных содержали в виварии с обеспечением стандартных условий: 12-часовой световой день, свободный доступ к воде и пище, температурный режим 18–25°С.
 За 1 ч до проведения хирургического вмешательства животным выполняли инъекцию гепарина в дозе 100 ЕД, эвтаназию осуществляли летальной дозой барбитуратов (150 мг/кг) интраперитонеально. Эксплантацию почки выполняли после срединной лапаротомии при послойном разделении тканей, при этом петли кишечника и брыжейку отводили в сторону с последующей ревизией боковых фланков и выведением почки и сосудистой ножки наружу. Иссечение сосудистой ножки осуществляли с участками аорты и задней полой вены до бифуркации. Выделение почки из жировой капсулы проводили в стерильных условиях с последующим промыванием раствором фосфатного буфера с добавлением 1%-ного пенициллина-стрептомицина. Почечную артерию выделяли с осторожностью, преимущественно тупым путем, канюлировали стерильным внутривенным катетером 24 G или 22 G («La-med Healthcare Pvt. Ltd», Индия) в зависимости от диаметра артерии и фиксировали в специализированном биореакторе («Harvard Apparatus», Массачусетс, США).
За 1 ч до проведения хирургического вмешательства животным выполняли инъекцию гепарина в дозе 100 ЕД, эвтаназию осуществляли летальной дозой барбитуратов (150 мг/кг) интраперитонеально. Эксплантацию почки выполняли после срединной лапаротомии при послойном разделении тканей, при этом петли кишечника и брыжейку отводили в сторону с последующей ревизией боковых фланков и выведением почки и сосудистой ножки наружу. Иссечение сосудистой ножки осуществляли с участками аорты и задней полой вены до бифуркации. Выделение почки из жировой капсулы проводили в стерильных условиях с последующим промыванием раствором фосфатного буфера с добавлением 1%-ного пенициллина-стрептомицина. Почечную артерию выделяли с осторожностью, преимущественно тупым путем, канюлировали стерильным внутривенным катетером 24 G или 22 G («La-med Healthcare Pvt. Ltd», Индия) в зависимости от диаметра артерии и фиксировали в специализированном биореакторе («Harvard Apparatus», Массачусетс, США).
Децеллюляризация почки
Децеллюляризацию выполняли детергент-энзиматическим методом в авторской модификации протокола, предложенного J. J. Song и соавт. [9]. Общее время воздействия детергентов составило 22 ч.
Процесс децеллюляризации начинали с антеградной перфузии через почечную артерию стерильного раствора фосфатного буфера с добавлением 1%-ного антибиотика-антимикотика в течение 30 мин. Далее последовательно выполняли перфузию деионизированной водой в течение 30 мин, 4%-ным раствором дезоксихолата натрия с добавлением 800 мкл ЭДТА 3 ч, промывали фосфатным буфером и воздействовали раствором бычьей панкератической ДНКазы-I 2000 ЕД/мг в течение 1 ч. Цикл завершали промыванием фосфатным буфером в течение 12 ч. Следующий цикл децеллюляризации начинали с перфузии деионизированной водой (30 мин), продолжали 4%-ным раствором дезоксихолата натрия в течение 1,5 ч и воздействием раствора бычьей панкератической ДНКазы-I также в течение 1,5 ч.
Завершали децеллюляризацию перфузией через почечную артерию стерильного раствора фосфатного буфера.
Выделение и типирование мезенхимальных мультипотентных стволовых клеток (ММСК)
 Для выделения ММСК у 10 крыс-самцов линии Wistar (Раппалово, Санкт-Петербург) массой 200±50 г после эвтаназии осуществляли забор бедренных и большеберцовых костей. В стерильных условиях метафизы костей отсекали, костный мозг путем многократных промываний раствором фосфатного буфера с 1%-ным содержанием антибиотика-антимикотика извлекали в стерильную пробирку. После центрифугирования осадок ресуспендировали в культуральной среде DMEM с добавлением 10%-ной фетальной бычьей сыворотки (FBS) и 1%-ного раствора пенициллина и стрептомицина (все – Gibco, Life Technologies, США). Посев культуры осуществляли на флаконы Corning (США) и инкубировали при 37°С с 5%-ным содержанием СО2. После первых 24 ч инкубации неприкрепившиеся клетки удаляли вместе с культуральной средой, далее смену среды проводили каждые 2 дня. Культивирование осуществляли до 3–4 пассажей с последующим типированием перед использованием в исследованиях цитотоксических свойств и жизнеспособности клеток на каркасах. Принадлежность клеток к ММСК верифицировали при индуцированной дифференцировке в три клеточные линии с помощью специализированных сред StemPro (Gibco, «Thermo Fisher Scientific Inc.», США) по протоколу производителя с последующей качественной детекцией [11]. После завершения индукции адипогенную дифференцировку выявляли с помощью красителя Oilred O, хондрогенную – при окрашивании сульфатированных гликозаминогликанов толуидиновым синим, минерализацию внеклеточного матрикса при остеогенной дифференцировке определяли при окрашивании ализариновым красным.
Для выделения ММСК у 10 крыс-самцов линии Wistar (Раппалово, Санкт-Петербург) массой 200±50 г после эвтаназии осуществляли забор бедренных и большеберцовых костей. В стерильных условиях метафизы костей отсекали, костный мозг путем многократных промываний раствором фосфатного буфера с 1%-ным содержанием антибиотика-антимикотика извлекали в стерильную пробирку. После центрифугирования осадок ресуспендировали в культуральной среде DMEM с добавлением 10%-ной фетальной бычьей сыворотки (FBS) и 1%-ного раствора пенициллина и стрептомицина (все – Gibco, Life Technologies, США). Посев культуры осуществляли на флаконы Corning (США) и инкубировали при 37°С с 5%-ным содержанием СО2. После первых 24 ч инкубации неприкрепившиеся клетки удаляли вместе с культуральной средой, далее смену среды проводили каждые 2 дня. Культивирование осуществляли до 3–4 пассажей с последующим типированием перед использованием в исследованиях цитотоксических свойств и жизнеспособности клеток на каркасах. Принадлежность клеток к ММСК верифицировали при индуцированной дифференцировке в три клеточные линии с помощью специализированных сред StemPro (Gibco, «Thermo Fisher Scientific Inc.», США) по протоколу производителя с последующей качественной детекцией [11]. После завершения индукции адипогенную дифференцировку выявляли с помощью красителя Oilred O, хондрогенную – при окрашивании сульфатированных гликозаминогликанов толуидиновым синим, минерализацию внеклеточного матрикса при остеогенной дифференцировке определяли при окрашивании ализариновым красным.
Оценка качества биологических каркасов почки
После завершения децеллюляризации проводили исследования, направленные на оценку качества биологических каркасов почки. Полученные образцы фиксировали в 10%-ном нейтральном забуференном формалине, дегидратировали и заключали в парафин по стандартной методике с использованием автоматического гистопроцессора Leica TP1020 и модульной установки Leica EG1150H (Германия). Парафиновые срезы толщиной 5 мкм, полученные при помощи ротационного микротома Leica RM2235 (Германия), депарафинизировали и гидратировали с последующим окрашиванием гематоксилином и эозином и флуорофором DAPI (4’,6-диамидино-2-фенилиндола). Гистологическую картину оценивали при помощи микроскопа Olympus BX 51 (Япония).
Эффективность проведенной децеллюляризации оценивали при количественном определении содержания ДНК до и после воздействия децеллюляризирующих агентов на спектрофотометре NanoDrop ND-1000 («Thermo Fisher Scientific Inc.», США) с использованием набора реагентов («Dneasy Blood and Tissue Kit», Qiagen, Швеция) по стандартной методике фирмы-изготовителя.
Также для оценки эффективности децеллюляризации применяли биофизический метод оценки – ЭПР-спектроскопию. Измерение спектров ЭПР проводили на спектрометре JES FA 300 («JEOL», Япония) при температуре 24°С в X-диапазоне. Параметры измерения: сверхвысокочастотное излучение мощностью 1 мВт, частота микроволнового излучения – 9144 МГц, амплитуда высокочастотной модуляции – 0,1 мТл [12]. Образцы предварительно подвергали лиофилизации в сушилке ЛС-1000 («Проинтех», Россия), после чего взвешивали (весы «Ohaus», КНР, точность±0,01 мг). Сигнал ЭПР у взвешенного образца измеряли в кварцевой ампуле (диаметр 5 мм), при этом масса навески в зоне резонатора составила 0,03 г [13]. Концентрацию парамагнитных центров в образцах определяли путем сравнения с сигналом стандартного образца (2,2,6,6-тетраметилпиперидин-1-ил)оксиданил, TEMPO), содержащего 6.4×10-7 моль парамагнитных центров, интегральную интенсивность сигнала ЭПР в исследуемых образцах вычисляли путем двойного численного интегрирования.
 Для оценки жизнеспособности клеток на каркасе и цитотоксических свойств полученного децеллюляризированного матрикса почки использовали метод статической рецеллюляризации с последующим выполнением XTT-теста и расчетом количественных показателей ЖСП и цитотоксического индекса [14] после измерения оптической плотности культуральной среды с XTT-реагентом. Для этого в 96-луночный планшет помещали образцы децеллюляризированной почки, добавляли суспензию клеток и культивировали в стандартных условиях в СО2-инкубаторе 24 ч перед выполнением ХТТ-теста. Для рецеллюляризации использовали ММСК 3-го пассажа в виде суспензии, клетки вводили однократно в общем объеме 30 тыс. на лунку в 200 мкл культуральной среды DMEM, содержащей 10% фетальной бычьей сыворотки и 1%-ный раствор антибиотика-антимикотика. Контролем служили ячейки с ММСК, культивируемыми без биологических каркасов. Рабочий раствор ХТТ готовили по протоколу производителя («Cell proliferation assay XTT, Aphli Chem GmbH, Германия). Измерение оптической плотности проводили на многофункциональном ридере FilterMax F5 («Molecular Devices», США) в стандартных условиях на длине волны 450 нм по предустановленным протоколам фирмы-разработчика.
Для оценки жизнеспособности клеток на каркасе и цитотоксических свойств полученного децеллюляризированного матрикса почки использовали метод статической рецеллюляризации с последующим выполнением XTT-теста и расчетом количественных показателей ЖСП и цитотоксического индекса [14] после измерения оптической плотности культуральной среды с XTT-реагентом. Для этого в 96-луночный планшет помещали образцы децеллюляризированной почки, добавляли суспензию клеток и культивировали в стандартных условиях в СО2-инкубаторе 24 ч перед выполнением ХТТ-теста. Для рецеллюляризации использовали ММСК 3-го пассажа в виде суспензии, клетки вводили однократно в общем объеме 30 тыс. на лунку в 200 мкл культуральной среды DMEM, содержащей 10% фетальной бычьей сыворотки и 1%-ный раствор антибиотика-антимикотика. Контролем служили ячейки с ММСК, культивируемыми без биологических каркасов. Рабочий раствор ХТТ готовили по протоколу производителя («Cell proliferation assay XTT, Aphli Chem GmbH, Германия). Измерение оптической плотности проводили на многофункциональном ридере FilterMax F5 («Molecular Devices», США) в стандартных условиях на длине волны 450 нм по предустановленным протоколам фирмы-разработчика.
Статистический анализ
Статистическую обработку полученных данных осуществляли методами вариационной статистики на персональном компьютере с использованием программного обеспечения Excel for Office. Полученные результаты выражали в виде средних значений (M) и ошибки среднего (m). При сравнении средних значений изучаемых групп процент возможной ошибки находили по таблице t-критерия Стьюдента для парных сравнений, выражаемый в виде значений достоверности различия «р», где р<0,05 считалось статистически значимым.
Результаты. После завершения процесса децеллюляризации макроскопически почки теряли интенсивный мясисто-красный цвет, характерный для нативного органа, и приобретали слегка опалесцирующий желтовато-белый оттенок, свойственный децеллюляризированным тканям (рис. 1), что согласуется с данными литературы [15–18]. При этом была сохранена трехмерная структура матрикса.
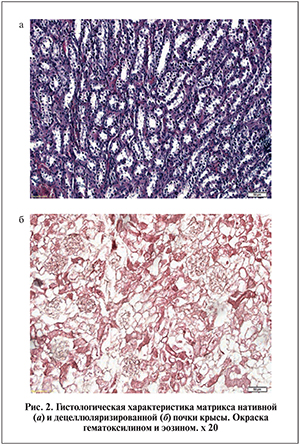
Окрашивание гематоксилином и эозином почки, децеллюляризированной по протоколу, проводимому при антеградной перфузии через почечную артерию растворов детергентноферментативным методом, выявило полное отсутствие клеточных элементов и ядер в кортикальном и медуллярном слоях при сохранной структуре ВКМ (рис. 2).
 При окрашивании флуорофором DAPI в срезах нативной почки отмечено интенсивное свечение ядерных структур, а децеллюляризированной свечение полностью отсутствовало.
При окрашивании флуорофором DAPI в срезах нативной почки отмечено интенсивное свечение ядерных структур, а децеллюляризированной свечение полностью отсутствовало.
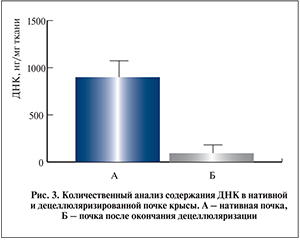
При количественном определении уровня ДНК в нативных и децеллюляризированных образцах почки установлено, что около 82,6% ядерного материала было удалено в процессе децеллюляризации (930,7±107,9 и 162,8,3±56,04 нг/мг в нативной ткани и децеллюляризированной ткани соответственно, p=0,0037; рис. 3).
Колориметрический анализ с использованием ХТТ-реагента показал наличие метаболической активности клеток, засеянных на каркас децеллюляризированной почки в статических условиях (засеивание каркаса проводилось на 96-луночном планшете в течение 24 ч). Расчет жизнеспособности клеток на каркасе и цитотоксического индекса количественным методом подтвердил правильность данных, полученных при качественной оценке метаболической активности клеток. Так, цитотоксический индекс каркаса составил 16%, а жизнеспособность клеток, засеянных на децеллюляризированный матрикс почки, – 116%, что свидетельствует о клеточной пролиферации. Статистически значимых различий между показателями оптической плотности клеток, культивированных на каркасе, и контрольных клеток не было (р=0,0624; рис. 4).
Одним из перспективных критериев оценки качества проводимой децеллюляризации может стать биофизический метод. Известно, что клеточный метаболизм в естественных условиях протекает с образованием свободных радикалов [19]. При этом в дыхательной цепи митохондрий одним из основных продуктов свободнорадикальной природы является семихинонный радикал убихинона (HQ•), по уровню которого можно судить о митохондриальной активности, поскольку парамагнитные частицы являются общими промежуточными продуктами всех окислительно-восстановительных реакций при физиологическом и патологическом метаболизме, что также является и одним из критериев, свидетельствующих о жизнеспособности клеток [20]. Одним из современных эффективных методов, позволяющих проводить изучение качественного и/или количественного содержания парамагнитных частиц как в целых живых тканях, так и в отдельных органоидах, является ЭПР-спектроскопия, которая дает возможность оценивать состояние свободнорадикальных процессов в сложных биологических системах, в том числе в митохондриях [20].
При анализе спектров ЭПР децеллюляризированной почки парамагнитные центры, соответствующие семихинонному радикалу убихинона (HQ•), не выявлены, что подтверждается отсутствием сигнала с g-фактором в диапазоне от 2,005 до 2,007, который по интенсивности отличался бы от нуля. Полученные данные указывают на отсутствие системы переносчиков электронов, необходимых для функционирования живых клеток в децеллюляризированной почке [21], что подтверждало отсутствие жизнеспособных клеток в соответствующих органах после выполнения протокола децеллюляризации.
В лиофилизированной ткани нативной почки с помощью метода ЭПР-спектроскопии были выявлены парамагнитные центры (g-фактор в диапазоне от 2,005 до 2,007), которые соответствовали семихинонному радикалу убихинона, при этом их концентрация в образцах варьировалась от 7,65×10-8 до 2,47×10-7 моль/г лиофилизированной ткани, что свидетельствует о наличии живых клеточных элементов в изученном образце. При изучении спектров ЭПР нативной почки концентрация парамагнитных центров с g-фактором 2,005 составила 9,79×10-8 моль/г лиофилизированной ткани, что подтвердило наличие свободнорадикальных процессов в митохондриях клеток нативной ткани.
Полученные результаты позволяют рассматривать метод ЭПР-спектроскопии как один из возможных способов оценки жизнеспособности клеточных структур в нативных и децеллюляризированных тканях почки, так как отсутствие сигнала ЭПР с g-фактором в диапазоне от 2,005 до 2,007 указывает на отсутствие живых клеток в изучаемом образце, что имеет практическое значение для определения завершенности этапа подготовки биоматрикса, оцениваемого по степени разрушения клеточных структур в ткани.
Обсуждение. Создание искусственного органа, полностью заменяющего донорскую почку, помогло бы спасти жизнь многим больным. Сейчас пациенты, ожидающие трансплантацию, вынуждены постоянно проходить процедуру диализа, что существенно ухудшает их качество жизни. Значительный рост патологии почек в последнее время требует разработки новых методов лечения, в том числе с активным привлечением клеточной терапии и тканевой инженерии [22]. Так, была разработана конструкция биологической почечной мембраны, состоящей из монослоя клеток, культивированных на полимерной синтетической мембране, с сохранением условий для ионного транспорта [22, 23]. Однако необходимы дальнейшие исследования для улучшения функционирования клеточного монослоя на поверхности мембраны и улучшения протоколов культивирования эпителиальных клеток почечных канальцев на синтетической мембране. Аппараты биоискусственной почки, как и ранее созданные аппараты искусственной почки для проведения гемодиализа и/ или перитонеального диализа, не в полной мере способны воссоздать комплексную пространственную структуру нативного органа и его клеточный состав. Например, в существующих аппаратах искусственной почки используются полупроницаемые мембраны для моделирования процесса функционирования почечных клубочков, но при этом не происходит замещения транспортных, метаболических и эндокринных функций, выполняемых только клетками канальцевого эпителия [23].
Использование аллогенных клеток канальцевого почечного эпителия в экстракорпоральных мембранных устройствах позволило значительно улучшить клинические исходы у пациентов без ухудшения качества жизни [23]. Это привело к созданию конструкции биоискусственной системы почечного эпителия, представляющего собой биореактор, в котором аллогенные клетки почечного эпителия засеяны на пористые карбоновые диски с подложкой из поликарбоната. Жизнеспособность клеток поддерживается путем перфузии культуральной среды через диски, что позволяет клеткам в определенной степени реализовывать метаболические и эндокринные функции канальцевого эпителия [24].
Однако указанные устройства используются исключительно экстракорпорально. Это заставляет искать возможности создания биологических каркасов почки, которые будут не только обладать компактностью и возможностью долговременного использования, но и способствовать прикреплению, росту и пролиферации различных клеточных линий для как можно более полноценного воспроизведения структурных и функциональных свойств нативной почки in vivo. В настоящее время ведется активный поиск биосовместимых материалов, способных обеспечивать механическую стабильность на уровне целого органа и не препятствовать дальнейшему росту клеток на биоискусственном каркасе. Децеллюляризация – процесс, направленный на удаление клеток с сохранением компонентов ВКМ и трехмерной структуры органа или ткани. По данным литературы, ВКМ обладает свойствами поддерживать клеточную адгезию, регулировать миграцию, рост, дифференцировку клеток, апоптоз, модулировать действие цитокинов и факторов роста, активировать межклеточное взаимодействие. Следовательно, для создания полноценной ТИК органа или ткани необходимо получение качественного биологического каркаса. Известны работы ученых по созданию децеллюляризированного матрикса почки с использованием протоколов, совмещающих различные типы и концентрации детергентов и энзимов, изменение последовательности и скорости перфузии растворов, длительности воздействия и т.д. [6–9]. Несмотря на успехи в этой области, полученные матриксы не были комплексно оценены и при проведении рецеллюляризации, хотя и давали кратковременные эффекты воспроизведения функции фильтрации, реабсорбции и секреции, функционально значительно отличались от нативной почки. Кроме того, ключевым аспектом является правильный подбор клеточной линии для рецеллюляризации матрикса. Так, например, в работе
J. J.Song и соавт. процедура получения ацеллюлярного каркаса почки проводилась путем перфузии 1%-ного раствора SDS с последующей рецеллюляризацией дифференцированными эпителиальными и эндотелиальными клетками. Авторы статьи предлагают заменить используемый детергент на 4%-ный раствор дезоксихолата натрия, являющийся децеллюляризирующим агентом более щадящего действия, а также сократить продолжительность экспозиции, что способствует сохранению структурной целостности ВКМ. ММСК в работе использованы для проведения тестирования на цитотоксичность каркаса, однако полноценно функционирующий тканеинженерный орган не может быть рецеллюляризирован с использованием только одной клеточной культуры. Более того, эндотелиальные и эпителиальные клетки также не справляются с этой задачей, в результате чего не обеспечивается полноценная функционально полноценная клубочковая фильтрация и реабсорбция [9]. Поиск оптимальных протоколов получения биологических каркасов почки и клеточных линий для рецеллюляризации остается актуальным вопросом тканевой инженерии.
Заключение. Разработка ТИК почки считается весьма перспективным направлением регенеративной медицины для решения ключевых проблем трансплантологии и осложнений проведения экстракорпоральной детоксикации.
Авторами статьи предложен модифицированный протокол децеллюляризации почки крысы с последующей комплексной оценкой морфологических изменений структуры полученного каркаса в результате обработки, количественным определением содержания остаточной ДНК и ЭПР-спектроскопией для регистрации биофизических параметров до и после воздействия детергентов и ферментов. Указанные параметры позволили оценить эффективность и качество проведенной децеллюляризации. Цитотоксические свойства каркаса и метаболическую активность клеток при рецеллюляризации оценивали количественно колориметрическим тестом с использованием ХТТ-реагента и последующим расчетом индексов жизнеспособности и цитотоксичности.
Разработанные критерии для оценки качества децеллюляризированных матриксов учитывают комплексный подход, направленный не только на уничтожение клеток, способных вызывать иммунную реакцию отторжения, но и на обеспечение сохранности структуры ткани, отсутствие токсичности, возможность восстановления биомеханических характеристик. Полученный каркас почки не нарушает клеточной адгезии, способствует пролиферации клеток и потенциально способен воссоздать трехмерную структуру нативного органа. Биологические каркасы зарекомендовали себя как надежные нетоксичные матриксы, воспроизводящие архитектонику нативной ткани с сохранными компонентами внеклеточного матрикса и развитой сосудистой сетью, поддерживающие адгезию, рост и пролиферацию клеток после рецеллюляризации.
Благодарности
Работа выполнена при поддержке государственного задания Министерства здравоохранения Российской Федерации (от 28.01.2015. Ч. 1, раздел 1) «Разработка экспериментальных образцов тканеинженерных конструкций на основе децеллюляризированных матриксов для применения в регенеративной медицине» и комплексной НИР «Клеточные механизмы регенерации интраторакальных органов и тканей. Разработка тканеинженерных конструкций с использованием биологических и синтетических каркасов».



