Актуальность. Проблема оперативного лечения пролапса гениталий (ПГ) остается весьма актуальной. Распространенность данной патологии среди женщин составляет 11,4–41%, риск операции по поводу этого заболевания – 2,7–11% случаев. С возрастом отмечается тенденция к увеличению частоты возникновения ПГ [1].
Единственный эффективный метод лечения ПГ и несостоятельности тазового дна – хирургический [2]. При этом хирургическая коррекция ПГ с использованием собственных тканей сопряжена с риском рецидива до 40% из-за несостоятельности этих тканей [3].
Современная хирургическая концепция пластики тазового дна основывается на «замене» поврежденной и неполноценной тазовой фасции на новую (создание неофасции), что обеспечивает надежный каркас для органов малого таза и патогенетически обосновано [3, 4]. Проведенные исследования показали преимущества полипропиленовых сеток [5], эффективность использования которых достигает 81,0–95,8% [6–8].
В настоящее время можно сказать, что применение полипропиленовых сеток в коррекции ПГ при наличии показаний обоснованно и целесообразно. Однако существенными недостатками использования наборов для лечения ПГ становятся возникающие mesh (имплантатассоциированные) осложнения: эрозии слизистой влагалища (1–19%), синехии влагалища (0,3%), эрозия мочевого пузыря (0,2%), уретровлагалищный свищ (0,15%), сморщивание протеза (1%), хронический болевой синдром (2,9–18,3%), диспареуния de novo (2,2–27,7%), инфицирование (0,6%), экструзии сеток (0–30%) [6–8].
Проведенное в 2013 г. экспериментальное исследование на крольчихах показало, что сверхлегкий (поверхностная плотность – 19 г/м2) и легкий (поверхностная плотность – 42,7 г/м2) полипропиленовые имплантаты при имплантации их в стенку влагалища и фиксации к мочевому пузырю вызывали асептическую воспалительно-репаративную реакцию с образованием рубца. Результаты анализа течения послеоперационного периода у всех крольчих позволили предположить, что осложнения при влагалищной коррекции ПГ с использованием полипропиленовых сеток могут быть связаны не с контактом сетчатых имплантатов с тканями, а с особенностями оперативной техники [9].
Ряд авторов [6–8, 10, 11] в качестве возможных причин возникновения mesh-осложнений выде-ляют:
- Необоснованное применение сетчатых имплантатов при коррекции ПГ.
- Особенности технического исполнения операции (поверхностное расположение полипропиленового имплантата – на эндопельвикальной фасции; избыточное натяжение сетки, неадекватное расправление имплантата с последующим «сморщиванием», избыточное иссечение слизистой влагалища, фиксация края протеза в проекции пределов фасциального дефекта без перекрытия здоровой ткани.
- Гистерэктомию.
Сказанное выше диктует необходимость совершенствования техники коррекции ПГ влагалищным доступом с использованием полипропиленовой сетки, позволяющей снизить риск повторных операций, количество послеоперационных осложнений.
 Цель исследования: сравнить результаты оперативного лечения пациенток с ПГ, оперированных влагалищным доступом с использованием легких и сверхлегких полипропиленовых сеток.
Цель исследования: сравнить результаты оперативного лечения пациенток с ПГ, оперированных влагалищным доступом с использованием легких и сверхлегких полипропиленовых сеток.
Материалы и методы. Проведено проспективное рандомизированное исследование, в которое были включены 93 женщины старше 18 лет с симптомным ПГ II–IV стадий по классификации POP-Q (ICS, 1996), согласившиеся на оперативное лечение и участие в данном исследовании. Операции были выполнены в период с 2007 по 2011 г.
Критерии исключения:
- беременность;
- облучение малого таза в анамнезе;
- тяжелые сопутствующие соматические заболевания, являющиеся абсолютным противопоказанием к оперативному лечению;
- изолированное ректоцеле;
- ПГ в сочетании с воспалительным процессом в органах малого таза и/или злокачественными и предраковыми заболеваниями гениталий;
- невозможность наблюдать пациентку в течение 24 мес после операции;
- поливалентная аллергия, в связи с риском развития реакции отторжения полипропиленового имплантата.
В зависимости от использованного способа коррекции ПГ пациентки были разделены на две группы. В 1-ю группу (n=50) вошли пациентки, которым была выполнена операция по разработанной нами методике с использованием перфорированного сверхлегкого (поверхностная плотность – 19 г/м2) полипропиленового имплантата отечественного производства [12]; во 2-ю (n=43) – пациентки, которым произведена операция с использованием стандартного троакарного набора с легким (поверхностная плотность – 42,7 г/м2) полипропиленовым имплантатом зарубежного производства.
Техника вагинальной экстраперитонеальной кольпопексии перфорированным полипропиленовым имплантатом. Операции выполняли под спинномозговой анестезией без или в сочетании с внутривенным наркозом. Пациентку укладывали на операционном столе с разведенными ногами, уложенными на подставки для ног, в положении Тренделенбурга 30°.
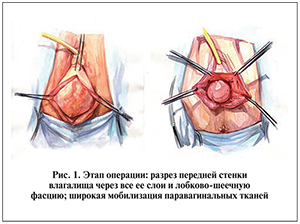
В полость мочевого пузыря устанавливали уретральный катетер Фолея № 16–20 Ch, баллон которого раздували до 20 мл. Проводили гидропрепаровку тканей передней стенки влагалища физиологическим раствором объемом 40 мл с введением последнего под лобково-шеечную фасцию. Следующим этапом выполняли разрез передней стенки влагалища с обязательным рассечением слизистой оболочки влагалища и лобково-шеечной фасции, отступя 2–3 см проксимальнее наружного отверстия уретры, не доходя до наружного зева шейки матки на 1,5–2,0 см при сохранении матки или обойдя вокруг шейку матки при влагалищной экстирпации последней (рис. 1).
По показаниям выполняли влагалищную экстирпацию матки с кульдопластикой по МакКоллу [13].
Тупым и острым путем выполняли широкую мобилизацию задней стенки мочевого пузыря и его латеральных (правой и левой) сторон, обнажали паравагинальное пространство, вскрывали клетчаточное пространство вокруг запирательных отверстий (см. рис. 1).
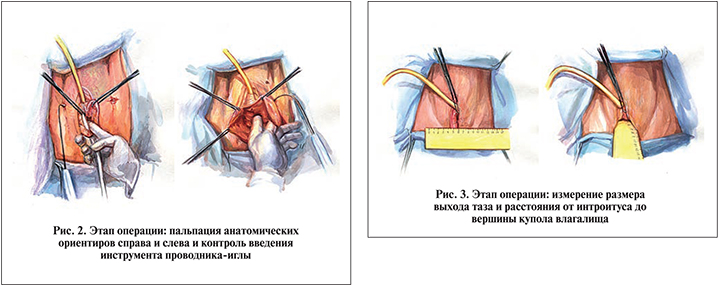
Мануально идентифицировали нижние ветви лонных костей с обеих сторон, костный бугорок седалищной кости, сухожильные дуги внутритазовой фасции (рис. 2).
Производили разрез кожи в области левой пахово-бедренной складки на уровне клитора длиной около 0,8 см. Далее под контролем указательного пальца при помощи проводника-иглы Урофикс ПЛ перфорировали мембрану запирательного отверстия таза в области переднемедиального края со стороны кожи.
Аналогично выполняли установку проводника-иглы справа. В результате один конец трубчатого проводника выходил через кожу пахово-бедренной складки, второй, перфорируя мембрану запирательного отверстия, – через влагалище. Через трубчатые проводники (канюли) устанавливали ретракторы рукавов полипропиленовой сетки.
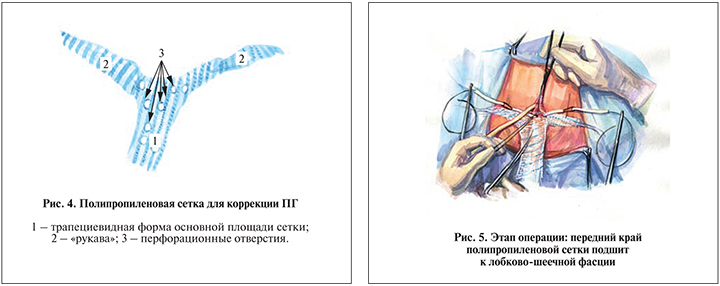
Подготавливали имплантат из сверхлегкой (поверхностная плотность – 19 г/м2) полипропиленовой сетки отечественного производства, для чего будущий имплантат вырезали по форме равнобедренной трапеции с индивидуальными размерами для каждой пациентки (высота трапеции определяется как расстояние от интроитуса до купола влагалища; широкое основание трапеции равно половине поперечного размера выхода таза [pасстояние между внутренними поверхностями седалищных бугров] +2 см; узкое основание равно ширине шейки матки +2 см) и два рукава длиной 10 см и шириной 1 см каждый (рис. 3).
В полученной полипропиленовой сетке делали 4–6 отверстий округлой формы диаметром 5–7 мм на расстоянии не менее 1 см от края сетки и друг от друга с целью уменьшения площади соприкосновения имплантата со стенкой влагалища. Далее к боковым сторонам, отступя 1,0–1,5 см от углов, прилегающих к широкому основанию трапеции, нерассасывающейся нитью (пролен, монофил) 2/0 симметрично фиксировали полипропиленовые рукава: один – справа, другой – симметрично слева (рис. 4).
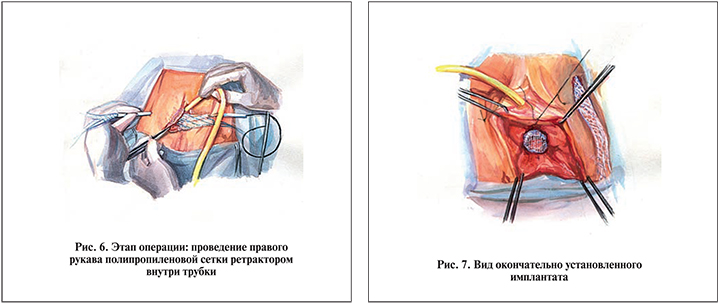
Передний край сетчатого полипропиленового имплантата фиксировали к лобково-шеечной фасции у переднего разреза влагалища рассасывающимися швами (викрил 2/0), а задний край – нерассасывающимся шовным материалом (пролен 2/0, монофил 2/0) к парацервикальным тканям (или при влагалищной гистерэктомии к шву по МакКоллу; рис. 5).
Левый и правый рукава полипропиленовой сетки проводили ретракторами внутри трубчатых проводников (канюль) изнутри (со стороны влагалища) наружу (рис. 6). Сетчатый полипропиленовый имплантат окончательно расправляли и без натяжения устанавливали под заднюю стенку мочевого пузыря (рис. 7).
При наличии ректоцеле, требующего оперативного лечения, проводили стандартную операцию с использованием перфорированного полипропиленового имплантата с учетом тех же принципов, что и при коррекции цистоцеле.
Слизистую влагалища ушивали непрерывным швом рассасывающимся шовным материалом без иссечения слизистой влагалища. Трубчатые проводники (канюли) извлекали. Избыток рукавов сетчатого протеза отсекали подкожно. Влагалище туго тампонировали стерильными салфетками, смоченными раствором антисептика.
Таким образом, к особенностям разработанного способа коррекции ПГ относятся: использование только двух рукавов, перфорирующих обтураторные отверстия; кольпотомия без иссечения слизистой и субфасциального расположения полипропиленовой сетки с тщательным расправлением ее без натяжения и надежной фиксацией; использование сверхлегкого полипропиленового имплантата с наличием перфорационных отверстий; изготовление сетчатого имплантата индивидуальных размеров, что позволяет перекрывать дефекты фасции; дополнительная фиксация заднего края полипропиленовой сетки к парацервикальным тканям или при влагалищной гистерэктомии к шву по Макколлу.
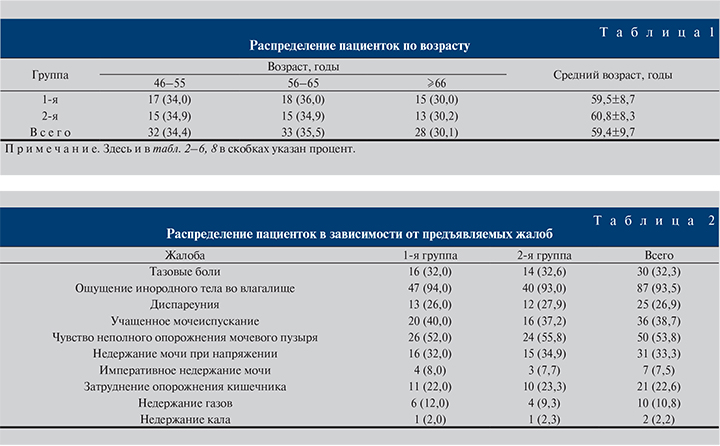
Возраст пациенток варьировался от 46 лет до 71 года (табл. 1).
Как видно из табл. 1, пациентки были сопоставимыми по среднему возрасту (p=0,42). Распределение пациенток по возрастным категориям также оказалось примерно одинаковым (p>0,05).
Средняя продолжительность заболевания составила 7,5±6,0 лет в 1-й группе и 5,9±4,2 года – во 2-й (p>0,05). Первые симптомы ПГ у пациенток 1-й группы появились в среднем в возрасте 51,1±5,4, 2-й – 50,9±8,8 года (p>0,05). У 20 (40%) пациенток 1-й группы, у 18 (41,9%) – 2-й первые проявления ПГ развились в возрасте до 55 лет.
По результатам опроса пациенток были выделены наиболее характерные жалобы, которые отражали степень вовлечения в процесс тазовых органов (табл. 2).
Как видно из табл. 2, жалобы в группах встречались с сопоставимой частотой (р>0,05); наиболее распространенной была жалоба на дискомфорт и ощущение инородного тела во влагалище.
Особенностей менструальной и детородной функций у обследованных женщин отмечено не было. Пациенток в менопаузе в 1-й группе было 45 (90%), во 2-й – 37 (86%; p>0,05), средняя длительность менопаузы составила 10,2±8,6 и 10,6±9,4 года соответственно (p>0,05). Изучение структуры и встречаемости гинекологических заболеваний показало отсутствие статистически значимых различий в группах.

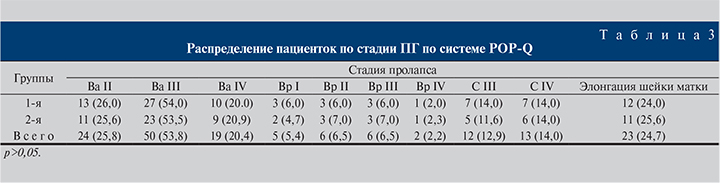
Распределение пациенток по стадиям пролапса по системе POP-Q представлено в табл. 3.
Всем пациенткам в пред- и послеоперационном периодах наряду с традиционным клиническим обследованием проводились гинекологический осмотр с оценкой степени ПГ по классификации POP-Q; ректальное исследование с оценкой состояния стенок прямой кишки и анального сфинктера, функциональные пробы при недержании мочи. Всем женщинам осуществляли цитологическое исследование мазков с экзо- и эндоцервикса для исключения заболеваний шейки матки, расширенную кольпоскопию, ультрасонографическое исследование органов малого таза, мочевыделительной системы и тканей промежности, магнитно-резонансную томографию малого таза. Инструментальные исследования – цистоскопию, урофлоуметрию и гистероскопию – выполняли по показаниям.
Всем пациенткам проводили эхографическое исследование тазового дна с применением трансвагинального и высокочастотного линейного датчиков. У 35 (70%) пациенток 1-й группы и у 29 (67,4%) – 2-й (p>0,05) выявлены признаки недостаточности тазового дна: истончение мышечных пучков ножек мышц-леваторов (m. bulbocavernosus), диастаз мышц в области сухожильного центра, деформация или отсутствие сухожильного центра, что свидетельствует о несостоятельности тазового дна.
Дефекты тазовой фасции диагностированы у пациенток с сопоставимой частотой (р>0,05).

Предоперационная подготовка пациенток с ПГ не отличалась от стандартной, включая коррекцию нарушений флоры влагалища с восстановлением нормального биоценоза и (по показаниям) местную терапию эстрогенами для улучшения репарации тканей.
При оперативном лечении ПГ проводили одномоментную коррекцию всех выявленных анатомических и функциональных проблем тазового дна с восстановлением нормального анатомического положения органов малого таза и их функций. Одновременно с экстраперитонеальной кольпопексией полипропиленовым имплантатом по показаниям были выполнены сочетанные операции. Основным показанием к гистерэктомии стало наличие сопутствующих заболеваний матки и придатков (табл. 4).
Статистическую обработку материала проводили на персональном компьютере AMD Athlon™ XP 1800 с использованием программного обеспечения Microsoft Windows XP Professional, версия 2002 Service Pack 2, статистического раздела электронной таблицы Microsoft Excel 2007.

Рассчитывали следующие показатели: среднее арифметическое (М); стандартное отклонение (СО); коэффициент вариации; асимметрию и эксцесс с оценкой их репрезентативности по t-критерию Стьюдента; коэффициент корреляции (r); степень вероятности возможной ошибки (p). При оценке существенности различий между средними величинами вычисляли коэффициент достоверности по критериям Стьюдента. За уровень достоверности была принята вероятность различия 95,0% (р≤0,05). Для выявления доли факториального и случайного влияния проводили дисперсионный анализ полученных результатов.
Коэффициент корреляции и его достоверность рассчитывали по Браве–Пирсон, где 0,3–0,5 – умеренная, 0,5–0,7 – значительная и 0,7–0,9 – сильно выраженная связь.
Результаты и обсуждение. Контрольное обследование пациенток проводили спустя 1, 3, 6 и 12 мес после операции, затем ежегодно. Отдаленные результаты оперативного вмешательства были прослежены в сроки от 1 года до 5 лет.
Длительность оперативного вмешательства во многом зависела от объема операции и была сопоставимой (p>0,05): 55,7±19,7 и 57,6±21,9 мин в 1-й и 2-й группах соответственно. Средняя интраоперационная кровопотеря во 2-й группе в 1,3 раза (р<0,05) превышала таковую в 1-й группе, составив 238,1±52,2 и 182,4±63,9 мл соответственно.
Все осложнения, возникшие при коррекции ПГ, были разделены на общехирургические (интраоперационные и ранние послеоперационные), mesh-ассоциированные, функциональные и рецидивы ПГ, не связанные с дефектом установки сетчатого имплантата (табл. 5) [6, 10, 14].

Общехирургические осложнения в 1-й группе встречались в 4,1 раза реже, чем у пациенток 2-й группы. Интраоперационные кровотечения объемом более 300 мл останавливали тугой тампонадой влагалища; гемотрансфузий не потребовалось. Во всех случаях ранения мочевого пузыря зашивали его стенку, после чего устанавливали полипропиленовый имплантат.
Гематомы промежности и влагалища, диагностированные в послеоперационном периоде по данным УЗИ, у 1 (2%) пациентки 1-й группы и у 4 (9,3%) – 2-й, не превышали размеров 4х2 см, рассасывались самостоятельно и бесследно. Однако у 1 пациентки 2-й группы была выявлена гематома объемом 100 мл, расположенная между сетчатым имплантатом и стенкой влагалища, которая была дренирована между швами и не потребовала дополнительной операции.
Наиболее частым специфическим mesh-ассоциированным осложнением во 2-й группе была эрозия стенки влагалища, которая наблюдалась у 4 (9,3%) пациенток, что в 4,7 раза чаще, чем в 1-й группе. Всем пациенткам эрозивный дефект устранен консервативно. У 1 (2,3%) пациентки 2-й группы через 3 мес после операции выявлена эрозия слизистой мочевого пузыря и было произведено эндовезикальное отсечение проленовых нитей, выступивших в полость мочевого пузыря, с последующей комплексной противовоспалительной терапией.
Абсцесс Ретциева пространства, возникший у 1 пациентки 2-й группы, был вскрыт и дренирован, назначена антибактериальная терапия, удаления имплантата не потребовалось.
После коррекции ПГ отмечено уменьшение частоты специфичных жалоб у пациенток всех групп. Так, на дискомфорт и ощущение инородного тела во влагалище в 1-й группе жаловались реже, чем до операции, на 84%, во 2-й – на 72%, на поллакиурию – на 40 и 30,2%, на чувство неполного опорожнения мочевого пузыря – на 52 и 48,8% реже соответственно. Частота встречаемости запоров у пациенток 1-й и 2-й групп снизилась в 2 раза.

Тазовые боли в раннем (1-е сутки) послеоперационном периоде присутствовали у всех пациенток и купировались назначением НПВС. У 2 (4,7%) пациенток 2-й группы боли во влагалище, промежности и внутренней поверхности бедер сохранялись более 3 мес, что потребовало длительного назначения НПВС и выполнения лечебной блокады с использованием нейролитических препаратов в область источника болевого импульса.
Таким образом, послеоперационные осложнения, за исключением рецидива развития ПГ, в 1-й группе констатировали в 3 (6%) наблюдениях, во 2-й – в 18 (41,9%).
Говоря о структуре рецидивов ПГ (табл. 6), необходимо отметить, что анатомическим (объективным рецидивом ПГ мы считали появление пролапса II и последующих стадий по классификации POP-Q.
В 1-й группе у 5 (10 %) пациенток диагностирован рецидив ПГ в виде ректоцеле в неоперированном (противоположном) отделе. У 3 (7%) пациенток 2-й группы рецидив цистоцеле развился из-за сморщивания сетчатого имплантата. При вагинальном осмотре выявлено опущение передней стенки влагалища, а ранее установленные имплантаты представляли собой натянутые тяжи. У 5 (11,6%) пациенток 2-й группы диагностирован рецидив ПГ в неоперированном (противоположном) отделе (в 4 случаях диагностировано ректоцеле, в 1 – элонгация шейки матки).
По данным ультрасонографического исследования тазового дна пациенток двух групп (табл. 7, 8), через 6 мес после операции отмечено статистически значимое улучшение показателей высоты сухожильного центра и диастаза леваторов по сравнению с дооперационными значениями, при этом ширина m. bulbocavernosus оставалась неизменной.
Число пациенток с ультразвуковыми признаками дефекта лобково-шеечной фасции после операции статистически значимо снизилось в обеих группах.
Таким образом, улучшение ультразвуковых показателей структур тазового дна и устранение дефектов лобково-шеечной и ректовагинальной фасций после операции у пациенток обеих групп свидетельствуют о высокой эффективности вагинальной экстраперитонеальной кольпопексии полипропиленовым имплантатом. Причиной развития рецидива цистоцеле у 3 (3,2%) пациенток 2-й группы стало сморщивание сетчатого имплантата, чего не произошло при коррекции ПГ разработанным способом вагинальной экстраперитонеальной кольпопексии перфорированным полипропиленовым имплантатом.
Результаты оперативного лечения ПГ спустя 12 мес были оценены как хорошие (полное восстановление функциональных изменений и отсутствие рецидива ПГ) у 41 (82%) пациентки 1-й группы и у 32 (74,4%) – 2-й; удовлетворительные (полное восстановление функциональных изменений, но имелся рецидив ПГ I–II стадий) – у 4 (8%) и 6 (14%) пациенток соответственно; неудовлетворительные (сохранение или усугубление стадии тазового пролапса и/или сохранение функциональных изменений) – у 5 (10%) и 5 (11,6%) пациенток соответственно.
Заключение. Разработанный нами способ вагинальной экстраперитонеальной кольпопексии перфорированным сверхлегким (поверхностная плотность – 19 г/м2) полипропиленовым имплантатом позволил избежать рецидива ПГ в оперированном отделе и статистически значимо снизить частоту встречаемости общехирургических осложнений в 4,1 раза, частоту эрозии стенки влагалища в 4,2, частоту гематом промежности и влагалища в 4,7 раза по сравнению с пациентками с ПГ, оперированными с использованием стандартного троакарного набора с легким (поверхностная плотность – 42,7 г/м2) полипропиленовым имплантатом.



