Введение. Мочекаменная болезнь (МКБ) – распространенное урологическое заболевание, которым в современном мире страдает около 10–15% населения развитых стран [1]. Основной формой МКБ является кальций-оксалатный нефролитиаз, поскольку около 60% всех почечных камней состоят преимущественно из кальций-оксалатных биоминералов. Фармакологические методы лечения МКБ довольно ограничены, поэтому в медицине до сих пор существует высокая потребность в разработке новых методов лечения МКБ при помощи лекарственных средств.
Ранее нами экспериментально была подтверждена гипотеза, будто сырье из свиных почек препятствует образованию почечных конкрементов и поэтому может считаться перспективным природным объектом для разработки нового антилитогенного средства [2]. Эти данные легли в основу широкого междисциплинарного проекта в Алтайском государственном медицинском университете, целью которого стало повышение качества медикаментозного лечения МКБ путем создания и внедрения в практику эффективного и безопасного лекарственного средства.
В рамках проекта необходимо было выяснить: с помощью каких методов возможна фармакотехнологическая обработка сырья из свиных почек для получения субстанции, пригодной для доклинического исследования в качества средства, используемого при МКБ? Первоначально для этого было решено получить биомедицинскую субстанцию из сырья свиных почек методом лиофильной сушки – одним из наиболее щадящих технологических методов обработки природного сырья, и апробировать антилитогенную активность полученной субстанции на модели экспериментальной МКБ. Кроме того, мы решили оценить эффективность этого способа медикаментозной коррекции МКБ по сравнению с натрия цитратом – одним из основных препаратов, используемых сегодня для лечения МКБ.
Цель настоящего исследования – провести сравнительную оценку антилитогенной активности биомедицинской субстанции из свиных почек, полученной путем лиофильной сушки, и натрия цитрата.
Материалы и методы. Эксперименты проведены на 45 самцах крыс сток Вистар массой 220–280 г, которые на протяжении всего эксперимента находились в индивидуальных метаболических клетках на стандартном лабораторном пищевом рационе. Животные были разделены на 3 группы по 15 крыс. С целью моделирования МКБ в контрольной группе крысы в течение 6 нед получали в виде питья 1%-ный раствор этиленгликоля [3]. В группе сравнения животным аналогично предоставлялся в свободном доступе 1%-ный раствор этиленгликоля, но при этом начиная с 4-й недели вплоть до конца эксперимента им ежедневно через зонд вводили внутрь раствор натрия цитрата в дозе 300 мг/кг.

В опытной группе животным начиная с 4-й недели на фоне продолжающегося потребления этиленгликоля в течение последующих 3 нед в пищевой рацион включали биомедицинскую субстанцию из свиных почек в дозе 1 г на крысу. Раз в неделю собирали суточный объем мочи с целью определения основных биохимических и морфологических показателей нефролитиаза: концентрации в моче ионов оксалата и кальция, активности маркерных ферментов повреждения почечного эпителия – лактатдегидрогеназы (ЛДГ), γ-глютамилтрансферазы (ГГТ) и N-ацетил-β-D-глюкозаминидазы (НАГ). По окончании эксперимента часть крыс декапитировали и определили в почечной ткани показатели оксидантного статуса (содержание в почках тиобарбитуратреактивных продуктов [ТБРП] и общей прооксидантной активности – ОПА) и активности антиоксидантных ферментов: глутатионпероксидазы (ГПО), супероксиддисмутазы (СОД) и каталазы (КАТ); кроме того, гистохимическим методом Косса определяли количество и размер кальциевых депозитов, формирующихся в области почечного сосочка.
Статистическую обработку провели с помощью программы «Statistica for Windows 6.0». Рассчитали среднее значение, стандартную ошибку, для выявления статистической значимости различий использовали критерий Манна–Уитни [4].

Результаты. Во всех трех группах животных уже к концу 3-й недели этиленгликолевой нагрузки определились типичные биохимические признаки оксалатного нефролитиаза. Так, наблюдалось пересыщение мочи оксалат-ионами на уровне 1–1,5 мг/мл (табл. 1) и 2–3-каратное увеличение активности маркерных ферментов в моче относительно исходного уровня (табл. 2). В течение последующих 4–6 нед опыта в контрольной группе продолжалось развитие нефролитиаза, вследствие чего на 42-й день наблюдения активность маркерных ферментов у этих крыс превысила исходный уровень в 3–4 раза, фиксировались четкие признаки оксидативного стресса в почечной ткани, маркером чего стало 8-кратное увеличение концентрации ТБРП в почечной ткани относительно здоровых животных и снижение активности ГПО, главного антиоксидантного фермента, на 25,1% (табл. 3, p<0,001). Результаты морфометрии в контроле заболевания показали наличие в области почечного сосочка кальциевых депозитов, среднее количество которых равнялось 27,4±3,23 в поле зрения, а их средний размер составил 12,0±0,62 мкм.
В то же время у крыс, получивших натрия цитрат, ожидаемо происходило ослабление литогенных процессов. Как видно из табл. 2, активность ЛДГ к моменту завершения эксперимента была ниже контрольных значений в 2,8 раза, ГГТ – в 3,0; НАГ – в 3,8 раза (для всех p<0,001). Параллельно наблюдалось снижение концентрации ТБРП в почечной ткани в 3,8 раза относительно контрольной группы и рост активности ГПО вплоть до уровня здоровых крыс (табл. 3). Наконец, результаты морфометрии показали, что 3-недельное применение натрия цитрата привело к снижению количества кальциевых депозитов в 3,4 раза относительно контроля, а их среднего размера – в 1,9 раза (табл. 4, в обоих случаях p<0,001). Добавим также, что на фоне натрия цитрата происходило двукратное снижение мочевой концентрации иона кальция (табл. 1). Полученные результаты согласуются с общеизвестными сведениями об эффективности натрия цитрата при МКБ.
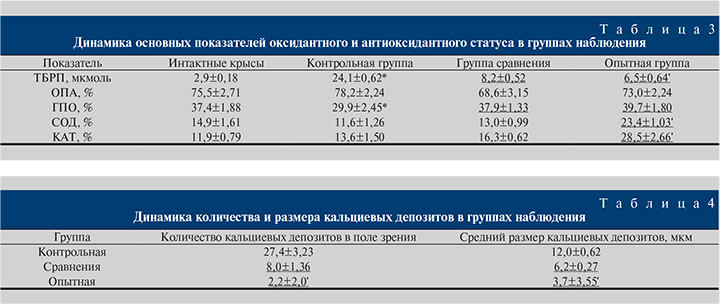
Трехнедельный курс назначения животным биомедицинской субстанции из свиных почек сопровождался следующими изменениями. Активность ЛДГ к моменту окончания эксперимента уступала уровню контрольной группы в 5,3 раза (табл. 2). При этом величина описываемого показателя в подопытной группе была ниже таковой в группе сравнения в 1,9 раза (p<0,001). Активность НАГ была меньше, чем в контроле, в 3,8 раза, полностью соответствуя группе сравнения.
Кроме того, под влиянием исследуемой биомедицинской субстанции концентрация ТБРП снизилась в 3,7 раза относительно контроля, став при этом ниже таковой в группе сравнения на 26,2%. Параллельно существенно возросла активность всех трех антиоксидантных ферментов (табл. 3). И если активность ГПО, равно как и в группе сравнения, повысилась до уровня здоровых животных, активность СОД увеличилась относительно интактных крыс в 1,6 раза, относительно контроля заболевания – в 2,0 и относительно группы сравнения – в 1,8 раза (во всех случаях p<0,01). Активность КАТ выросла в 2,4; 2,1 и 1,7 раза соответственно (во всех случаях p<0,01).
Наконец, по результатам морфометрии оказалось, что после применения биомедицинской субстанции из свиных почек количество кальциевых депозитов уменьшилось относительно контроля заболевания в 12,5 раза – до 2,2±2,0 в поле зрения (см. табл. 4), что было меньше, чем в группе сравнения, в 3,6 раза (p<0,001). При этом средний размер кальциевых депозитов в подопытной группе составил 3,7±3,55 мкм, что в 3,2 раза уступало уровню контрольной группы и в 1,7 – уровню группы сравнения (p<0,05).
Обсуждение. В ходе настоящего исследования продемонстрировано довольно ощутимое превосходство биомедицинской субстанции из свиных почек над натрия цитратом по выраженности литогенного эффекта.
Во-первых, более выраженно ослаблялся фактор повреждения нефроцитов, играющий существенную роль в формировании первичного очага литогенеза [5]. Об этом свидетельствовало в 2 раза более выраженное снижение активности ЛДГ – фермента, характеризующего степень цитолиза почечных клеток.
Кроме того, различия были зафиксированы в характере антиоксидантного действия испытуемых веществ. Оказалось, что концентрация ТБРП – основного маркера перекисного окисления мембранных фосфолипидов после применения биомедицинской субстанции из свиных почек снижалась на четверть интенсивнее, нежели на фоне натрия цитрата. Не исключено, что это было обусловлено активацией антиоксидантных ферментов СОД и КАТ, чего не происходило при применении натриевой соли лимонной кислоты. Как известно, указанные ферменты служат «ловушкой» для активных форм кислорода (АФК), нейтрализуя их и снижая деструктивное влияние на клеточные структуры нефроцитов [6]. Можно предположить, что тканевой материал свиных почек содержит биологически активные вещества, способные стимулировать ферментную защиту против АФК, чего не наблюдается при использовании натрия цитрата.
Итогом наблюдаемых процессов стало значительно более выраженное под влиянием биомедицинской субстанции из свиных почек снижение количества и размера кальциевых депозитов по сравнению с натрия цитратом.
С одной стороны, это могло стать следствием превалирующего нефропротекторного действия, поскольку фактор повреждения тканей почки имеет существенное значение для формирования первичного очага литогенеза с последующим формированием на нем под действием движущих сил кристаллизации почечного конкремента [5]. С другой стороны, нельзя не принимать во внимание возможность активации внутрипочечного ингибирования кристаллизации. Как известно, существенную роль в сдерживании литогенных процессов играют внутрипочечные ингибиторы кристаллизации – белковые молекулы, препятствующие адгезии и агрегации кристаллического материала в моче [7, 8]. Пептиды тканевого материала свиных почек прямо или опосредованно могут вносить вклад в указанный процесс.
Заключение. Результаты проведенного исследования свидетельствуют о высокой антилитогенной активности биомедицинской субстанции из свиных почек, превосходящей таковую цитрата натрия. Полученные данные позволяют продвинуться в понимании дальнейших направлений разработки нового высокоэффективного лекарственного средства для лечения МКБ на основе сырья из свиных почек.


