Введение. Пиелонефрит – наиболее частое неспецифическое заболевание почек во всех возрастных группах. Заболеваемость среди взрослого населения составляет 100 на 100 тыс. человек [1]. Среди всех урологических заболеваний острый пиелонефрит встречается чаще и составляет 14% в структуре болезней почек. Гнойные его формы могут развиваться у трети пациентов. Частота нефрэктомий по поводу гнойного пиелонефрита в отдельных клиниках достигает 40–50% [2].
В последние годы отмечается увеличение частоты случаев пиелонефрита, в том числе его гнойных форм, нередко регистрируют атипичное его течение. Обусловлено это как улучшением диагностики, так и резко возросшей вирулентностью микроорганизмов в результате приобретенной ими устойчивости к антибиотикам, а также изменением течения инфекционного процесса в почке вследствие подавления иммунных реакций, наличия у больных сенсибилизации и суперинфекции [3].
Проблема заболеваемости острым пиелонефритом не теряет своей актуальности и по сей день. Это подтверждается тем, что анализу эффективности лечебно-диагностических и профилактических мероприятий неоднократно посвящались пленумы урологов России, межрегиональные конференции [4].
Многообразие форм острого пиелонефрита осложняет их диагностику и лечение. Нередко трудно отличить тяжелое течение серозной стадии острого пиелонефрита от начальных проявлений формирования гнойных очагов. Для решения этой проблемы необходимо представлять патогенетический процесс развития острого необструктивного пиелонефрита.
В патогенезе формирования острого необструктивного пиелонефрита выделяют несколько этапов развития:
- повторяющаяся кратковременная бактериемия. При этом повреждается мембрана гемокапилляров клубочков, которая становится проницаемой для микроорганизмов;
- некоторое количество бактерий проходит через мембрану и попадает в просвет капсулы, а далее в просвет извитого канальца I порядка;
- микроорганизмы, попавшие в просвет капсулы клубочка и извитого канальца I порядка, начинают быстро размножаться благодаря наличию благоприятной среды с содержанием глюкозы первичной мочи;
- начинается массивная агрессия бактерий против клеток канальцевого эпителия, бурная лейкоцитарная реакция; клетки эпителия канальцев распадаются и гибнут. Базальная мембрана разрывается. Инфицированное содержимое извитого канальца II порядка проникает в межуточную ткань почки, что ведет к формированию первичных перитубулярных инфильтратов [5].
Эти изменения характерны для серозной стадии пиелонефрита. Картина УЗИ при этой стадии зависит от длительности и тяжести течения заболевания. Так, при легком течении процесса по УЗИ изменений не определяется. При тяжелом, длительном течении серозной стадии пиелонефрита отмечается утолщение паренхимы, нарушение кортикомедуллярной дифференцировки и появление зон пониженной эхогенности с нечеткими контурами. По данным допплерографии определяется ухудшение кровообращения в зоне пониженной эхогенности с нечеткими контурами и усиления периферического сопротивления в огибающих сосудах.
Дальнейшее развитие патологического процесса может идти тремя путями: 1) при нагноении перитубулярных инфильтратов образуются гнойники в поверхностных слоях коркового вещества почки – апостемы; 2) отдельные апостемы могут сливаться, отграничиваться соединительнотканным валом, превращаясь в абсцессы; 3) при отсутствии нагноения, но продолжающемся воспалении в процесс вовлекаются внутрипочечные артерии с последующим их частичным или полным тромбозом и формированием зоны ишемии, при инфицировании которой образуется карбункул почки.
Общепринятый алгоритм лечения гнойных форм пиелонефрита формировался десятки лет и предусматривал хирургическую санацию гнойных очагов, декомпрессию мочевых путей, проведение антибактериальной и дезинтоксикационной терапии. При этом не проводилось воздействия на зону ишемии и формирующегося воспалительного очага, было затруднено проникновение антибактериальных препаратов, не контролировался кровоток в пораженной зоне. В настоящее же время все чаще появляется информация о возможностях консервативной терапии гнойного пиелонефрита [6].
Своевременное дренирование и правильно подобранная патогенетическая терапия, проводимые в инфильтративную стадию, способствуют предупреждению развития гнойных деструктивных форм заболевания в 98,7% наблюдений. А.В. Айвазян и соавт. [7] отметили, что глубокие гемостазиологические и микроциркуляторные нарушения одновременно нарушают соотношение белков, крови и снижают уровень иммуноглобулинов. В свою очередь восстановление кровообращения в зоне ишемии позволяет улучшить процессы фагоцитоза, ускорить элиминацию продуктов распада из очага воспаления, улучшить доставку антибактериальных и антикоагулянтных препаратов в дистальные отделы очага воспаления.
В реализации антитромботического действия большая роль принадлежит белкам крови – фибронектину (ФН) и антитромбину III.
Фибронектин – один из медиаторов, играющих важную роль в процессе иммунного воспаления, входит в состав экстрацеллюлярного матрикса почки и всегда вовлекается в патологический процесс. В основном продуцируется клетками печени, но почки также участвуют в его метаболизме, а гломерулярные клетки сами способны его продуцировать. Фибронектин принимает активное участие в воспалительных реакциях и фагоцитозе [8]. Кроме того, он участвует в таких физиологических процессах, как коагуляция, фибринолиз, репарация тканей, восстановление микроциркуляции, регуляция клеточных взаимодействий [9].
Антитромбин III – специфический белок системы свертывания крови. Основной его функцией является инактивация нескольких основных факторов свертывания, таких как FVIII, VWF и FXIII, в том числе тромбина, и недопущение повышенного образования кровяных сгустков (тромбов). За счет этого он улучшает микроциркуляцию в пораженной зоне и препятствует образованию тромбов в поврежденных сосудах.
При недостатке этих белков применяется криопреципитат.
 Криопреципитат представляет собой протеиновый комплекс, полученный из плазмы, содержащий высокую концентрацию фибриногена, FVIII, VWF и FXIII. Также он содержит ФН, антитромбин III, иммуноглобулины, белки системы комплемента [10].
Криопреципитат представляет собой протеиновый комплекс, полученный из плазмы, содержащий высокую концентрацию фибриногена, FVIII, VWF и FXIII. Также он содержит ФН, антитромбин III, иммуноглобулины, белки системы комплемента [10].
Кроме того, криопреципитат оказывает бактериостатическое действие [11], способствует уменьшению воспалительного процесса, улучшению кровоснабжения и репаративных процессов в пораженной области [12]. Криопреципитат применяется в нашем отделении с 2000 г. Ежегодно увеличивается количество больных острым гнойным пиелонефритом, соответственно увеличивается и количество больных, получающих криопреципитат. Включая в комплексную терапию больных криопреципитат, мы стремимся к уменьшению числа оперируемых больных. В среднем в год терапию с криопреципитатом получают 84 больных.
Впервые результаты по использованию криопреципитата в комплексном лечении больных пиелонефритом были опубликованы нами в 2005 г. [13].
Целью нашего исследования стало изучение эффективности применения криопреципитата в комплексной консервативной терапии больных острым гнойным необструктивным пиелонефритом.
Материалы и методы. Был проведен ретроспективный анализ историй болезни пациентов с диагнозом «острый необструктивный пиелонефрит». С 2007 по 2015 г. на базе кафедры урологии были пролечены 3912 больных острым необструктивным пиелонефритом. Средний возраст пациентов составил 33 года.
При поступлении всем больным проведена оценка тяжести состояния:
- учтены выраженность клинических проявлений; нарушение сознания; интенсивность болей при пальпации почек, время их возникновения; колебания температуры тела; изменение АД; ЧСС; ЧДД;
- также учтены функциональные методы обследования (УЗИ, обзорная и внутривенная урография. МСКТ, МРТ почек проведено только в сложных диагностических наблюдениях);
- лабораторный контроль анализов крови (общий и биохимический анализы крови) и мочи (общий анализ и бактериологический посев);
- учтена длительность заболевания от повышения температуры тела и болей в поясничной области до госпитализации, наличие сопутствующей патологии и предшествующих заболеваний.
Всех проанализированных пациентов мы разделили на две большие группы в зависимости от того, использовался ли криопреципитат в комплексном консервативном лечении (первая группа), или нет (вторая группа). В каждой группе определено число пациентов, которым удалось избежать оперативного вмешательства и для которых терапия оказалась не эффективной.
Комплексное консервативное лечение пациентов обеих групп включило антибактериальную, дезинтоксикационную, противовоспалительную терапию. В первой группе в качестве источника ФН, антитромбина III, иммуноглобулинов применен криопреципитат.
В течение нескольких лет эмпирически подбиралась доза криопреципитата и длительность лечения. В результате полученных данных больным вводился криопреципитат от 3 до 5 доз внутривенно в зависимости от массы тела и тяжести состояния больного ежедневно в течение 3–5 дней [12].
Антибактериальную терапию при поступлении назначали эмпирически и при необходимости корректировали после получения результата бактериологического посева мочи с учетом чувствительности микрофлоры к антибиотикам. Использовали антибактериальные препараты широкого спектра действия: цефалоспорины III и IV поколения, фторхинолоны, аминогликозиды как в монотерапии, так и в их сочетании в зависимости от тяжести состояния. Антибактериальную терапию продолжали в среднем в течение 3–4 дней после нормализации температуры тела. Контроль эффективности осуществлен на 5-й, 10 и 20-й день терапии и включил общий анализ крови и мочи.
Результаты. В первую группу вошли 756 (19,3%) человек, из них 149 (19,7%) мужчин и 607 (80,3%) женщин, которые в составе комплексной терапии пиелонефрита получали криопреципитат. В данную группу отбирались больные с тяжелым течением заболевания.
У 476 (62,9 %) человек по данным УЗИ отмечены утолщение коркового слоя почки и единичные и множественные гипо- и изоэхогенные очаги с обедненным кровотоком в паренхиме почки, а также отек паранефральной клетчатки. Лабораторные показатели в среднем: Hb 124,1 г/л, L 14,9×109, СОЭ 35,6 мм/ч, уровень лейкоцитов в моче в среднем: покрывает все поля зрения.
У 280 (37,04%) пациентов при УЗИ выявлено незначительное увеличение размеров почки, повышение эхогенности околопочечной клетчатки, незначительное утолщение коркового слоя почки без патологических очагов. Лабораторные показатели в среднем: Hb 130,2 г/л, L 12,8×109, СОЭ 26,3 мм/ч, уровень лейкоцитов в моче в среднем: большое количество.
По данным внутривенной урографии признаков нарушения оттока мочи не было в обеих подгруппах, но отмечено умеренного замедления выделительной функции почки на стороне поражения на 7-й и 12-й минутах. По данным МСКТ и МРТ у 173 (36%) человек подтверждены карбункулы почки, у 96 (21,5%) – апостематозный пиелонефрит. При апостематозном пиелонефрите по данным УЗИ визуализируются лишь косвенные признаки патологии.
В группе получавших криопреципитат был прооперирован лишь 21 (2,7 %) больной. Из них у 7 обнаружены абсцессы почки, у 9 – карбункулы почки, у 5 – апостематоз почки. Пациенты были оперированы в среднем на 4-е (3–6-е) сутки. Нормализация лабораторных анализов наступала в среднем на 5,3-х суток. По УЗИ нормализация толщины коркового слоя, восстановление кровотока в зоне ишемии патологических очагов приходили в норму на 4,7-х суток. Период пребывания больных в стационаре составил в среднем 10 сут.
Вторую группу составили 3156 (80,7%) пациентов, из них 391 (12,4%) мужчина и 2765 (87,6%) женщин, которые получали комплексное консервативное лечение без применения криопреципитата. В данную группу вошли пациенты с легким течением острого пиелонефрита (анамнез до 1–2 сут, подъем температуры тела до 37,3–38°С, лейкоцитоз 9–11×109, в общем анализ мочи лейкоцитов 10–15) и пациенты, у которых по данным дополнительных методов обследования при поступлении в стационар определен гнойный пиелонефрит (сформированные карбункулы почки, абсцессы).
Получали комплексную терапию и не были подвергнуты оперативному лечению 2974 (94,2%) человека. Среди них у 55 (1,85 %) по данным УЗИ отмечено утолщение коркового слоя почки без признаков деструкции. У остальных пациентов изменений по данным УЗИ и внутривенной урографии отклонений не выявлено. Лабораторные показатели в среднем: Hb 132,1 г/л, L 10,7×109, СОЭ 19,3 мм/ч, уровень лейкоцитов в моче в среднем: 13,9.
Нормализация ультразвуковой картины наступала в среднем на 4,6-х суток, лабораторных анализов – на 5,4-х суток.
В 182 (5,8%) наблюдениях консервативное лечение оказалось неэффективным, и потребовалась операция. У всех больных этой подгруппы отмечено замедление выделительной функции почек по данным экскреторной урографии, нарушение подвижности почки. При УЗИ у 147 человек визуализировались гипо-, изо- и анэхогенные очаги в паренхиме почки с обедненным кровотоком, утолщения коркового слоя почки, паранефральный отек, у 35 человек наличие полостей абсцесса почки. Лабораторные показатели в среднем: Hb 125,4 г/л, L 13,7×109, СОЭ 30,3 мм/ч, уровень лейкоцитов в моче в среднем: покрывают все поля зрения.
Среди прооперированных у 98 (53,8%) человек выявлен карбункул почки, у 35 (19,2%) – абсцесс почки, у 49 (26,9%) – апостематозный пиелонефрит.
Больные второй группы подвергались оперативному лечению в среднем на 3-и (1–5-е) сутки в зависимости от состояния.
Нормализация лабораторных показателей наступала в среднем на 9,6-х суток. Контроль УЗИ почек в послеоперационном периоде не проводился.
Выписка больных в среднем происходила на 12,5-х суток госпитализации.
В качестве иллюстрации приводим клиническое наблюдение.
П а ц и е н т к а Ч. 36 лет поступила в урологическое отделение ГБ № 11 12.09.08 по скорой помощи с жалобами на боли в поясничной области справа, повышение температуры тела до 39,9°С, учащенное мочеиспускание с резью. Из анамнеза: больна в течение 3 сут, когда появились боли в поясничной области справа, частое мочеиспускание с резью, повышение температуры тела до 39,9°С. Обратилась в поликлинику, направлена в дежурный урологический стационар.
Хронические заболевания: последние 5 лет страдает хроническим тонзиллитом.
При поступлении состояние тяжелое. Сознание ясное. Поведение адекватное. Питание нормальное. Кожные покровы чистые, обычной окраски. Периферические лимфоузлы не увеличены. Живот не вздут, мягкий, участвует в акте дыхания, отмечается умеренная болезненность в проекции правой почки. Симптомы раздражения брюшины отрицательные. Селезенка, печень не увеличены. Пальпация правой почки болезненна. Симптом поколачивания положительный справа.
Общий анализ крови: эритроциты 4,6×1012/л, Hb 125 г/л, л. 24,2 г/л, э. 1%, п. 8%, с. 80%, лимф. 7%, м. 4%, СОЭ 40 мм/ч. Биохимический анализ крови: билирубин 12 ммоль/л, глюкоза 5,4 ммоль/л, мочевина 7,2 ммоль/л, общий белок 67,5 г/л, креатинин 0,07 ммоль/л. Фибриноген 5 г/л. Общий анализ мочи: белок 0,132, лейкоциты сплошь покрывают все поля зрения.
Бактериальный посев мочи от 11.09.08 отрицательный.
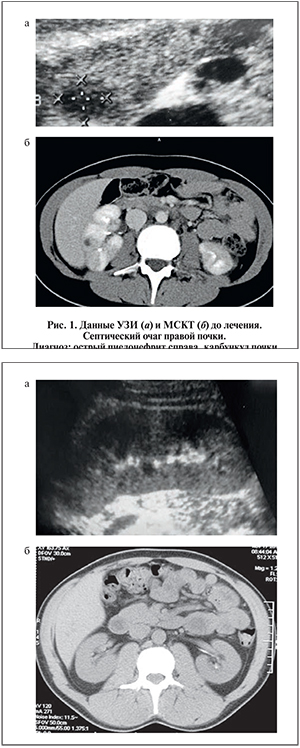
УЗИ почек от 12.09.08: увеличение размеров правой почки с отеком паранефральной клетчатки. Нарушение кортико-медуллярной дифференцировки с неоднородным снижением эхогенности. В проекции нижнего полюса правой почки лоцируется гипоэхогенный участок с неровными, размытыми контурами диаметром 32 мм (септический очаг?) При допплерографии отмечается резкое снижение кровотока в этой области.
Данные МСКТ от 12.09.08: формирующийся карбункул правой почки (рис. 1).
Назначено лечение: цефотаксим 2 г 2 раза в день внутривенно, гентамицин 160 мг 1 раз в день вутривенно, глюкоза 5% 400 внутривенно капельно, ревалгин 5 мл внутривенно при болях, анальгин 50% 2 мл+димедрол 1% 1 мл внутримышечно при повышении температуры тела более 38°С. Вновь при повышении температуры до 39,1°С вечером того же дня назначены раствор Рингера 800 мл+эуфиллин 2,4% 10 мл внутривенно капельно, а также криопреципитат 5 доз внутривенно капельно. В тот же день температура тела снизилась и не превышала 38°С. 13.09.08 было назначено еще 5 доз криопреципитата. Вечером 14.09.08 температура тела нормализовалась. В данном случае инфузия криопреципитата проводилась 4 дня.
Контроль УЗИ от 15.09.08: размер почки в норме, отек паранефральной клетчатки не определяется, очаговое изменение не визуализируется. Кортико-медуллярная дифференцировка не изменена. В области ранее лоцируемого гипоэхогенного участка определяется умеренное утолщение коркового слоя до 15 мм, скорость кровотока практически не отличается от нормы. Дуговые артерии прослеживаются на всем протяжении (рис. 2).
Таким образом, добавление криопреципитата к комплексной терапии способствовало улучшению общего состояния, нормализации кровотока и толщины коркового слоя почки.
Следовательно, по данным клинико-лабораторного обследования больным острым гнойным пиелонефритом, получавшим комплексную терапию с применением криопреципитата, удалось ликвидировать признаки гнойного воспаления в почках, что подтверждалось положительной динамикой снижения температуры тела, уменьшением болевых ощущений, нормализацией показателей крови (лейкоциты, СОЭ) и мочи (белок, лейкоциты). По данным УЗИ почек у больных первой группы септический очаг уменьшался в размерах вплоть до полного исчезновения и восстановления кровотока в пораженной зоне. Больные второй группы при наличии септического очага подвергались оперативному лечению, УЗИ в послеоперационном периоде не проводилось. Оперативное лечение, проведенное у больных II группы по данным показателей уровней лейкоцитов и СОЭ до и после лечения (сохраняющееся повышение показателей в среднем до 9,6 суток), указывало на умеренную сохраняющуюся активность воспалительного процесса, а также сохранение болевых ощущений в послеоперационной области.
Обсуждение. Острый необструктивный пиелонефрит в своем развитии проходит несколько стадий. Исход заболевания во многом зависит от времени обращения больного и сроков начала лечения. При назначении антибактериальной терапии в раннем периоде развития острого пиелонефрита удается остановить дальнейшее прогрессирование воспалительного процесса. Если же пациент вовремя не обращается за помощью или антибактериальная терапия оказывается неэффективной, воспаление усиливается. Это приводит к ухудшению кровообращения в паренхиме почек (сначала за счет отека тканей почки, а в дальнейшем за счет тромбоза почечных артерий) и уменьшению доставки антибактериальных препаратов в зону воспаления. Именно в этот период патогенетически обосновано назначение криопреципитата. За счет улучшения микроциркуляции в зоне ишемии, лучшей доставки антибактериальных средств он препятствует формированию гнойного очага воспаления, способствует более быстрому разрешению воспалительного процесса и улучшению процессов репарации и регенерации. Можно сказать, что, вводя криопреципитат, мы обрываем каскад патогенетических реакций организма в ответ на вторжение инфекционного агента.
Эффективность применения криопреципитата подтверждается результатами настоящего исследования, согласно которым в группе пациентов, получавших криопреципитат, потребность в оперативных вмешательствах была в 2 раза меньше – 2,7 против 5,8%.
Несмотря на отсутствие изменений при стандартном проведении УЗИ почек, уже в этот момент могут отмечаться нарушения кровотока, приводящие в последующем к развитию ишемии, поэтому всем больным острым пиелонефритом в ходе УЗИ в обязательном порядке должна проводиться допплерография. КТ, МРТ при необходимости проводятся больным на различных этапах диагностики и лечения. При выявлении ишемии считаем назначение криопреципитата обязательным.
Это приводит к уменьшению количества оперативных вмешательств, сокращает сроки пребывания больных в стационаре на 2,5 суток.
Выводы
- Больным острым гнойным пиелонефритом показано применение криопреципитата для нормализации кровотока в почке, улучшения проникновения антибактериальных препаратов в очаг воспаления, а также биосанации очагов деструкции, что ведет к обратному развитию апостем и карбункулов почки.
- С целью проведения контроля за эффективностью лечения больным гнойным пиелонефритом показано проведение УЗИ почек в сочетании с допплеровским исследованием сосудов в динамике.
- Назначение криопреципитата оправданно пациентам с проявлениями гнойного пиелонефрита, а также больным с карбункулом почки и апостематозным пиелонефритом.


