Введение. Туберкулез остается глобальной проблемой современности. В 2015 г. в мире было диагностировано 10,4 млн новых случаев туберкулеза, причем 3,5 млн из заболевших были женщины и 1 млн – дети [1]. Безусловно, наиболее распространен туберкулез органов дыхания, но его диагностика, как правило, не встречает особых затруднений. Иная ситуация с туберкулезом внелегочных локализаций, который охватывает все органы и системы, кроме, как следует из термина, органов бронхолегочной системы. В структуре заболеваемости туберкулезом на 2–3-м месте после туберкулеза легких стоит туберкулез мочеполовой системы [2–6]. Внедрение современных методов диагностики, таких как мультиспиральная компьютерная томография, молекулярно-генетические методы идентификации M. tuberculosis, повысило частоту случаев своевременной диагностики до 75% [7], однако у каждого четвертого пациента заболевание по-прежнему выявляют на стадии формирования каверн [7].
Помимо субъективных причин этого явления существуют и объективные. Нефротуберкулез в 75% случаев сопровождается неспецифическим пиелонефритом, что логичным образом исключает патогномоничный признак – «стерильную пиурию». Неоптимальное антибактериальное лечение окончательно затушевывает клиническую картину уротуберкулеза, меняет патоморфологическую картину в очаге воспаления и делает невозможной идентификацию M. tuberculosis [3, 8, 9].
Мы поставли цель определить микробный спектр мочи и дериватов половых желез у пациентов с подозрением на урогенитальный туберкулез (УГТ) и изучить чувствительность выделенных микрорганизмов к основным антибактериальным препаратам.
Материалы и методы. Проанализирован спектр патогенной микрофлоры, выделенной у больных, поступивших в урогенитальную клинику ННИТ с целью исключения УГТ с 1 января 2012 по 30 сентября 2016 г. Видовую идентификацию микроорганизмов проводили методом время пролетной масс-спектрометрии и на микробиологическом анализаторе Phoenix 100 («BectonDickinson», США). Антибиотикорезистентность определяли на микробиологическом анализаторе Phoenix 100 («BectonDickinson», США).
Результаты. Всего за анализируемый период было выполнено 3004 бактериологических исследования на неспецифическую микрофлору, в том числе секрета простаты и/или эякулята – 735, мочи – 2018, отделяемого женских половых органов – 251.
В 2012 г. грамнегативная микрофлора была представлена энтеробактериями (89 [39,9%] штаммов), из них Citrobacter freundii – 2 (2,2%), E. coli – 67 (75,3%), Enterobacter spp. – 3 (3,4%), Klebsiella pneumonia – 14 (15,7%), Proteus spp. – 3 (3,4%). В 2 (0,9%) наблюдениях были выделены другие грамнегативные палочки (Sphingobacterium spiritivorum), в 11 (4,9%) – неферментирующие грамотрицательные бактерии. Восемь (3,6%) штаммов дрожжеподобных грибов были представлены одним видом – Candida albicans. Также были найдены грамположительные палочки (4 [1,8%]) штамма и грамположительные кокки (109 [48,9%]), среди которых преобладали Enterococcus spp. – 59 (54,1%) и Staphylococcus spp. – 37 (16,6%).
В 2013 г. структура грамнегативной микрофлоры несколько изменилась. Среди 89 (38,5%) изолятов доля E. coli уменьшилась на треть – 43 (48,3%) штамма, а доля Enterobacter spp. увеличилась в 3 раза – 8 (10%) штаммов. Количество штаммов Klebsiella spp. удвоилось и в абсолютном, и в процентном значении – 30 (33,7%) изолятов. Та же тенденция отмечена в отношении Proteus spp. – 7 (7,9%) штаммов. Среди 116 (50,2%) штаммов грамположительных кокков лидировал Enterococcus spp. (48 [41,4%]) и Staphylococcus spp. (58 [50%]). Спектр других микроорганизмов существенно не изменился.
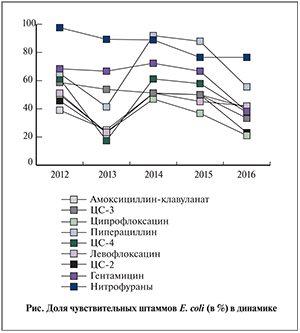 В 2014 г. в диагностически значимом титре было выделено 237 штаммов. Грамнегативная микрофлора была представлена энетеробактериями – 113 (47,7%) штаммов, перечень которых оказался весьма широк: Cedecealapagei – 1 (0,9%), Citrobacter freundii – 2 (1,8%), E. coli – 66 (58,4%), Enterobacter spp. – 5 (4,4%), Klebsiella spp. – 29 (25,7%) Proteus spp. – 9 (8%), Providencia rettgeri – 1 (0,9%). Другие грамнегативные палочки были представлены пятью видами: Alcaligenes faecalis (6 изолятов), Comamonas testosterone, Gardnerella vaginalis, Haemophilus parainfluenzae, Oligella urethralis (по 1 изоляту). Неферментирующие грамотрицательные бактерии в структуре микрофлоры составили 12,2% (29 штаммов), из них наиболее значимыми были изоляты P. aeruginosa – 16 (55,2%). Грамположительные кокки обнаружены в 79 (33,3%) наблюдениях, из них основными были Enterococcus spp. (66 [83,5%]) и Staphylococcus spp. (10 [12,7%]).
В 2014 г. в диагностически значимом титре было выделено 237 штаммов. Грамнегативная микрофлора была представлена энетеробактериями – 113 (47,7%) штаммов, перечень которых оказался весьма широк: Cedecealapagei – 1 (0,9%), Citrobacter freundii – 2 (1,8%), E. coli – 66 (58,4%), Enterobacter spp. – 5 (4,4%), Klebsiella spp. – 29 (25,7%) Proteus spp. – 9 (8%), Providencia rettgeri – 1 (0,9%). Другие грамнегативные палочки были представлены пятью видами: Alcaligenes faecalis (6 изолятов), Comamonas testosterone, Gardnerella vaginalis, Haemophilus parainfluenzae, Oligella urethralis (по 1 изоляту). Неферментирующие грамотрицательные бактерии в структуре микрофлоры составили 12,2% (29 штаммов), из них наиболее значимыми были изоляты P. aeruginosa – 16 (55,2%). Грамположительные кокки обнаружены в 79 (33,3%) наблюдениях, из них основными были Enterococcus spp. (66 [83,5%]) и Staphylococcus spp. (10 [12,7%]).
В 2015 г. 189 штаммов определялись в диагностически значимом титре. Грамнегативная микрофлора традиционно была представлена энтеробактериями – 98 (51,9%) штаммов, среди которых на долю ведущего уропатогена E. coli пришлось 65,3% (64 изолята). В каждом четвертом наблюдении была идентифицирована Klebsiella spp. – 22 (22,4%). В структуре грамположительных кокков, на долю которых в общем спектре микрофлоры пришлось 40,2% (76 штаммов), наиболее часто определяемыми были Enterococcus spp. – (45 [59,2%]) и Staphylococcus spp. (23 [30,3%]) с существенным перераспределением частоты между этими двумя микроорганизмами.
За 9 мес 2016 г. удалось выделить 112 штаммов в диагностически значимом титре. Среди 71 (63,4%) штамма грамнегативной микрофлоры E. coli была выделена в половине наблюдений (38 штаммов – 53,5%). Среди грамположительных кокков 22 (19,6%) штамма были представлены Enterococcus spp. и 12 (10,7%) – Staphylococcus spp.
Таким образом, структура патогенной микрофлоры была нестабильной без какой-либо причины, однако в любом случае около половины среди представителей грамнегативной микрофлоры всегда приходилось на E. coli, что подтверждает ее роль как ведущего уропатогена. В связи с этим ниже мы приводим данные по антибиотикорезистентности только этого инфекционного агента.
Результаты исследования чувствительности E. coli к основным антибиотикам и химиопрепаратам представлены на рисунке. Как видно из данных, относительно приемлемую частоту резистентности обеспечивают только антисинегнойные пенициллины в комбинации с ингибиторами β-лактамаз (пиперациллин/тазобактам) и нитрофурантоин, у остальных же частота чувствительных штаммов прогрессивно уменьшалась и составила к 2016 г. 40% и менее.
Обсуждение. В России рациональный выбор антибиотика при лечении инфекций нижних мочевыводящих путей (ИНМП) имеет место лишь в 49,2% наблюдений [10]. Злоупотребление фторхинолонами и амикацином приводит к несвоевременному выявлению туберкулеза мочеполовой системы [11].
К числу наиболее частых ошибок относится назначение препаратов с неустановленной эффективностью и/или низкой микробиологической активностью [10]. Повышение эффективности лечения острой ИНМП, увеличение межрецидивного периода при хронической ИНМП возможны только при оптимальном подборе антибактериального препарата [12].
Резистентность микрофлоры сильно варьируется в зависимости от географической зоны, более того, отмечены существенные колебания даже, к примеру, в такой небольшой стране, как Иран [14–17]. Т.С. Перепанова и соавт. [12] исследовали 987 внебольничных штаммов уропатогенов, полученных от пациентов из 28 центров 20 городов России, Беларуси и Казахстана. Доля представителей семейства Enterobacteriaceae составила 83,5%. При этом E. coli являлась возбудителем инфекции мочевыводящих путей у 63,5% пациентов, частота выделения ее существенно не различалась у пациентов с неосложненными (64,6%) и осложненными (62,1%) инфекциями. В то же время в Сибири роль E. coli в развитии инфекций мочевыводящих путей существенно ниже [17].
В многоцентровом исследовании, проведенном в Китае [18], были получены интересные данные о корреляции пола с видом уропатогена. Авторы обнаружили, что E. coli преобладает у женщин (54,8%; у мужчин этот патоген высевался в 37,2% наблюдений), а Staphylococcus epidermidis и Enterococcus faecalis соответственно в 1,5 и в 5,0 раз чаще выделяли у мужчин. Максимальная чувствительность E. coli была к фосфомицину, нитрофурантоину и ряду цефалоспоринов (выше 90%); к левофлоксацину 39% штаммов оказались устойчивыми. Подчеркнуто, что резистентность E. coli зависит от ее филогенетического типа [19].
Среди пациентов с бактериально подтвержденной инфекцией мочевыводящих путей мальчиков и девочек было почти поровну: соответственно 54,9 и 45,1%. E. coli была выделена у больных суммарно в 65,2% наблюдений, но чаще у девочек (70,8%), чем у мальчиков (60,5%), это объясняется анатомическими особенностями и недостаточным соблюдением гигиены в условиях стационара, возможно, с использованием памперсов. Штаммы E. coli демонстрировали in vitro чувствительность к амикацину в 79,7% наблюдений; напротив, к цефиксиму 68,4% изолятов были устойчивыми [20]. Вероятно, это связано с особенностями обследованных пациентов – фторхинолоны и аминогликозиды в среде детей младшего возраста имеют ограниченное применение. Другие авторы также обнаружили в моче у детей (средний возраст – 38 мес, 74% девочек) лишь 52% чувствительных к цефиксиму штаммов E. coli при наибольшей эффективности амикацина (94%) [21].
Анализ резистентности уропатогенов в Турции [22] выявил, что чувствительность E. coli к цефиксиму в детской клинике составила 73,7%, чувствительность Klebsiella spp. – 85,3%, Proteus spp. – 94,4%. Enterobacter spp. закономерно показал высокую резистентность (74%), поскольку этот возбудитель не входит в спектр действия цефиксима. К ципрофлоксацину микрофлора мочи была чувствительной в 83,7–100% наблюдений, что неудивительно, поскольку, как уже говорилось выше, фторхинолоны в педиатрической практике не применяют [22].
Недавнее исследование по эпидемиологии урогенитальных инфекций (УГИ) во Франции показало крайне высокую чувствительность E. coli к цефиксиму, сопоставимую с таковой к традиционным лидерам – фосфомицину и нитрофурантоину: частота резистентных штаммов составила соответственно 5,6, 2,2 и 1,2% [23]. Аналогичные данные продемонстрировали другие французские исследователи: более 95% изолятов E. coli были чувствительны к цефиксиму, фосфомицину и нитрофурантоину [24]. Следует иметь в виду, что, хотя E. сoli считается самым частым уропатогеном, немалая доля приходится на стафилококки и энтерококки, которые a priori не чувствительны к цефиксиму [25]. При оценке клинической роли цефиксима отмечена 100%-ная эффективность этого антибиотика при остром отите, остром синусите, острой пневмонии, но лишь 88,6% – при неосложненных УГИ при хорошей переносимости и минимальной частоте побочных реакций [20]. Однако для эмпирического лечения неосложненной инфекции мочевых путей рекомендуется использовать препараты, которые не применяются по другим показаниям [12].
При сравнении активности in vitro ципрофлоксацина и цефиксима к 293 штаммам E. coli (из них 40 β-лактамазпродуценты), к 54 штаммам Klebsiella pneumonia (из них 10 β-лактамазпродуценты) и к 53 изолятам Proteus murabilis было установлено несущественное преобладание фторхинолона (85,7 и 80,2% соответственно, p=0,125). Оказалось, что цефалоспорины (цефпрозил и цефиксим) ингибируют рост соответственно 80–90% ципрофлоксацинрезистентных штаммов уропатогенов [26].
Изучение результатов посевов мочи в педиатрическом госпитале в течение 6 лет показало, что треть штаммов E. coli характеризовалась генетической предрасположенностью к развитию резистентности к антибиотикам. Бета-лактамазпродуцирующие штаммы E. coli были устойчивыми к цефиксиму в 99% наблюдений, к ципрофлоксацину – в 76%, даже к имипенему в 23% наблюдений возбудитель демонстрировал резистентность [27].
Устойчивость E. coli к цефиксиму in vitro в 90% наблюдений преодолевается одновременным добавлением амоксициллина/клавуланата. In vitro минимальная ингибирующая концентрация (МИК) цефиксима составляет 24 мг/л, амоксициллина/клавуланата – 3 мг/л, а их сочетание обеспечивает МИК уже при 0,125 мг/л [28]. В педиатрической практике получено подтверждение этому тезису – сочетанное применение цификсима и амоксициллина/клавуланата детьми с УГИ оказалось более эффективным, чем при монотерапии каждым из этих препаратов [29].
Пересадка почки сопряжена с повышенным риском развития инфекции в трансплантате; в исследовании [30] данное осложнение диагностировали в трети (33,6%) случаев. Выделенные уропатогены были устойчивыми к цефиксиму в 50,4–60,2% случаев. Следует принять во внимание, что изучалась отягощенная когорта пациентов, что подтверждает высокий уровень резистентности микрофлоры к антибиотикам, повсеместно сохранившим хорошую эффективность: к амикацину были устойчивы 38,3–43% штаммов, к нитрофурантоину – 23,8–47,9% и даже к имипенему – 44,8–62,7% [30].
Заключение. Несмотря на относительную стабилизацию эпидемической ситуации по туберкулезу в целом по России, в Сибири и на Дальнем Востоке сохраняется высокая заболеваемость туберкулезом, в том числе урогенитальным. Диагностика УГТ сложна, частота бактериологической верификации не превышает 40%, в первую очередь из-за неоптимального выбора препаратов для эмпирической терапии УГИ. В 2007 г. XI съезд урологов России принял резолюцию, в которой рекомендовал избегать при назначении эмпирической терапии по поводу УГИ антибиотиков, ингибирующих рост M. tuberculosis.
К таким препаратам наряду с фосфомицином и фуразидином относятся цефалоспорины. К I и II поколениям цефалоспоринов уропатогены демонстрируют очень высокую резистентность, и их нельзя признать оптимальными. Из цефалоспоринов III поколения цефиксим в силу высокой биодоступности остается препаратом выбора в амбулаторной практике.
Полученные нами результаты нельзя экстраполировать на популяцию в целом, поскольку в ФГБУ ННИИТ МЗ РФ для дифференциальной диагностики поступают пациенты с длительным анамнезом, получившие множество курсов лечения различными антибактериальными препаратами, что закономерно привело к селекции резистентных штаммов. Наши данные подчеркивают необходимость строгого выбора антибиотиков для эмпирической терапии по поводу УГИ; в отсутствие эффекта пациент должен быть немедленно обследован на туберкулез методами молекулярно-генетической диагностики.


