Введение. Мужской фактор имеет место в половине случаев бесплодного брака [1, 2]. В настоящее время принято считать, что наиболее частой (35–40%) причиной мужского бесплодия является идиопатическая олиго-, астено- и/или тератозооспермия [1–6]. Нарушения в количественных и качественных показателях спермы наблюдаются в этом случае в отсутствии анамнестических факторов риска, отклонений в результатах эндокринных исследований и при нормальных данных медицинского осмотра.
Для улучшения качества спермы в таких случаях используются различные лекарственные препараты, наиболее часто – антиэстрогены, антиоксиданты (витамины и микроэлементы) и карнитины [3–10].
Мета-анализы выполненных исследований свидетельствуют о том, что антиэстрогены – тамоксифен и кломифена цитрат (КЦ) – обеспечивают значимое увеличение концентрации сперматозоидов, их подвижности и увеличение числа наступивших беременностей [11–13]. Тем не менее, согласно последним Рекомендациям Европейской ассоциации урологов (EAU), для эмпирического лечения идиопатического бесплодия антиэстрогены не рекомендованы [6]. Причиной, очевидно, служат отсутствие реакции на эти препараты со стороны многих бесплодных мужчин, неубедительные данные по родам и возможные тератогенные эффекты.
Несколько рандомизированных клинических испытаний показали потенциал антиоксидантных добавок для лечения мужской субфертильности, связанной с оксидативным стрессом (ОС) [14–16]. По результатам мета-анализа M. Showell и соавт. [15], антиоксиданты улучшают жизнеспособность, концентрацию и прогрессивную подвижность, связывание с яйцеклеткой, фрагментацию ДНК сперматозоидов; повышают процент беременностей при естественном зачатии и в программах вспомогательных репродуктивных технологий (ВРТ). Тем не менее, характеризуя качество включенных в анализ исследований, авторы обзора отмечают, что уровень доказательности при этом «низкий» и «очень низкий». Невысокая стоимость и относительно низкий риск токсичности этих антиоксидантов привлекательны для пациентов и врачей, поэтому с 2013 г. они рекомендованы EAU для лечения мужского бесплодия, но, как подчеркивается в последних Рекомендациях EAU, не для лечения идиопатических форм [6]. Причина, очевидно, в том, что идиопатическое бесплодие далеко не всегда является следствием ОС: 30–80% случаев – по обобщенным данным M. Showell и соавт. [15], около 40% – по нашим данным [16]. В иных случаях применение антиоксидантов представляется малоперспективным.
Попытки лечения мужского бесплодия карнитинами предпринимаются давно и в целом достаточно успешны [10, 17–24]. Мета-анализы рандомизированных исследований показывают положительное влияние карнитинов на концентрацию, подвижность, морфологию, акросомальную реакцию сперматозоидов и процент беременностей: отношение шансов (ОШ) спонтанной беременности на фоне лечения, по разным оценкам, варьируется от 3,2 [25] до 4,1 [26]. Увеличение прогрессивной подвижности коррелирует при этом с уровнем спермального карнитина [21]. В то же время в некоторых плацебо-контролируемых исследованиях не выявлено ни улучшения качества спермы, ни повышения процента беременностей при лечении карнитинами [27]. Кроме того, наблюдаемое на фоне приема карнитинов улучшение показателей спермограммы: прогрессивной подвижности и процента морфологически нормальных сперматозоидов, непродолжительное и проходит после 16 нед лечения [25].
Хотя роль антиэстрогенов, антиоксидантов (витаминов и микроэлементов) и карнитинов в лечении бесплодия в целом хорошо документирована, обзор публикаций показывает скудность исследований, в которых проводилось сравнение комплексной терапии с монотерапией данными препаратами. В двух работах показано, что комбинация КЦ с витамином Е (400 мг/сут) давала значимое увеличение концентрации и общей подвижности по сравнению с плацебо [28] и монотерапией КЦ [29], однако процент беременностей не учитывался.
Таким образом, показания и ожидаемая эффективность лечения мужского бесплодия антиэстрогенми, карнитинами и антиоксидантами как в режиме монотерапии, так и при комбинированном использовании остаются не вполне ясными.
Цель настоящего исследования: изучить эффективность и безопасность комплекса L- и ацетил-L-карнитинов, витаминов А, Е и С, селена, цинка и других антиоксидантов (препараты «СпермАктин»®+«Больше чем поливитамины»® ) в комбинации с КЦ для лечения мужского идиопатического бесплодия в форме олиго-, и/или астено-, и/или тератозооспермии. Основной рассматриваемый в данной статье вопрос: повышает ли включение карнитинов эффективность такого комплексного лечения?
Материалы и методы. Исходно в исследование были включены 173 мужчины из бесплодных пар в возрасте 25–45 лет. Обследование проводили в соответствии с рекомендациями ВОЗ [1, 2].
Критерии включения в исследование:
- отсутствие беременности в браке более 12 мес при половой жизни без контрацепции;
- наличие сперматозоидов в эякуляте;
- идиопатическая олиго-, и/или астено-, и/или тератозооспермия;
- отсутствие инфекций репродуктивного тракта (Chlamydia trachomatis, Mycoplasma genitalium, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis), диагностированных методом полимеразной цепной реакции;
- отсутствие клинических и лабораторных признаков воспалительного процесса дополнительных половых желез;
- отсутствие выраженных аутоиммунных реакций против сперматозоидов, когда антиспермальные антитела (АСАТ) покрывают не более десятой части подвижных гамет (MAR IgG<10%);
- отсутствие пальпируемого варикоцеле;
- отсутствие выраженной соматической патологии;
- отсутствие психосексуальной и эякуляторной дисфункций.
Критерии исключения:
- установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF, CFTR);
- азооспермия;
- пиоспермия;
- гиперпродукция ФСГ;
- пальпируемое варикоцеле, подтвержденное результатами УЗИ;
- наличие иммунного фактора бесплодия (MAR IgG ≥ 10%);
- выраженная соматическая патология;
- психосексуальная и эякуляторная дисфункция;
- возраст супруги больше 35 лет;
- очевидные женские причины бесплодия (аномалии органов женской половой системы, двусторонняя непроходимость маточных труб, ановуляция), о которых сообщили пациенты или их жены.
Пациенты случайным образом были разделены на две группы: основную (88 человек) и контрольную (85 человек).
 Пациенты основной группы получали в течение не менее 6 мес L-карнитин фумарат (1 г), ацетил-L-карнитин (0,5 г) дважды в сутки (препарат Спермактин® по 1 саше 5 г два раза в день во время еды), комплекс витаминов и микроэлементов «Больше чем поливитамины»® (витамин А 9900 МЕ, витамин D 400 МЕ, витамин Е 25 мг, витамин С 100 мг, витамин В1 4 мг, В2 4 мг, В6 4 мг, В12 4 мг, фолиевая кислота 400 мкг, цинк в виде цитрата 30 мг, селен в виде селенометионина 25 мкг, L-глутатион 5 мг, другие микроэлементы, экстракты карликовой пальмы, женьшеня, пажитника и кайенского перца в дозах 250, 25, 25 и 25 мг соответственно) и КЦ по 25 мг дважды в сутки перорально.
Пациенты основной группы получали в течение не менее 6 мес L-карнитин фумарат (1 г), ацетил-L-карнитин (0,5 г) дважды в сутки (препарат Спермактин® по 1 саше 5 г два раза в день во время еды), комплекс витаминов и микроэлементов «Больше чем поливитамины»® (витамин А 9900 МЕ, витамин D 400 МЕ, витамин Е 25 мг, витамин С 100 мг, витамин В1 4 мг, В2 4 мг, В6 4 мг, В12 4 мг, фолиевая кислота 400 мкг, цинк в виде цитрата 30 мг, селен в виде селенометионина 25 мкг, L-глутатион 5 мг, другие микроэлементы, экстракты карликовой пальмы, женьшеня, пажитника и кайенского перца в дозах 250, 25, 25 и 25 мг соответственно) и КЦ по 25 мг дважды в сутки перорально.
Пациенты контрольной группы в течение такого же периода и в тех же дозировках получали КЦ и комплекс витаминов, минералов и экстрактов препарата «Больше чем поливитамины»®.
Исследование эякулята проводили в соответствии с требованиями ВОЗ [2]: определяли концентрацию, подвижность и долю нормальных форм, вычисляли количество прогрессивно подвижных сперматозоидов в эякуляте и интегральный индекс качества спермы (объем эякулята х концентрация сперматозоидов х доля прогрессивно подвижных форм х доля нормальных форм). Методом смешанной реакции агглютинации определяли процент подвижных сперматозоидов, покрытых АСАТ (SpermMar Kit, FertiPro, Бельгия).
Эякулят оценивали до и через 3–4 мес лечения. Повторное плановое обследование прошли 68 мужчин основной и 62 – контрольной групп, продолжающих лечение по причине отсутствия в этот период беременности. Через 6 мес после начала лечения у всех пациентов (n=173), исходно включенных в исследование, в том числе не явившихся на плановое обследование, путем опроса через Интернет или по телефону собирали информацию о наступлении или отсутствии беременности за последние полгода.
Пациенты отвечали на следующие вопросы:
- Ожидаемая беременность наступила?
- Когда наступила беременность?
- Беременность наступила на фоне лечения в естественном цикле, после искусственной инсеминации, в результате экстракорпорального оплодотворения (ЭКО)?
- Жена получала лечение у гинеколога по поводу бесплодия и других гинекологических заболеваний?
- Не было спонтанного прерывания беременности?
По результатам обработки полученной информации в основной группе осталось 53 мужчины, в контрольной – 52, получивших лечение в полном объеме и соответствовавших критериям включения/исключения. Остальных считали выбывшими по различным причинам: установление женского фактора бесплодия, участие в программе ЭКО и других вспомогательных репродуктивных технологий, инфекционно-воспалительные заболевания у женщин с необходимостью применять барьерную контрацепцию, развод и прекращение лечения, а также в случае, если пациенты были недоступны или не захотели отвечать на поставленные вопросы. Данные пары при оценке реальной фертильности не учитывались, но показатели спермограммы в процессе лечения в тех случаях, когда анализ эякулята был сделан, при статистическом анализе исключены не были.
Таким образом, изменения спермограммы на фоне лечения характеризовали по данным лабораторного обследования 75% мужчин, а восстановление реальной фертильности – по данным 61% мужчин, исходно включенных в исследование.
Обработку эмпирических данных проводили с использованием программы «STATISTICA» («StatSoft», США). Средние значения по группам представляли в виде M±SD, медианы, 25-го и 75-го процентилей, диапазона «невыпадающих значений». На графиках Box-and-whisker «выпадающими» оказались точки, которые находятся далеко от центра распределения и не являются характерными для него (возможно, это результат ошибок наблюдения или выбросами). Они определялись следующим образом: значения, больше чем верхняя граница «ящика»+коэффициент (верхняя граница «ящика»–нижняя граница «ящика»); значения, меньше чем нижняя граница «ящика»–коэффициент (верхняя граница «ящика»–нижняя граница «ящика») с коэффициентом х 1. «Экстремумы» определяли так же, но в формуле коэффициент умножается на 2.
Значимость различий между группами проверяли с помощью критериев Стьюдента (t), Манна–Уитни (m–w), знаков (z), χ2 и Вилкоксона (w); различия считали значимыми при p<0,05.
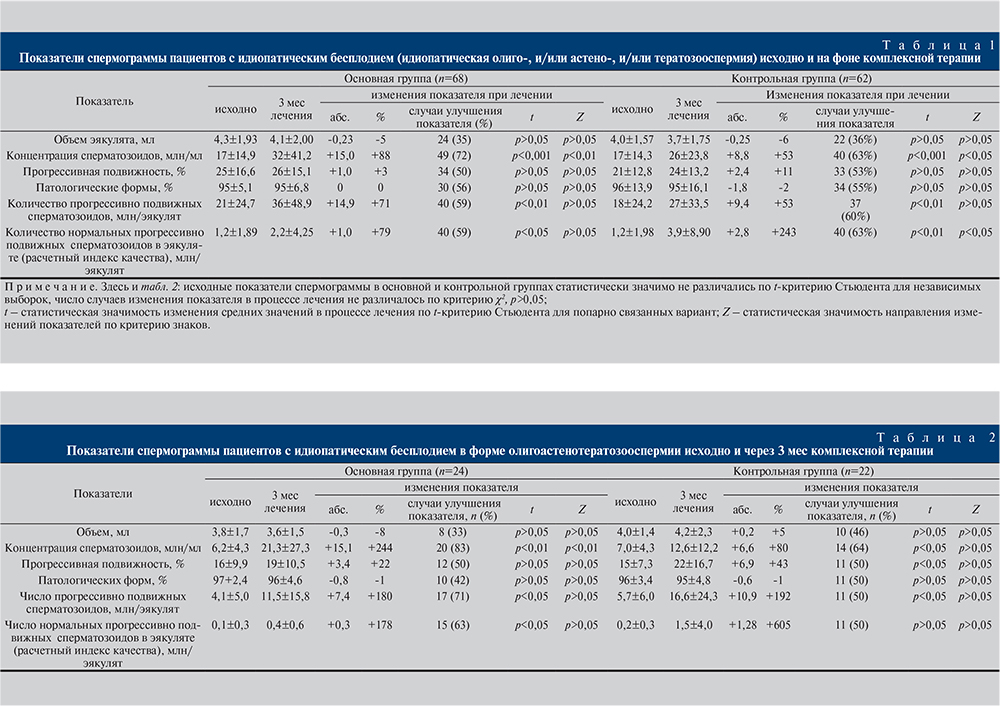
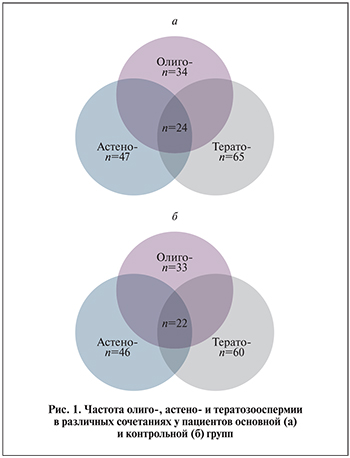
Результаты. Исходно клинико-анамнестические характеристики пациентов основной и контрольной групп не различались. Возраст пациентов составлял 33,1±6,5 и 32,6±5,3 года соответственно (p>0,05). Не было различий в концентрации (p>0,05), прогрессивной подвижности (p>0,05), доли аномальных форм сперматозоидов (p>0,05), расчетной величине количества прогрессивно подвижных сперматозоидов с эякуляте (p>0,05; табл. 1). Проценты случаев олиго-, астено- и тератозооспермии в сравниваемых группах также не различались (рис. 1). Не было различий и в количестве пациентов, имевших все данные нарушения одновременно (олигоастенотератозооспермия): 24 из 68 и 22 из 62 (p>0,05 по χ2), средних значениях для этой группы (табл. 2).
Концентрация сперматозоидов. У пациентов основной группы, получавших комплексное лечение, включившее КЦ, витамины- и микроэлементы-антиоксиданты вместе с карнитинами, через 3 мес происходит увеличение концентрации сперматозоидов в среднем по группе на 15 млн/мл (188% исходного уровня; р<0,001); медиана, рассчитанная с исключением «выпадающих» значений, увеличилась при этом меньше – на 8 млн/мл (153%, р=0,00001; рис. 2, а). У пациентов контрольной группы, не получавших карнитины, среднее увеличение концентрации составило 9 млн/мл для средней (153% исходного; р<0,001) и 7,5 млн/мл для медианы (154%, р=0,0007; рис. 2, б). При этом и в основной, и в контрольной группах имелась достаточно большая доля мужчин (28 и 37% соответственно; р>0,05), у которых увеличение концентрации сперматозоидов при данном лечении вообще отсутствует, т.е. остается неизменной, или снижается (табл. 1).
Прогрессивная подвижность у пациентов обеих групп через 3 мес лечения практически не менялась (р>0,05; табл. 1 и рис. 2, г); доля прогрессивно подвижных сперматозоидов увеличивалась в обеих группах примерно в половине случаев (р>0,05; табл. 1).
Процент морфологически аномальных форм через 3 мес лечения в среднем не снижался в обеих группах (табл. 1, рис. 2, д, е); положительная динамика морфологии имела место чуть больше чем в половине случаев в обеих группах (р>0,05; табл. 1).
Несмотря на отсутствие положительных изменений подвижности и морфологии, за счет увеличения концентрации расчетное количество сперматозоидов с прогрессивной подвижностью во всем эякуляте увеличилось в обеих группах: в основной – на 14,9 млн (171% исходного; p<0,01), в контрольной – на 9,4 млн (153%; p<0,01); медианы изменились меньше: +4,5 млн (134% от исходного; р=0,009) в основной (рис. 2, к) и +3,8 млн (140%; р=0,01) в контрольной (рис. 2, л). Улучшение данного показателя имело место примерно в 60% случаев в обеих группах (р>0,05; табл. 1).
Подгруппы с сочетанными нарушениями – олигоастенотератозооспермией
У пациентов с олигоастенотератозооспермией (табл. 2) концентрация сперматозоидов увеличилась на фоне лечения: у 20 из 24 основной группы (83%; p<0,01) и у 14 из 22 контрольной (64%; р>0,05). Средняя арифметическая стала больше на 15,5 млн/мл в основной (344% исходной; p<0,01) и 6,6 млн/мл в контрольной (180%; p<0,05); медиана изменилась меньше на 10 млн/мл (322%; p=0,0008) в основной и 0,5 млн/мл в контрольной (107%; p>0,05).
В обеих подгруппах имело место сходное увеличение доли сперматозоидов с подвижностью категории А за счет уменьшения доли сперматозоидов категории В. В основной группе процент быстроподвижных сперматозоидов увеличился в среднем на 4% (150% исходного; p<0,05), медиана – на 6% (p=0,04); в контрольной – на 8% (223% исходного; p<0,05) и 2% (p=0,025) соответственно.
Процент патологических форм при олигоастенотератозооспермии на фоне лечения в обеих подгруппах менялся разнонаправленно и статистически не значимо (p>0,05; см. табл. 2, рис. 3).
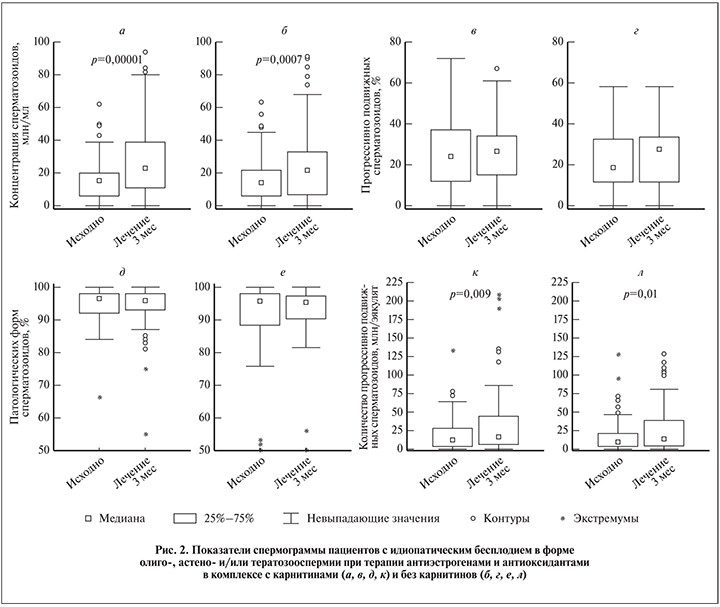
Суммарно за счет увеличения концентрации в обеих подгруппах с олигоастенотератозооспермией наблюдалось увеличение количества прогрессивно подвижных сперматозоидов в эякуляте и расчетного числа прогрессивно подвижных и морфологически нормальных сперматозоидов в эякуляте – индекс качества спермы (табл. 2; рис. 3). Увеличение числа прогрессивно подвижных сперматозоидов в основной составило в среднем 280% исходного (p<0,05), в контрольной – 292% (p<0,05); изменение величины медианы составило 286% для основной (с 2,13 до 6,09 млн/эякулят; p=0,012) и 146% для контрольной (с 3,7 до 5,4 млн/эякулят; p>0,05). Индекс качества спермы при сравнении средних в основной подгруппе вырос в 2,78 раза (p<0,05), медиана – в 2 раза (р=0,03). В контрольной группе среднее значение индекса качества увеличилось почти в 6 раз, но за счет значительной дисперсии изменения не были статистически значимыми (p>0,05). Положительная динамика данных расчетных показателей в основной подгруппе имела место в 71 и 63% случаев, в контрольной – только у половины обследованных.
Беременности. За 6-месячный период наблюдения беременность в естественном цикле наступила у 11 (20,8%) из 53 пар основной группы и у 10 (19,2%) из 52 – контрольной (р>0,05). В подгруппах с исходной олигоастенотератозооспермией беременности за тот же период были получены в 1 (4%) случае из 24 в основной группе и в 2 (9%) из 22 в контрольной (p>0,05).
Обсуждение. Эффективность эмпирического лечения по поводу идиопатического мужского бесплодия по-прежнему остается спорным вопросом [3–8].
Мы ставили задачу оценить целесообразность включения карнитинов в комплекс препаратов, часто применяемых для лечения идиопатического мужского бесплодия: КЦ как антиэстрогена и витаминов Е, С, А, селена, цинка и других микроэлеменов в качестве антиоксидантов. Назначение нескольких веществ, способных действовать синергически, кажется логичным.
Карнитины реализуют ряд эффектов, которые могут быть полезными для мужских гамет. Они участвуют в обеспечении сперматозоидов энергией, необходимой для дыхания и движения, за счет переноса acyl-группы и окислительного фосфорилирования жирных кислот в митохондриях [30, 31]. Кроме того, карнитины могут быть ответственными за снижение избыточного токсичного внутриклеточного ацетил-КоА, чтобы защитить сперматозоиды от ОС [17, 20]. Полагают, что большая часть активности карнитина реализуется в семенных канальцах, меньшая – в придатках [19, 23].
В доступной литературе информации о комплексном применении указанных препаратов и нутриентов для лечения мужского идиопатического бесплодия мы не нашли.

По полученным нами данным, добавление L- и ацетил-L-карнитинов в суточной дозе 2 и 1 г соответственно приводит к некоторому улучшению средних показателей спермограммы пациентов с олиго-, астено- и/или тератозооспермией: увеличивает добавленную концентрацию в 1,7 раза относительно базовой терапии (+88 и +52% соответственно), а у больных со смешанной патоспермией – более чем в 3 раза (оценка по медиане).
Одновременно добавление L- и ацетил карнитина и L-карнитина фумарата к базовой терапии увеличивает среднее число прогрессивно подвижных сперматозоидов в эякуляте на 37% (+14,9 и + 9,4 млн в основной и контрольной группах соответственно). У пациентов с сочетанными нарушениями эякулята применение L- и ацетил карнитина и L-карнитина фумарата почти вдвое (286 и 146% исходного соответственно) увеличивает число прогрессивно подвижных сперматозоидов (медиана), а также более чем на 40% в относительных значениях (71 и 50%) долю пациентов с положительной динамикой данного показателя. Для случаев олигоастенотератозооспермии применение карнитинов уменьшает долю не реагирующих на терапию более чем в 2 раза: с 36 до 17%.
Однако установлено, что улучшение качества спермы на фоне лечения происходит во всех группах практически только за счет увеличения концентрации сперматозоидов. При этом и в основной, и в контрольной группах было немало мужчин (28 и 37% соответственно), у которых увеличение концентрации сперматозоидов при лечении отсутствовало.
Оценка прогрессивной подвижности и морфологии сперматозоидов не выявила какого-либо значимого положительного эффекта карнитинов при комплексном лечении пациентов с астено- и/или тератозоспермией. Тем не менее было отмечено, что в обеих подгруппах с олигоастенотератозооспермией наблюдалось увеличение доли сперматозоидов с быстрой прогрессивной подвижностью (категория А по ВОЗ, 1999) за счет уменьшения доли сперматозоидов категории В.
Оценка реальной фертильности не показала значимого увеличения вероятности наступления беременности при включении карнитинов в комплексную терапию мужского бесплодия вместе с антиэстрогенами, витаминами и минеральными антиоксидантами.
Полученные нами данные согласуются с результатами уже опубликованных исследований, в которых было показано увеличение концентрации сперматозоидов при назначении антиэстрогенов [7, 11–13]. По нашим данным, эффект более выражен в случае олигозооспермии, но при этом более 17% пациентов никак не реагируют на подобную терапию. При астено- и/или тератозооспермии в отсутствие олигозооспермии увеличение концентрации сперматозоидов на фоне лечения отсутствует уже у 36% пациентов. Кроме того, по нашим данным, морфология и подвижность при этом существенно не улучшаются. Об отсутствии эффекта терапии антиэстрогенами на морфологию сперматозоидов сообщали многие авторы [28, 29], а отсутствие улучшения подвижности, о чем писали некоторые исследователи [11–13], очевидно, связано с большой долей пациентов с выраженной тератозооспермией в нашей выборке. В последнее время стало ясно, что в большинстве случаев кажущаяся идиопатической тератозооспермия на самом деле служит следствием имеющихся генетических дефектов [32]. В связи с этим мы полностью согласны с мнением A. Jungwirth и соавт. [6], что антиэстрогены мало пригодны для эмпирической терапии и требуют уточнения показаний к их назначению: исходной оценки уровня гонадотропинов, тестостерона, эстрадиола, и их изменений в процессе лечения.
Избирательный подход требуется и при назначении антиоксидантов – далеко не всегда ОС служит причиной снижения качества сперматозоидов в отсутствие инфекционно-воспалительного процесса [16, 33, 34]. Различные фармакологические фирмы предлагают готовые комплексы нутриентов, способных, по мнению производителей, улучшать мужскую фертильность. Однако применение комплекса антиоксидантов способствовало улучшению подвижности сперматозоидов только в половине (3 из 6) подобных исследований [35–37], концентрация увеличилась только в 1 из 6 [38]. Плацебо-контролируемые исследования еще менее оптимистичны. В частности, сочетанное назначение витаминов С и Е при астенозооспермии не улучшало параметры спермы и 24-часовую выживаемость сперматозоидов [39]. Комплекс «FertilAid for men», содержащий набор витаминов и минералов-антиоксидантов, показал увеличение общего числа подвижных сперматозоидов, причем с минимальным уровнем доказательности (р=0,05), но улучшения в количестве, подвижности и морфологии сперматозоидов достигнуто не было [40]. Другой аналогичный комплекс «Menevit» повысил процент наступивших беременностей после ЭКО (ICSI), но только в случае ОС и фрагментации ДНК, причем качество эмбрионов при этом не улучшилось [41]. Более обнадеживающие результаты были недавно получены при использовании комплекса витаминов-антиоксидантов и высоких доз карнитинов (2 г L-карнитина и 1 г ацетил-L-карнитина в сутки): препарат «Proxeed Plus» улучшал прогрессивную подвижность в многоцентровом двойном слепом плацебо-контролируемом исследовании, проведенном в Сербии, Нидерландах и США [42]. В другой работе авторы отметили, что наблюдаемое повышение прогрессивной подвижности коррелировало с уровнем спермальных карнитинов [21]. Однако, по другим данным, «Proxeed Plus» улучшал общее количество подвижных сперматозоидов только у пациентов с повышенным базовым уровнем активных форм кислорода [24]. Ранее об улучшении качества спермы при использовании L-карнитин+ацетил-L-карнитина совместно с НПВС цинноксикам, по данным двойных слепых плацебо-контролируемых исследований, сообщали G. Cavallini и соавт. [23], но авторы подчеркнули, что лечение не дает результата при концентрации сперматозоидов менее 5 млн/мл и, наоборот, – при астено- и/или тератозооспермии в отсутствие олигозооспермии. Это полностью согласуется с нашими данными. Некоторые исследователи вообще не обнаружили какого-либо положительного влияния комплекса L- и ацетил-L-карнитинов на качество спермы в течение 24 нед в плацебо-контролируемых исследованиях [27]. Данные отечественных авторов также противоречивы: одни видели существенное улучшение подвижности и морфологии при использовании карнитинов [43], другие – нет [44]. По нашим ранее опубликованным данным, карнитины в комбинации с витамином Е способствовали улучшению подвижности в виде увеличения процента активно подвижных гамет (категория А) за счет уменьшения доли сперматозоидов с медленным поступательным движением (категория В) [10]. Эффект увеличения доли подвижных сперматозоидов категории А при комплексной терапии олигоастенотератозооспермии мы наблюдали и в настоящем исследовании, но на фоне применения комплекса КЦ и антиоксидантов добавление карнитинов не влияло на данный показатель. G. Balercia и соавт. в двойном слепом плацебо-контролируемом исследовании применения карнитинов также не обнаружили значимого увеличения процента прогрессивно подвижных и нормальных форм, а только скорость их прямолинейного движения [22].
Отсутствие ожидаемого нами существенного улучшения результатов комплексного лечения пациентов с идиопатическим мужским бесплодием при добавлении L- и ацетил-L-карнитинов, очевидно, объясняется тем, что витамины (А, Е, С) и минералы (цинк, селен, магний и др.), получаемые наряду с КЦ пациентами обеих групп, в полной мере обеспечили антиоксидантный эффект – в той степени, в какой он мог способствовать улучшению качества спермы. Карнитины при этом не могли привнести ничего принципиально нового и полезного в метаболизм гамет. Однако и сами антиоксиданты были в нашем случае не слишком эффективными, поскольку из выборки в самом начале исследования были исключены пациенты с высоким риском ОС: инфекционно-воспалительными процессами репродуктивного тракта, варикоцеле, АСАТ, установленными производственными вредностями. Это остро ставит вопрос о дифференциальной диагностике при лечении так называемых идиопатических форм мужского бесплодия и важности проведения специальных исследований для выбора лечения. К таким исследованиям спермы сегодня относятся определение активных форм кислорода в нативном эякуляте и внутриклеточного ОС по продукции свободных радикалов отмытыми сперматозоидами; определение антиоксидантной емкости семенной плазмы; оценка содержания в сперме карнитинов, альфа-гликозидазы, цитрата и цинка; оценка последствий ОС – фрагментации ДНК сперматозоидов и зависимость этих повреждений от правильности упаковки хроматина (соотношение гистоны/протамины), других характеристик эякулята [2–5, 45].
Выводы
- Назначение L- и ацетил-L-карнитинов (в дозе 2 и 1 г в сутки соответственно) совместно с КЦ и комплексом антиоксидантов (витамины и минералы) при идиопатической олиго-, и/или астено-, и/или тератозооспермии оказывает дополнительное положительное влияние на концентрацию сперматозоидов, более выраженное у пациентов с множественными нарушениями параметров спермограммы – олигоастенотератозооспермией, за счет чего добавленное количество прогрессивно подвижных сперматозоидов в эякуляте увеличивается почти вдвое (286 и 146% исходного для медианы основной и контрольной групп соответственно); доля не реагирующих на данную терапию уменьшается при этом более чем в 2 раза (с 36 до 17%).
- Назначение L- и ацетил-L-карнитинов не улучшает морфологию, прогрессивную подвижность сперматозоидов и процент наступивших беременностей по сравнению с пациентами, получающими базовую терапию.
- Необходимо продолжение исследований с целью уточнения показаний к назначению карнитинов при комплексном лечении мужского бесплодия.


