Повреждение магистральных сосудов (аорта, нижняя полая вена, подвздошные артерии и вены) – одна из самых сложных интраоперационных ситуаций в лапароскопии. Частота встречаемости, по результатам различных ретроспективных исследований, варьируется от 0,043 до 1,7% [1–5]. В целом риск возникновения значимого кровотечения в ходе лапаро- и торакоскопических процедур достигает 2,3% [4]. В лапароскопической урологии повреждение сосудов – наиболее общее интраоперационное осложнение [6]. Риск повреждения магистральных сосудов связан с технической сложностью хирургического пособия и методом выполнения пневмоперитонеума, при этом рекомендуется более безопасный «открытый» способ. Сложность операции прогностически важнее, чем опыт хирурга, а также возраст или индекс массы тела пациента [1, 3, 6, 7].
В доступных нам источниках зафиксировано не менее 700 случаев повреждения главных сосудов брюшной полости в ходе лапароскопии с опытом успешного восстановления лапароскопическим способом [8]. Сравнительного анализа о том, какие анатомические структуры повреждаются чаще, достоверно не обнаружено. Регистрированы единичные случаи одновременного повреждения иглой Вереша абдоминальной аорты и нижней полой вены с мезентериальными сосудами, а также одновременной травмы правых общих подвздошных артерии и вены. Все повреждения были успешно ликвидированы [5, 9]. В то же время интраоперационная травма крупных вен брюшной полости и таза вне зависимости от вида оперативного вмешательства и хирургической отрасли ассоциирована с высоким процентом послеоперационной смертности и тяжелых осложнений – 23 и 60% соответственно [10]. Кроме этого повреждение сосудов – самая частая причина конверсии [11]. Закрытие дефекта возможно хирургическим швом, клипированием, с помощью сшивающих аппаратов, клеевых композиций и гемостатических губок или комбинацией методов [12]. В отдельных случаях могут потребоваться использование заплаты из аутовены или искусственного материала, анастомоз «конец в конец», протезирование сосуда [10].
Таким образом, повреждение магистральных сосудов в процессе лапароскопии – нечастое, но регулярно встречающееся интраоперационное событие с потенциально высоким риском тяжелых, в том числе летальных, осложнений. Хирургическая тактика вариабельна. Определить правильные тактические и технические приемы, их последовательность, адекватность для каждого конкретного случая не всегда просто. Это связано с ограниченным временем для принятия решения и высокой эмоциональной нагрузкой, которая ложится на хирургическую бригаду при возникновении кровотечения из магистральных сосудов. Этот факт побудил нас поделиться своими клиническими наблюдениями и предложить пошаговую хирургическую тактику, используемую в нашем отделении.
Клинический случай № 1
Пациент М. 48 лет. Находился на стационарном лечении в урологическом отделении Федерального клинического центра высоких медицинский технологий ФМБА России с 12.02 по 26.02.2016. Диагноз: аутосомно-доминатная поликистозная болезнь почек. Хронический пиелонефрит. Хроническая болезнь почек 5Д, программный диализ с 2010 г. По данным лучевых методов исследования, классическая картина поликистоза со значительно увеличенными почками, которые занимают практически все забрюшинное пространство. Кроме этого обращало на себя внимание морбидное ожирение с индексом массы тела 41,5 кг/м2. В целях ликвидации хронического очага инфекции и подготовки к трансплантации почки 15.02.2016 была произведена лапароскопическая билатеральная нефрэктомия. Операция начата с правосторонней нефрэктомии. Почка частично располагалась в ретрокавальном пространстве. На заключительном этапе выполнения правосторонней нефрэктомии отмечено постоянное и достаточно интенсивное поступление венозной крови из области ворот почки. Повышено внутрибрюшное давление с 11 до 16 мм рт.ст. Для более эффективной эвакуации сгустков произведена смена аспиратора диаметром 5 мм на диаметр 10 мм. Без использования специальных устройств заведена «рука помощи» через аппендикулярный разрез в правой подвздошной области. После удаления основной массы жидкой крови и сгустков визуализирован дефект стенки нижней полой вены, находящийся рядом с устьем правой гонадной вены, которая была ранее клипирована. Первичный гемостаз был достигнут сначала прижатием пальцем к позвоночнику и далее пережатием рукой (рис. 1).
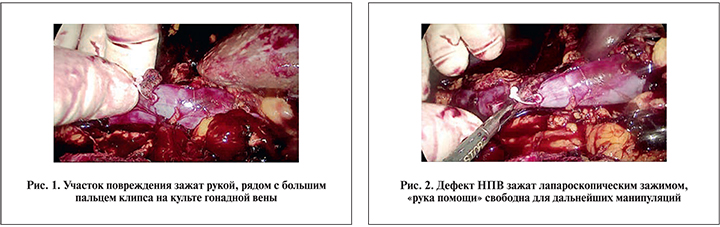
Далее установлен дополнительный 5-мм порт и рана в нижней полой вене пережата зажимом (рис. 2). Левая рука оперирующего хирурга была освобождена, что дало возможность закончить удаление правой почки. За счет аспирации кист размеры удаляемого органа были значительно уменьшены и почка удалена через тот же разрез в правой подвздошной области. Освобождено пространство для окончательной диагностики ситуации и выбора метода закрытия дефекта в нижней полой вене.
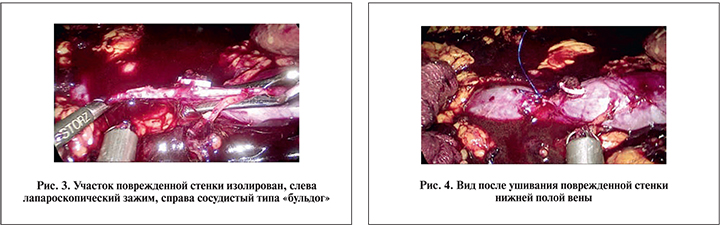
Установлено, что длина повреждения около 5–6 мм располагается параллельно ходу сосуда и возможно его ушить без значимого сужения просвета. Поврежденный участок изолирован сосудистым и лапароскопическим зажимами и ушит интракорпорально полипропиленовой нитью 4–0 на атравматической игле (рис. 3, 4).
Операция продолжена левосторонней нефрэктомией, которая протекала без технических сложностей. Кровопотеря оценена в 3000 мл. После компенсации кровопотерь течение послеоперационного периода гладкое, проводилась стандартная терапия, направленная на профилактику послеоперационных осложнений. В настоящий момент пациент продолжил программный гемодиализ и находится в листе ожидания.
Клинический случай № 2
Пациент М. 37 лет. Донор почки. 10.12.2015 была произведена мануально-ассистированная донорская нефрэктомия слева. В процессе мобилизации левого мочеточника в области подвздошных сосудов возникло повреждение общей левой бедренной артерии вследствие локального спаечного процесса. Место дефекта изолировано лапароскопическими зажимами (рис. 5).
Для удобства интракорпорального шва через порт для ручной ассистенции был установлен троакар, после чего дефект артерии длиной до 3 мм был ушит (рис. 6).

Кровопотеря составила не более 200 мл. Послеоперационный период протекал без особенностей. Пациент выписан на 3-е сутки после операции.
Причина повреждения нижней полой вены в первом клиническом случае в сочетании факторов – гигантских размеров почек с ретрокавальным расположением медиального края правой почки и не диагностированный в предоперационном периоде крупный приток НПВ. В процессе выполнения правосторонней нефрэктомии произошел его отрыв у места впадения.
Интраоперационный конфликт с нижней полой веной может быть не менее опасным, чем повреждение магистральных артерий, что продемонстрировано в наших наблюдениях. Основное обстоятельство – потеря времени, которое уходит на определение источника кровотечения. Задача усложняется в условиях местной венозной гипертензии и развитых коллатеральных вен, например на фоне крупных опухолей почек или поликистоза. Причем предоперационная диагностика анатомических вариантов строения притоков НПВ, наличия и числа крупных патологических вен не всегда возможна в необходимом объеме [13]. В таких условиях оперативное пособие может сопровождаться «фоновым» венозным кровотечением, которое не будет клинически значимо, но может на какое-то время маскировать повреждение более крупных венозных стволов, что и стало основной причиной кровопотери в представленном клиническом случае. Вопрос конверсии также остается открытым. В обсуждаемой ситуации, по нашему мнению, лапаротомия не улучшила бы визуализацию и не снизила бы кровопотерю, но значительно ухудшила бы течение послеоперационного периода, что подтверждается нашим наблюдением. Ручная ассистенция позволила использовать все положительные стороны лапароскопии и открытой хирургии. Как результат – ранняя активизация, отсутствие послеоперационных осложнений, сравнительно короткий срок стационарного лечения. Во втором случае правильный порядок действий позволил максимально быстро справиться с возникшей ситуацией без каких-либо последствий.
Представлена схема (см. таблицу) с основными тактическими этапами хирургической коррекции ранения магистральных сосудов и соответствующие им технические приемы. Для быстрого перевода в режим ручной ассистенции: справа выполняется разрез в правой подвздошной области, как для аппендэктомии (для правшей), или верхнесрединная минилапаротомия (для левшей); слева для правшей верхнесрединная минилапаротомия или разрез левой подвздошной области для левшей. Длина разреза чуть больше ширины запястья оперирующего хирурга. Такой разрез достаточен для работы с минимальными потерями газа и объема брюшной полости без использования специальных устройств (hand-port), которые не всегда бывают доступными.

Расширение показаний к лапароскопическим операциям и повышение их сложности будут ассоциироваться с повышенным риском повреждения магистральных сосудов. Предложенная хирургическая тактика позволит оперирующему хирургу справиться с этой крайне непростой ситуацией в минимально возможное время и максимально безопасно для пациента.



