Доброкачественная гиперплазия предстательной железы (ДГПЖ) – полиэтиологическое заболевание, возникающее вследствие разрастания периуретральной железистой зоны предстательной железы, приводящего к обструкции нижних мочевыводящих путей.
Морфологический диагноз ДГПЖ подразумевает наличие стромальной и эпителиальной гиперплазии. Клинически ДГПЖ проявляется различными расстройствами мочеиспускания, связанными с нарушением пассажа мочи по нижним мочевыводящим путям и ухудшением накопительной функции мочевого пузыря c:
- необходимостью просыпаться ночью, чтобы опорожнить мочевой пузырь;
- уменьшением напряжения струи мочи;
- ощущением неполного опорожнения мочевого пузыря после мочеиспускания;
- появлением трудно сдерживаемых позывов к мочеиспусканию;
- учащением мочеиспускания в дневные часы;
- малообъемным мочеиспусканием.
Зачастую к перечисленным выше симптомам присоединяется затруднение в начале акта мочеиспускания, более выраженное утром и заставляющее пациентов натуживаться, чтобы начать мочиться. Все перечисленные симптомы, как правило, объединяют под общим названием «симптомы нижних мочевыводящих путей (СНМП)». При отсутствии адекватного лечения, особенно на конечных стадиях заболевания, резко возрастает риск возникновения острой задержки мочеиспускания и почечной недостаточности, а также развития таких осложнений ДГПЖ, как дивертикулы и камни мочевого пузыря, хронические воспалительные заболевания нижних мочевыводящих путей.
Симптомы нижних мочевыводящих путей встречаются не только при доброкачественном увеличении предстательной железы, но и могут присутствовать при сдежующих заболеваниях и синдромах:
- инфекции мочевой системы;
- гематурии;
- нейрогенных расстройствах мочеиспускания;
- гиперактивности мочевого пузыря;
- гипотонии детрузора;
- конкрементах дистального отдела мочеточника;
- ночной полиурии, обусловеленной эндокринологическими и/или кардиологическими заболеваниями;
- опухолях мочевого пузыря;
- стриктуре уретры;
- меатостенозе;
- применении лекарственных препаратов, угнетающих сократительную активность детрузора или увеличивающих тонус сфинктера мочевого пузыря;
- раке предстательной железы.
Одна из основных причин возникновения этих симптомов – увеличение предстательной железы в размерах. Именно увеличение предстательной железы служит неоспоримым доказательством наличия заболевания и наиболее частым проявлением его прогрессирования. У мужчин с объемом простаты более 50 см3
риск развития умеренных или тяжелых СНМП повышается в 5 раз и в 3 раза повышен риск возникновения выраженной инфравезикальной обструкции, соответствующей снижению максимальной скорости потока мочи Qmax<10 мл/с. Эти факты свидетельствуют о тесной связи между СНМП, инфравезикальной обструкцией и объемом предстательной железы.
В соответствии с современными представлениями о классификации симптомов расстройств мочеиспускания при ДГПЖ их принято подразделять на три категории.
- Симптомы фазы накопления:
- увеличение частоты мочеиспусканий;
- наличие императивных позывов;
- никтурия (ночная поллакиурия);
- ургентное недержание мочи.
- Симптомы фазы опорожнения:
- вялая струя мочи;
- разбрызгивание струи;
- прерывание струи;
- задержка начала мочеиспускания;
- необходимость натуживания в начале мочеиспускания;
- капельное окончание микции.
- Постмиктурические симптомы:
- постмиктурическое подкапывание;
- ощущение неполного опорожнения мочевого пузыря.
Это условное деление СНМП врачу при первичном осмотре выявлять превалирующую симптоматику. Симптомы нижних мочевыводящих путей разнообразны и неспецифичны, кроме того, специалисты различного уровня подготовки трактуют их по-разному. Внедрение в широкую практику некоторых элементов искусственного интеллекта, в частности экспертных систем и номограмм, значительно облегчает диагностику [47].
МКБ-10 • По МКБ-10 СНМП не являются отдельным синдромом и кодируются как различные заболевания, приводящие к ним. Наиболее часто встречаются следующие нозологии:
N40. Гиперплазия предстательной железы. Аденома простаты.
N31.0. Незаторможенный мочевой пузырь, не классифицированный в других рубриках.
N31.9. Нервно-мышечная дисфункция мочевого пузыря неуточненная.
N41.9. Воспалительная болезнь предстательной железы неуточненная.
N35. Стриктура уретры.
Возможно использование кодов отдельных симптомов:
R30. Боль, связанная с мочеиспусканием.
R31. Неспецифическая гематурия.
R32. Недержание мочи неуточненное.
R33. Задержка мочи.
R35. Полиурия, частое мочеиспускание, полиурия ночная [никтурия].
R39. Другие симптомы и признаки, относящиеся к мочевыделительной системе.
ЭПИДЕМИОЛОГИЯ
Средний возраст появления симптомов заболевания – 60 лет, хотя в США симптомы ДГПЖ выявляют у 40% мужчин 50–59 лет. У 30% мужчин старше 65 лет обнаруживают развернутую клиническую картину заболевания. У мужчин, чьи отцы страдали ДГПЖ, заболеваемость выше [21]. У мужчин моложе 30 лет гистологические признаки ДГПЖ не встречаются. С возрастом частота выявления ДГПЖ возрастает, достигая пика к девятому десятилетию жизни (90%). Пальпируемое увеличение простаты обнаруживают в 20% случаев у мужчин 60 лет и в 43% случаев у мужчин 80 лет. Однако увеличение простаты не всегда сочетается с клиническими проявлениями. Симптомы нижних мочевыводящих путей к 60 годам в какой-либо степени проявляются у 60% мужчин. При обследовании мужчин европеоидной расы СНМП (от средних до значительных проявлений) были выявлены у 13% пациентов 40–49 лет, а у пациентов старше 70 лет – в 28% случаев. В Канаде СНМП(от сильных до умеренных проявлений) обнаружили у 23% обследованных. В Шотландии и Нидерландах частота проявления симптомов возрастает с 14% в 40 лет до 43% в 60 лет. Распространенность от умеренных до тяжелых симптомов варьируется от 14% во Франции до 30% в Нидерландах. С каждой последующей декадой жизни удваивается количество мужчин с СНМП. В Германии приблизительно у 30% мужчин от 50 до 80 лет есть проявления этих симптомов.
ФАКТОРЫ РИСКА
Причина развития ДГПЖ до сих пор окончательно не установлена, но общепризнанным считают влияние двух факторов: изменение гормонального статуса мужчины и старение. Основываясь на многочисленных данных эпидемиологических и долгосрочных клинических рандомизированных исследований, ДГПЖ рассматривают как хроническое прогрессирующее заболевание. Доказанными факторами риска прогрессирования ДГПЖ считают [2, 3, 23]:
- возраст;
- уровень простатоспецифического антигена (ПСА) >1,5 нг/мл;
- объем предстательной железы ≥30 см3;
- СНМП средней и тяжелой степени выраженности [47].
Сахарный диабет и ДГПЖ сочетаются чаще, чем предполагает случайная вероятность, возможно, это связано с патогенезом данных заболеваний.
ПРОФИЛАКТИКА
Не разработана.
СКРИНИНГ
Мужчины старше 50 лет зачастую отмечают изменения мочеиспускания, поэтому им следует проводить скрининг ДГПЖ, выявляя симптомы опорожнения и накопления. Скрининг наиболее эффективен для мужчин с отягощенной наследственностью. Оптимальная частота контрольных обследований является предметом обсуждения, однако большинство специалистов согласны с необходимостью ежегодных осмотров. Последние включают пальцевое ректальное обследование, ультразвуковое исследование органов мочевой системы, урофлоуметрию, определение наличия и объема остаточной мочи (УЗИ после мочеиспускания) и определение уровня общего ПСА сыворотки крови. У пациентов возрастной группы до 50–55 лет при отсутствии приведенных выше факторов риска возможно проведение контрольных обследований 1 раз в 2 года.
КЛАССИФИКАЦИЯ
В клинической практике в настоящее время считают, что нормальный объем простаты – до 25–30 см3, малым называют объем простаты от 30 до 40 см3, средним – от 40 до 80 см3, более 80 см3 – крупным, превышающий 250 см3 – гигантским.
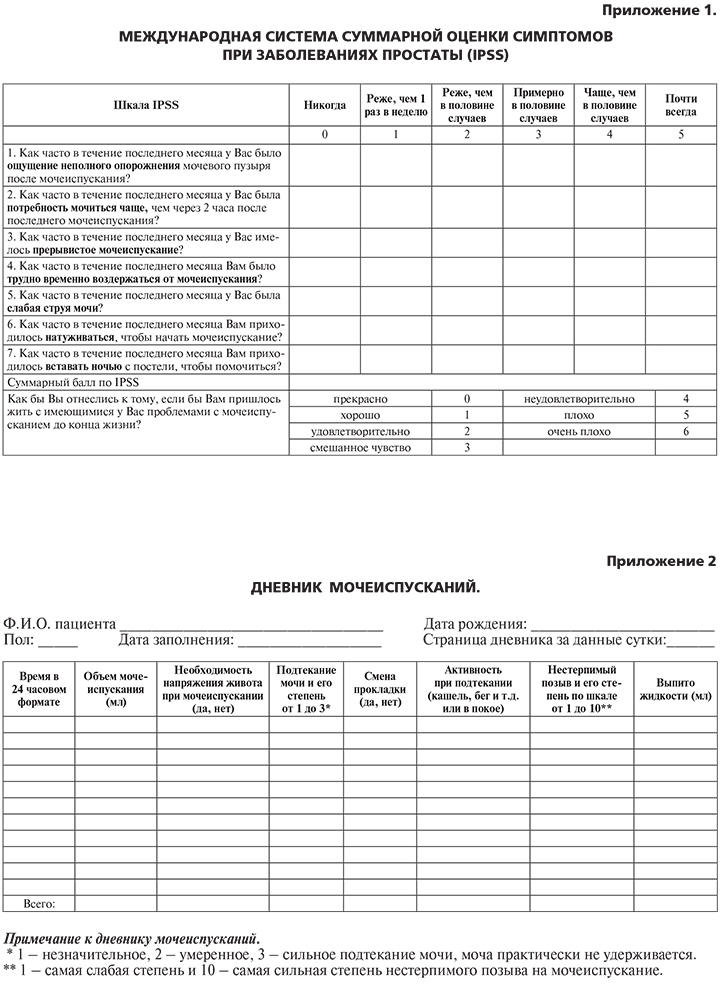
Симптомы нарушенного мочеиспускания классифицируют по степени, исходя из значений суммарного балла Международного индекса симптомов при заболеваниях простаты (IPSS – International Prostate Symptom Score), представленного в приложении 1:
- незначительные – 0–7 баллов;
- умеренные – 8–19 баллов;
- выраженные – 20–35 баллов.
В России иногда используется устаревшая классификация Гюйона, согласно которой выделяют три стадии болезни:
- I стадия – компенсации (незначительная дизурия при отсутствии остаточной мочи);
- II стадия – субкомпенсации (симптоматика заболевания прогрессирует, имеется остаточная моча, почки и верхние мочевыводящие пути проходят этапы снижения функционального состояния, часто возникают осложнения болезни);
- III стадия – декомпенсации (полная декомпенсация функции мочевого пузыря, парадоксальная ишурия, выраженный уретерогидронефроз и хроническая почечная недостаточность [ХПН]) [3].
ДИАГНОСТИКА
Жалобы и анамнез
Диагностика ДГПЖ основывается на жалобах, анамнезе, данных физического обследования, лабораторных и инструментальных методов исследования. Жалобы больных выявляют и анализируют с помощью вопросника IPSS (см. приложение 1), который обладает высокой специфичностью (79%) и чувствительностью (83%)B [8, 30]. Следует отметить отсутствие корреляции между интенсивностью жалоб пациентов, объективной выраженностью расстройств мочеиспускания и размерами предстательной железы [19].
Большой диагностической ценностью обладает Дневник регистрации качества и частоты мочеиспусканий (Приложение 2), который заполняется пациентом в течение 3 сут и включает информацию о времени каждого мочеиспускания, объеме выделенной мочи, объеме и характеристике потребляемой жидкости, наличии ургентных позывов к мочеиспусканию, эпизодов недержания мочи и необходимости прерывать сон для опорожнения мочевого пузыря. Дневник прост в заполнении, не требует материальных затрат и предоставляет врачу наиболее полную клиническую картину заболевания, позволяя уточнить жалобы больного, например отличить никтурию от ноктурии (ночная поллакиурия) [9, 28, 41].
Физикальное обследование
Пальцевое ректальное исследование (ПРИ) предстательной железы. В ходе его выполнения определяются примерный размер предстательной железы, ее консистенция и болезненность при пальпации, выраженность срединной бороздки, подвижность слизистой оболочки прямой кишки над железой и тонуса сфинктера прямой кишки. Наличие асимметрии предстательной железы, участков уплотнения, зон хрящевидной консистенции является основанием для дополнительного обследования, цель которого – исключение рака предстательной железы. Нарушение тонуса сфинктера прямой кишки может свидетельствовать о неврологической этиологии расстройств мочеиспускания. Размеры предстательной железы при ПРИ не всегда коррелируют с жалобами пациента [32].
В физикальное обследование входят элементы неврологического осмотра с оценкой выраженности некоторых рефлексов. Оценивают сохранность сенсорной чувствительности в области промежности, бедер, перианальной области. Снижение или полная утрата чувствительности может свидетельствовать о генерализованной периферической нейропатии, поражении спинного мозга.
Также необходимо провести исследование ряда рефлексов. Повышение активности глубоких сухожильных рефлексов указывает на повреждение нервных путей от головного до передних рогов спинного мозга (рефлекс Бабинского). Определение анального и бульбокавернозного рефлексов позволяет оценить сохранность спинномозгового рефлекса на уровне крестцового отдела спинного мозга.
Лабораторные и инструментальные исследования
- Общий анализ мочи необходим для диагностики заболеваний почек, мочевого пузыря и уретры.
- Концентрацию креатинина в сыворотке крови определяют для уточнения суммарного функционального состояния почек и исключения почечной недостаточности. Было обнаружено, что азотемия встречается в 15–30% случаев при ДГПЖ.
- Всем больным ДГПЖ для исключения РПЖ целесообразно исследовать концентрацию общего простатоспецифического антигена (ПСА) в сыворотке крови. Условной границей нормы ПСА по-прежнему считается 4 нг/мл, однако нельзя забывать, что большое значение имеет также возраст пациента и объем предстательной железы. Чувствительность определения общего ПСА в диагностике рака простаты – 70%, в то время как специфичность этого показателя колеблется в пределах 65–70%. Существует понятие возрастной нормы ПСА. Так, у пациента с ДГПЖ объемом 40 см3 уровень ПСА должен быть менее 1,6 нг/мл в 50 лет, менее 2,0 нг/мл в 60 лет и должен превышать 2,3 нг/мл в 70-летнем возрасте [48]. Более подробные рекомендации по интерпретации уровня общего ПСА сыворотки крови смотрите в главе настоящих рекомендаций, посвященной диагностике и лечению РПЖ.
- УЗИ простаты (желательно трансректальным датчиком). Ультразвуковое исследование верхних мочевых путей не является рутинным для пациентов с СНМП/ДГПЖ и выполняется только при наличии подозрения на опухоли верхних мочевыводящих путей.
- Урофлоуметрия. Особое значение уделяется форме урофлоуметрической кривой и значению Qmax – максимальной скорости потока мочи. Для интерпретации результатов этого исследования объем мочеиспускания должен быть не менее 150 мл. В противном случае Qmax может быть не валидной. Условной границей нормы Qmax считается 15 мл/с. При максимальной скорости потока мочи, равной 15 мл/с или больше, вероятность инфравезикальной обструкции (ИВО) очень небольшая. Напротив, Qmax в 10 мл/с со специфичностью 70% и чувствительностью в 47% свидетельствует о наличии ИВО.
- Определение объема остаточной мочи. Объем остаточной мочи менее 50 мл ассоциирован с низким риском наличия выраженной инфравезикальной обструкции. Большой объем остаточной мочи является противопоказанием к назначению динамическогго наблюдения и существенно снижает вероятность успеха медикаментозной терапии. Объем остаточной мочи следует контролировать для выявления риска развития задержки мочи и у пациентов, которым проводится терапия препаратами с антихолинэстеразной активностью.
- Комплексное уродинамическое исследование.
У мужчин старше 50 лет СНМП, как правило, связаны с ДГПЖ [6, 12]. В особых случаях, например при наличии сопутствующих неврологических заболеваний, больным, имевшим в анамнезе травмы позвоночника и органов таза, больным моложе 50 и старше 50 лет целесообразно проведение комплексного уродинамического обследования – цистометрии наполнения, исследования соотношения давление/поток, электромиографии тазового дна. Комплексное уродинамическое исследование позволяет дифференцировать причины расстройства мочеиспускания – инфравезикальную обструкцию, нарушение сократительной способности мочевого пузыря и сложные нейрогенные расстройства мочеиспускания, такие как детрузорно-сфинктерная диссинергия, гиперактивность и гипоактивность детрузора и т.д. [37].
Показания к комбинированному уродинамическому исследованию:
- возраст пациента моложе 50 лет;
- объем мочеиспускания при урофлоуметрии менее 150 мл;
- объем остаточной мочи 300 мл и более;
- максимальная объемная скорость мочеиспускания 15 мл/с и более при жалобах на наличие СНМП;
- подозрение на нейрогенную дисфункцию мочевого пузыря;
- состояние после оперативного лечения (в том числе неэффективного) органов таза.
Из всех уродинамических исследований «соотношение давление/поток» обладает наибольшей диагностической ценностью. Методика исследования подразумевает измерение давления детрузора в момент максимальной скорости потока мочи (при урофлоуметрии). Пациенты с высоким давлением детрузора и низкой скоростью потока мочи имеют лучшие результаты оперативного лечения, чем пациенты с низким внутрипузырным давлением и низкой скоростью потока мочи [4, 24, 32, 33], поскольку у первых имеется доказанная инфравезикальная обструкция, в то время как у вторых причина СНМП кроется в нарушении сократительной способности мочевого пузыря.
- Обзорную и экскреторную урографию не считают обязательным исследованием для больных ДГПЖ. Их выполняют по следующим показаниям:
- наличие (в том числе в анамнезе) инфекции мочевыводящих путей (ИМП), мочекаменной болезни, оперативных вмешательств на мочевыводящих путях;
- подозрение на опухоль;
- гематурия;
- При наличии гематурии для исключения опухоли мочевого пузыря показана уретроцистоскопия.
- В отдельных случаях для исключения рака мочевого пузыря (РМП) и РПЖ выполняют компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ). В рутинной практике они не применяются.
Дифференциальная диагностика
Дифференциальную диагностику проводят с заболеваниями и патологическими состояниями, представленными ниже.
- Фимоз – невозможность отведения крайней плоти за головку полового члена.
- Сужение наружного отверстия уретры (меатостеноз), требующее либо дилатации, либо оперативного лечения – меатотомии, меатопластики.
- Стриктура уретры.
- Камни мочевого пузыря, вызывающие дизурию, боль в надлобковой области с иррадиацией в головку полового члена, прерывистую струю мочи, диагностируемые обычно у мужчин с инфравезикальной обструкцией.
- Камни уретры, которые бывают первичными (крайне редко), вторичными (мигрировавшими в уретру из вышележащих отделов мочевыводящих путей). Заболевание проявляется дизурией, слабостью струи мочи или острой задержкой мочеиспускания.
- Камни дистального отдела мочеточников.
- Клапаны уретры (как правило, выявляются в раннем возрасте).
- Уретриты диагностируют по наличию дизурии, сочетающейся со слизисто-гнойными выделениями из уретры.
- РПЖ, проявляющийся СНМП, как фазы опорожнения, так и накопления. В ходе ПРИ в предстательной железе могут выявляться очаги уплотнения.
- Острый простатит (абсцесс простаты) проявляется выраженным дискомфортом или болью в перианальной области, болью в пояснично-крестцовой области, высокой лихорадкой. Предстательная железа при ПРИ увеличена, отечна, резко болезненна. При абсцессе обнаруживают очаги размягчения.
- Хронический простатит, для которого характерно сочетание нормальных (либо несколько увеличенных) размеров простаты с симптомами инфекционно-воспалительного процесса, подтверждаемыми исследованием секрета простаты.
- Склероз простаты, характеризуемый дизурией на фоне уменьшения размеров и/или уплотнения простаты.
- Склероз шейки мочевого пузыря (болезнь Мариона), обычно встречаемый в более молодом, чем при ДГПЖ, возрасте и проявляемый постепенным нарастанием симптоматики в течение длительного периода времени.
- Нейрогенные расстройства мочеиспускания, которые могут быть обусловлены травмой спинного мозга, рассеянным склерозом, инсультом, болезнью Паркинсона, сахарным диабетом.
- РМП нередко манифестирует безболевой макро- или микрогематурией; 30% пациентов с этим заболеванием могут страдать от дизурии, вплоть до императивных позывов на мочеиспускание.
- Цистит редко возникает у мужчин. Больных беспокоят дизурия, боль в надлобковой области. Характерны усиление боли в конце акта мочеиспускания и временное уменьшение боли после его завершения.
- Сахарный диабет, зачастую проявляющий себя полиурией.
- Побочное действие лекарственных средств, снижающих сократительную способность мочевого пузыря или увеличивающих тонус шейки мочевого пузыря.
ЛЕЧЕНИЕ
Пациенту следует подробно рассказать обо всех возможных видах лечения. Больным с незначительно и умеренно выраженными СНМП можно рекомендовать поведенческую терапию, динамическое наблюдение или медикаментозную терапию. При выраженной симптоматике показано хирургическое вмешательство. Больным с выраженной симптоматикой ДГПЖ и абсолютными противопоказаниями к оперативному лечению также назначают лекарственную терапию.
Показания к госпитализации
Пациентов экстренно госпитализируют при:
- острой задержке мочеиспусканияD;
- развитии острой почечной недостаточности (ОПН)D;
- гематурии и тампонаде мочевого пузыря.
После разрешения острой задержки мочеиспускания необходимо проводить мониторинг объема циркулирующей жидкости, АД, концентрации электролитов в связи с возможным развитием угрожающих жизни нарушений водно-электролитного баланса [4]. Дренирование мочевого пузыря (катетеризация, установка троакарной цистостомы) может спровоцировать развитие макрогематурии.
Плановую госпитализацию пациентов осуществляют для оперативного лечения или при необходимости обследования, которое невозможно выполнить в амбулаторных условиях.
Немедикаментозное лечение
Немедикаментозное лечение показано пациентам с незначительной симптоматикой.
Тактика выжидательного наблюдения при СНМП/ДГПЖ заключается в образовании пациента, динамическом наблюдении и рекомендациях по изменению образа жизни (поведенческая терапия).
Больному рекомендуются следующие мероприятия:
- уменьшить потребление жидкости за 3 ч до отхода ко сну;
- обязательно опорожнять мочевой пузырь перед сном;
- иногда может быть рекомендована техника «двухэтапного мочеиспускания»;
- лечение запоров;
- при постмиктурическом дриблинге хорошие результаты дает применение техники «сдаивания», подразумевающая мануальное удаление мочи из мочеиспускательного канала движениями от корня полового члена в дистальном направлении;
- за 3 ч до сна отказаться от потребления продуктов, обладающих мочегонным действием (чай, кофе, фрукты, ягоды, алкоголь, молочные продукты);
- стараться избегать применения диуретиков, антихолинэстеразных лекарственных средств в вечернее время.

Пациентам, имеющим СНМП с расстройствами фазы «накопления», при наличии гиперактивного мочевого пузыря (ГМП) можно рекомендовать упражнения по тренировке мышц мочеполовой диафрагмы (упражнения Кегеля, лечебную гимнастику) [62].
Контрольные обследования у уролога каждые 6–12 мес.
Медикаментозное лечение
С учетом прогрессирующего характера данного заболевания медикаментозную терапию СНМП следует проводить длительно (иногда в течение всей жизни пациента). В зависимости от превалирования симптомов фазы опорожнения или накопления медикаментозная терапия может существенно различаться.
● Альфа-адреноблокаторы. Пациентам с симптомами ДГПЖ фазы опорожнения при отсутствии задержки мочеиспускания лекарственную терапию следует начинать с α-адреноблокаторов [26, 27, 64]. Эта группа препаратов долгие годы считается «терапией первой линии» в лечении больных ДГПЖ и представлена 5 медикаментами, эффективность которых при назначении в приведенных ниже дозах одинакова. Препараты различаются профилем безопасности – вероятностью развития побочных эффектов, наиболее частым из которых является снижение артериального давления. Международные данные свидетельствуют о высокой эффективности этих препаратов, заключающейся в 30–40%-ном уменьшении балла IPSS и увеличении максимальной скорости потока мочи приблизительно на 20–25%. Эти препараты могут уменьшать выраженность симптомов фазы как накопления, так и опорожнения, но больше эффективны для пациентов с небольшим объемом простаты. В длительных исследованиях они не продемонстрировали способности предотвращать прогрессирование ДГПЖ, не снижают вероятности развития острой задержки мочеиспускания, не влияют на объем простаты и не предотвращают постепенного увеличения предстательной железы в размерах [49, 50].
- Тамсулозин в дозе 0,4 мг/сут. Препараты на основе тамсулозина являются самыми популярными в России и во всем мире и среди других α-адреноблокаторов обладают благоприятным профилем безопасности и удобством приема (не требуют подбора дозы, принимаются 1 раз в сутки).
- Альфузозин назначается в дозе 10 мг/сут и также обладает высоким уровнем безопасности.
- Силодозин применяется в дозе 8 мг 1 раз в сутки [46]. Это новый α-адреноблокатор, который обладает наибольшей избирательностью в отношении α1А-адренорецепторов предстательной железы по сравнению с α1В-адренорецепторами гладких мышц сосудов и селективностью к рецепторам α1А-подтипа по сравнению с подтипами α1В и α1D. При его назначении следует учитывать тот факт, что на фоне лечения силодозином более 20% пациентов отмечают расстройства эякуляции. Эффект преходящ, исчезает вскоре после отмены препарата и очень редко бывает причиной отказа от лечения пациентов с СНМП, развившимися на фоне ДГПЖ.
- Теразозин – α-адреноблокатор, на фоне которого может регистрироваться некоторое снижение артериального давления. Дозу препарата повышают постепенно с 1 до 10 мг/сут и принимают преимущественно перед сном.
- Доксазозин также относится к препаратам, нуждающимся в титровании дозы. Его назначают начиная с 1 мг/сут, постепенно увеличивая дозу до 8 мг/сут. При его назначении также следует контролировать уровень артериального давления.
● Ингибиторы 5-альфа-редуктазы. Больным с объемом предстательной железы 40 см3 и более или повышенным значением ПСА (>1,4–1,6 нг/мл) [47] оправданно назначение ингибиторов 5α-редуктазы, которые при нормальной переносимости необходимо принимать длительно или пожизненно [20]. Ингибиторы 5α-редуктазы – единственная группа препаратов, уменьшающая объем предстательной железы в среднем на 25–30%, предотвращающая дальнейший ее рост и развитие/прогрессирование ДГПЖ. При этом происходит уменьшение балла IPSS на 15–30%. При постоянном длительном приеме ингибиторы 5α-редуктазы снижают риск оперативного вмешательства и острой задержки мочеиспускания. Они также могут снижать риск кровотечения (уменьшать выраженность кровотечения) при назначении курсовой терапии перед ТУРП. [65]
- Финастерид назначается в дозе 5 мг/сут [44].
- Дутастерид – в дозе 0,5 мг/сут.
Эффект действия препаратов отсрочен во времени и проявляется не ранее чем через 6 (дутастерид) и 12 мес (финастерид). Применение коротких курсов ингибиторов 5α-редуктазы не оправданно.
Наиболее часто встречающийся побочный эффект препаратов этой группы – ухудшение сексуальной функции. В недавних исследованиях было показано, что выраженность этого эффекта уменьшается после года непрерывного приема препаратов. Гинекомастия выявляется у 1–2% пациентов. Важно помнить, что ингибиторы 5α-редуктазы снижают концентрацию ПСА сыворотки крови в 2 раза, что имеет большое значение для диагностики рака простаты. На фоне терапии препаратами этой фармакологической группы следует для получения истинного значения ПСА увеличивать лабораторные показатели в 2 раза.

● Антагонисты мускариновых рецепторов. Эти препараты также называются медикаментозными средствами с антихолинергической активностью. Они могут назначаться как терапия первой линии у больных с выраженными расстройствами мочеиспускания фазы накопления при отсутствии или минимальной выраженности расстройств фазы опорожнения. Еще одним официальным показанием для их назначения являются сохраняющиеся СНМП после месяца непрерывной терапии α-адреноблокаторами в активной терапевтической дозировке. При этом антимускариновые препараты назначаются в комбинации с альфа-адреноблокаторами. Подробнее о возможности их комбинированного применения см. ниже. При их назначении отмечается положительная динамика в отношении никтурии, частоты дневных мочеиспусканий и выраженности ургентности. Отмечено также некоторое уменьшение балла IPSS. Основной принцип их действия – блокирование проводимости по волокнам парасимпатической нервной системы. Блокаторы мускариновых рецепторов уже более 20 лет являются препаратами «выбора» в лечении гиперактивного мочевого пузыря. Опыт лечения пациентов с ДГПЖ этими препаратами пока небольшой. Назначение антимускариновых препаратов у пациентов с выраженной инфравезикальной обструкцией и большим количеством остаточной мочи не показано. При соблюдении этих принципов вероятность развития ОЗМ на фоне терапии антимускариновыми препаратами не превышает 1 случай на 10 000 назначений.
Пациентам с СНМП на фоне ДГПЖ могут назначаться солифенацин, толтеродин и фезотеродин в стандартных терапевтических дозировках. Эффективность применения этих препаратов доказана в немногочисленных международных клинических исследованиях. Применение антимускариновых препаратов требует ультразвукового мониторинга количества остаточной мочи [47].

● Ингибиторы фосфодиэстеразы 5-го типа (иФДЭ5). Препараты этой фармакологической группы за счет увеличения внутриклеточной концентрации циклического гуанозинмонофосфата снижают тонус гладких мышц детрузора, предстательной железы и уретры [51]. Другим доказанным механизмом их воздействия на органы малого таза является улучшение кровотока в этой области [52]. Они также способствуют уменьшению активности хронических воспалительных процессов в простате и мочевом пузыре [53].
Единственным препаратом этой группы, официально разрешенным к применению для лечения СНМП у больных ДГПЖ, является тадалафил, назначаемый ежедневно в дозировке 5 мг/сут. Он вызывает снижение балла IPSS на 22–37% за счет уменьшения выраженности обеих групп симптомов – фазы опорожнения и накопления. При этом существенного изменения максимальной скорости потока мочи в большинстве проведенных исследований не зарегистрировано [66].
Тадалафил может назначаться в режиме монотерапии и в комбинации с α-адреноблокаторами. Безопасным сочетанием является его одновременное назначение с тамсулозином и силодозином. Стандартное противопоказание к назначению ингибиторов фосфодиэстеразы 5-го типа из-за высокого риска гипотонии – их сочетание с нитратами.
Информация о влиянии иФДЭ5 на объем простаты и риск прогрессирования заболевания отсутствует.

● Органотропные препараты на основе экстракта простаты. Механизм действия до конца не изучен (имеются отдельные российские исследования, подтверждающие положительный эффект препаратов). Международные исследования, позволяющие рассматривать возможность назначения органотропных препаратов с позиций «доказательной медицины», не проводились, в связи с чем сформулировать показания к их применению не представляется возможным.
● Препараты из растительного сырья. Несмотря на отсутствие доказанной эффективности лекарственных препаратов растительного происхождения в международных клинических исследованиях, фитотерапия ДГПЖ остается популярной в России и еще в нескольких странах мира. Сложный механизм действия фитопрепаратов труден для детального изучения, поскольку последние состоят из различных растительных компонентов. Учитывая тот факт, что большинство этих препаратов во всем мире относятся к классу биологически активных добавок, их сравнительного изучения не проводилось. В России распространены фитопрепараты на основе экстракта Serenoa repens, Pigeum Africanum, Hypoxisrooperi, Urticadioica и еще нескольких растений.

● Бета-3-агонисты. Новая фармакологическая группа препаратов для лечения ГАМП – это агонисты бета-3-адренорецепторы. Бета-3-адренорецепторы являются преобладающими среди бета-рецепторов, расположенных в гладкомышечных клетках детрузора и их стимуляция индуцирует расслабление детрузора. Мирабегрон 50 мг – первый представитель этого класса препаратов. С 2013 г. препарат стал доступным в Европе под названием «Бетмига». Широко приемняется в Японии, Северной Америке, Австралии. Мирабегрон производится в форме таблеток с контролируемой абсорбцией. Исходно препарат позиционировался как альтернатива антихолинэестеразным средствам при их недостаточной эффективности. Показанием к его назначению является гиперактивность мочевого пузыря. Мирабегрон высокоселективен в отношении бета-3-адренорецепторов: его сродство к бета-3-адренорецепторам в 105 и 33 раза выше, чем к бета-1- и бета-2-адренорецепторам соответственно. Активация бета-3-адренорецепторов с помощью мирабегрона стимулирует расслабление детрузора и способствует удержанию мочи, приводя к увеличению накопительной емкости мочевого пузыря и интервала между мочеиспусканиями [63].
Существенным преимуществом мирабегрона является то, что он свободен от типичных побочных эффектов, присущих холинолитикам: сухости во рту, запоров и повышения внутриглазного давления. Наиболее распространенными побочными явлениями в группе мирабегрона были гипертензия (7,3%), назофарингит (3,4%)
Литературные данные о применении препарата пациентами с ДГПЖ в настоящее время немногочисленны и свидетельствуют об отсутствии зачимых колебаний объема остаточной мочи и максимальной скорости мочеиспускания на фоне терапии мирабегроном [67], Имеются отдельные публикации об эффективности комбинации мирабегрона с тамсулозином у пациенов с сочетанной симптоматикой – наличием расстройств фазы наполнения и опорожнения [47]. Единичные работы свидетельствуют о возможности сочетания мирабегрона с м-холинолитиками. Такая комбинация оказалась более эфективной в устранении симптомов расстройства фазы наполнения, чем монотерпия этими препаратами [70].

● Аналоги вазопрессина. Десмопрессин – синтетический аналог антидиуретического гормона, позволяющий значительно увеличить реабсорбцию в канальцах почек и снизить объем выделяемой мочи. Препарат является эффективным методом борьбы с никтурией, если ее причина – ночная полиурия. Десмопрессин не оказывает влияния на все прочие СНМП. Применять следует с осторожностью, контролируя уровень натрия в сыворотке крови через 3 дня, неделю, месяц после начала использования и далее каждые 3–6 мес при постоянном приеме. Назначать этот препарат лучше после консультации и под контролем терапевта [47].

КОМБИНИРОВАННАЯ МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Комбинированное применение ингибиторов 5α-редуктазы и α-адреноблокаторов
Работы последних лет доказали сложный патогенез расстройств мочеиспускания у больных ДГПЖ. Причины нарушения мочеиспускания – инфравезикальная обструкция и ослабление функции детрузора.
Известно, что действие ингибиторов 5α-редуктазы основывается на снижении активности тканевых факторов роста и активации апоптоза, что при длительном применении способствует уменьшению размеров предстательной железы и снижению выраженности механического компонента инфравезикальной обструкции. Выше приводилась информация о способности ингибиторов 5α-редуктазы снижать риск прогрессирования ДГПЖ. В основе механизма действия α-адреноблокаторов лежит расслабление гладкой мускулатуры шейки мочевого пузыря и уретры вследствие блокады α1-адренорецепторов и устранения динамического компонента инфравезикальной обструкции. При этом действие α-адреноблокаторов сказывается вскоре после начала лечения. Очевидно, комбинированное назначение препаратов двух различных фармакологических групп позволяет оказывать воздействие на сложные механизмы патогенеза СНМП и вызывать существенное улучшение качества жизни больных ДГПЖ.
В последние годы все больше урологов уделяют особое внимание комбинированному лечению ДГПЖ. Наиболее значительные результаты в этой области достигнуты благодаря исследованиям MTOPS и CombAT. В первом риск прогрессирования ДГПЖ на фоне комбинированной терапии финастеридом и доксазозином оказался на 64% ниже, чем в группе плацебо. А вероятность оперативного вмешательства была ниже на 67%. Результаты 4-летнего комбинированного назначения ингибитора обоих типов 5α-редуктазы – дутастерида и суперселективного α-адреноблокатора тамсулозина (исследование CombAT) – показали, что общий риск прогрессирования ДГПЖ снизился на 41%, вероятность развития острой задержки мочи – на 68%, а необходимость оперативного вмешательства – на 71%. Следует отметить, что CombAT – единственное в своем роде исследование, включившее пациентов высокого риска прогрессирования ДГПЖ. В MTOPS и CombAT было доказано однозначное преимущество длительной комбинированной терапии над монотерапией ингибитором 5α-редуктазы или α-адреноблокатором по всем исследуемым параметрам – динамике СНМП, показателю качества жизни и риску прогрессирования заболевания. Причем эффективность комбинированной терапии была доказана для всех пациентов, включенных в исследование, независимо от исходных данных (первоначальной степени тяжести симптомов, исходного объема простаты, предыдущей терапии, возраста пациента, исходного значения ПСА и других факторов).
В исследовании CONDUCT в течение двух лет изучалась эффективность комбинированного назначения дутастерида и тамсулозина по сравнению с плацебо в группе из 742 пациентов со средней выраженностью СНМП и высоким риском прогрессирования заболевания. Было доказано, что комбинированное назначение статистически значимо предотвращало прогрессирование заболевания и способствовало уменьшению выраженности симптомов по данным динамики балла IPSS. Общее снижение риска прогрессирования составило 11,3% по сравнению с группой плацебо – 43,1% [68]. Это оптимальная медикаментозная терапия для пациентов высокого риска прогрессирования заболевания: пациенты со среднетяжелыми и тяжелыми симптомами ДГПЖ. До начала лечения необходимо оговорить с пациентом длительный характер такого лечения – более 12 мес. У больных с умеренно выраженными СНМП может обсуждаться возможность последующей (по прошествии 6 мес) отмены α-адреноблокатора [47].

Комбинированное применение α-адреноблокаторов и антагонистов мускариновых рецепторов
Для понимания патогенеза СНМП определенный интерес представляет теория, объясняющая значение мышцы мочевого пузыря (детрузора) в процессе формирования симптомов расстройства мочеиспускания. Доказано, что спонтанные сокращения детрузора приводят к возникновению частых, а иногда и императивных позывов к мочеиспусканию. Такая совокупность симптомов расстройства фазы накопления объединяется понятием «гиперактивный мочевой пузырь». Современные эпидемиологические исследования указывают на широкую распространенность симптомов гиперактивного мочевого пузыря у взрослого населения Европы. До сих пор предметом обсуждения остается первичность или вторичность гиперактивности мочевого пузыря у пациентов с инфравезикальной обструкцией, но никто из специалистов не отрицает наличия причинно-следственной связи между этими двумя состояниями.
Одним из перспективных направлений медикаментозного лечения СНМП является комбинированное назначение α-адреноблокатора и средств с антимускариновой активностью. Первый класс препаратов эффективно устраняет симптомы инфравезикальной обструкции, в то время как второй способен значительно снизить выраженность накопительных расстройств. Немногочисленные работы по комбинированному назначению этих препаратов освещают опыт применения доксазозина, тамсулозина и теразозина с оксибутинином, солифенацином и толтеродином. Такое лечение может быть рекомендовано пациентам со средней и тяжелой симптоматикой при отсутствии эффекта от монотерапии этими препаратами [69]. Больным, у которых количество остаточной мочи превышает 150 мл, это лечение следует назначать с осторожностью, под контролем ультразвукового исследования [47].

ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Суть любого оперативного вмешательства при ДГПЖ – устранение механической обструкции на уровне простатического отдела мочеиспускательного канала. Операции по поводу ДГПЖ – одни из наиболее распространенных хирургических вмешательств для пожилых мужчин [25]. В среднем 30% мужчин в течение жизни переносят ту или иную операцию по поводу этого заболевания [10, 43]. Из всех пациентов, для которых первым проявлением заболевания стала острая задержка мочеиспускания, 60% переносят оперативное лечение в течение 1 года и 80% – в течение 7 лет [14].
Существуют общепринятые показания к оперативному лечению ДГПЖ. К ним относятся выраженная инфравезикальная обструкция, неэффективность предшествовавшей медикаментозной терапии, выраженная симптоматика, наличие осложнений ДГПЖ (ХПН, камни мочевого пузыря), интермиттирующая макрогематурия, большое количество остаточной мочи (хроническая задержка мочеиспускания), рецидивирующая задержка мочеиспускания [1, 3]. Относительным показанием к операции является наличие «средней доли», присутствие которой, как известно, существенно снижает вероятность успеха медикаментозной терапии. Увеличение простаты, даже весьма выраженное, не сопровождаемое тяжелой симптоматикой, показанием к выполнению оперативного вмешательства не является, но в то же время это один из факторов прогрессирования заболевания.
Наиболее популярные виды оперативного вмешательства у больных ДГПЖ: монополярная или биполярная трансуретральная резекция простаты (ТУРП), монополярная трансуретральная вапоризация простаты (ТУВП), лазерная энуклеация простаты гольмиевым лазером (HoLEP), позадилонная и чреспузырная аденомэктомия (простатэктомия).
Необходимо отметить, что в особенно тяжелых случаях декомпенсированной ДГПЖ при выраженной хронической задержке мочеиспускания, тяжелой ХПН и других состояниях возможно выполнение «двухэтапного лечения». При этом первым этапом является суправезикальная деривация мочи (цистостомия), позволяющая в последующем назначать пациенту специфическую терапию по восстановлению сократительной способности мочевого пузыря и устранению клинических проявлений ХПН. Позднее выполняется «отсроченная операция» по удалению аденоматозных узлов одним из перечисленных выше способов. Система скрининга заболеваний предстательной железы, приведенная нами в начале данной главы, существенно сократила количество пациентов, нуждающихся в «двухэтапном лечении».
ТУР предстательной железы – «золотой» стандарт оперативного лечения ДГПЖ. Применяется при объеме простаты от 30 до 80 см3. В отдельных клиниках, располагающих большим опытом выполнения ТУРП, верхняя граница объема простаты, подлежащей ТУРП, может повышаться до 120 см3. Метод эффективен для 80% пациентов. Результатом этой операции является увеличение максимальной скорости потока мочи на 163%, снижение балла IPSS на 70% и балла QoL на 69%. Количество остаточной мочи уменьшается на 77% [54]. Имеются данные исследований эффективности ТУРП с продолжительностью наблюдения за пациентами более 20 лет. Ни один другой метод не имеет столь убедительной доказательной базы.
В зависимости от объема удаленной ткани простаты следует различать следующие виды ТУРП:
- «псевдо-ТУР» (удаляется лишь небольшая часть гиперплазированной ткани – 10–20% объема, не более 10–15 г) преимущественно из области шейки мочевого пузыря или часть средней доли ДГП (создание «мочевой дорожки»);
- «парциальная ТУР» (удаляется 30–80%). В зависимости от объема резекции «парциальную ТУР» подразделяют на «паллиативную ТУР» и «субтотальную ТУР»;
- «тотальная ТУР» (трансуретральная простатэктомия): удаляется практически 90–100% объема гиперплазированной ткани, что соответствует открытой операции.
Радикальность выполнения ТУРП определяет риск необходимости повторного вмешательства. В среднем этот риск составляет 1–2% в год. На примере более чем 20 тыс. пациентов было продемонстрировано, что повторная операция (реТУРП,уретротомия или резекция шейки мочевого пузыря) потребовалась 5,8, 12,3 и 14,7% пациентов через 1 год, 5 и 8 лет наблюдения [55]. Смертность после этой операции составляет 0,1% [56]. Наиболее часто встречающиеся осложнения – кровотечение (2,9%), тампонада мочевого пузыря (4,9%), инфекционные осложнения (4,1%), эректильная дисфункция (6,5%), ретроградная эякуляция (65,4%), стриктура уретры (5–7%), склероз шейки мочевого пузыря (2–4%), недержание мочи (1–2%), ТУР-синдром (0,8%) [39, 57].
Биполярная трансуретральная резекция простаты – одна из модификаций традиционной трансуретральной резекции простаты с применением биполярной плазмокинетической технологии. Техника выполнения оперативного вмешательства идентична монополярной трансуретральной резекции простаты. Отличие состоит в том, что операция выполняется в физиологическом растворе, а энергия не проходит через тело пациента, распространяясь между двумя полюсами на петле (истинная биполярная резекция) или петлей и тубусом резектоскопа (псевдобиполярная резекция). У биполярной резекции более выраженный коагуляционный эффект и лучшая безопасность для пациентов с повышенной кровоточивостью и/или использующих кардиостимуляторы. Тем не менее по-прежнему имеется дефицит данных по отсроченным результатам биполярного ТУРП, что не позволяет достоверно оценить преимущества биполярной технологии над традиционным монополярным оперативным вмешательством [47].
Открытая аденомэктомия (чреспузырная, позадилонная, промежностная) описана более 100 лет назад и по-прежнему актуальна для пациентов с большим объемом предстательной железы (>80–100 cм3). При высокой эффективности этот вариант оперативного вмешательства наиболее травматичный и сопряжен с высоким риском осложнений. Выраженность СНМП после операции снижается на 63–86% (балл IPSS с 12,5–23,3), балл QoL уменьшается на 60–87%, максимальная скорость потока мочи возрастает на 375% (+16,5–20,2 мл/с), а объем остаточной мочи снижается на 86–98% [58, 59]. Эффект операции стойкий, рецидивы регистрируются очень редко и в основном «ложные» (обусловлены разрастанием резидуальной аденоматозной ткани, не удаленной в ходе первой операции. Смертность после этой операции менее 1%, частота гемотрансфузии – 7–14%, вероятность недержания мочи – до 10%), склероз шейки мочевого пузыря и стриктуры уретры регистрируются у 6% пациентов [58, 59].
Трансуретральная инцизия предстательной железы (ТУИП) показана пациентам с небольшим размером простаты (менее 30 см3). Эффективность вмешательства составляет 78–83%, а частота осложнений значительно ниже по сравнению с ТУР: ретроградная эякуляция возникает не более чем в 25% случаев [1, 3].
Современные лазерные технологии: гольмиевая энуклеация (HoLEP), лазерная резекция аденомы предстательной железы, вапоризация аденоматозной ткани с помощью лазера с «зеленым» излучением (с длиной волны 532 нм) или диодным лазером, энуклеовапоризация с помощью тулиевого лазера позволяют достичь эффекта, аналогичного открытой аденомэктомии, однако сопровождаются значительно меньшим количеством послеоперационных осложнений. Техника выполнения этих операций имеет свои особенности и требует специального обучения. Отдаленные результаты 5- и 7-летних исследований демонстрируют результаты, сравнимые с ТУРП. Это утверждение правомочно также в отношении частоты повторных операций, риска и характера осложнений [58, 59].
Трансуретральная игольчатая абляция предстательной железы менее эффективна, чем ТУР, однако не требует госпитализации пациента и общего обезболивания при проведении вмешательства. Может быть предложена для пациентов с отягощенным терапевтическим статусом и противопоказаниями к проведению более масштабных вмешательств. Частота осложнений (недержание мочи и эректильная дисфункция) после игольчатой абляции крайне низкая. Послеоперационная задержка мочи наблюдается в 13,3–41,6% случаев и продолжается 1–3 дня; в течение недели 90–95% пациентов не нуждаются в катетере. Балл IPSS уменьшается на 50%, а максимальная скорость потока мочи увеличивается на 70% к исходу первого года после операции [66].
Интерстициальная лазерная коагуляция – метод выбора для больных, принимающих антикоагулянты [38, 40], характерна высокая безопасность, но чаще возникает необходимость повторного оперативного леченияА [22].
После трансуретральной микроволновой термотерапии существует большая вероятность длительного дренирования мочевого пузыря. Физическая основа метода – коагуляционный некроз ткани простаты, которая нагревается до 45°С антенной, помещаемой в простатический отдел уретры. Длительная катетеризация необходима в 25% случаев. Эффективность приблизительно на 20% ниже, чем после ТУРП, и зависит от используемого оборудования, поставляемого различными производителями. Доказательная база эффективности применения трансуретральной микроволновой терапии пока недостаточна для формулировки рекомендаций по ее широкому применению [5, 15, 17, 36, 42].
Простатические стенты могут быть постоянными и временными и, будучи эндоскопически помещенными в простатический отдел мочеиспускательного канала, расширяют его просвет. Их применение показано пациентам, которым невозможно выполнить более масштабное оперативное лечение вследствие наличия отягощенного соматического или психического статуса. Мета-анализ результатов их применения свидетельствует, что для 16% больных эффективность применения стентов может быть признана неудовлетворительной в первые 12 мес после установки. Основные причины – произвольная миграция стента (37%) и рецидив инфравезикальной обструкции (14%). В течение первых 5 лет после установки стенты оказываются неэффективными приблизительно у 1/3 пациентов [61].

ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ МЕДИКАМЕНТОЗНУЮ ТЕРАПИЮ ИЛИ ПЕРЕНЕСШИХ ОПЕРАТИВНОЕ ВМЕШАТЕЛЬСТВО
Цели дальнейшего наблюдения за пациентом – регистрация динамики симптоматики, раннее выявление осложнений и побочных эффектов леченияD.
- Для наблюдения за динамикой симптоматики при ДГПЖ следует использовать шкалу международного индекса этого заболевания (IPSS).
- Для своевременного выявления РПЖ следует выполнять ПРИ и контролировать уровень ПСА в сыворотке крови каждые 12 мес.
- Для контроля наличия ИМП и функции почек необходимо регулярно выполнять общий анализ мочи, определять концентрацию креатинина в сыворотке крови.
- Для своевременного выявления побочных эффектов медикаментозной терапии следует регулярно (при каждом посещении) интересоваться у пациента, как он переносит прием препаратов.
ИНФОРМИРОВАНИЕ БОЛЬНОГО
Пациента информируют о клинической картине ДГПЖ, знакомят с различными методами лечения и их потенциальными результатами. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациент имел возможность задать все интересующие его вопросы.
- Необходимо убедить пациента не стыдиться болезни и ознакомиться с научно-популярной литературой о ДГПЖ.
- Следует информировать пациента о симптоматике, различных осложнениях ДГПЖ, включая инфекционные и обструктивные.
ОСЛОЖНЕНИЯ
Необходимо учитывать, что онкологические, инфекционно-воспалительные заболевания мочевого пузыря и предстательной железы, мочекаменная болезнь могут сочетаться с ДГПЖ или осложнять ее течение. Наиболее частые осложнения ДГПЖ [3, 7]:
- инфекция мочеполовых органов (хронический цистит, хронический пиелонефрит, хронический простатит);
- камни мочевого пузыря;
- острая задержка мочеиспускания;
- гематурия;
- хроническая задержка мочи с парадоксальной ишурией;
- ХПН.
ПРОГНОЗ
За последние десятилетия прогноз при ДГПЖ стал значительно более благоприятным. Это связано с внедрением:
- лекарств, воздействующих на этиопатогенетические механизмы развития и прогрессирования болезни;
- малоинвазивных оперативных технологий при этом заболевании (ТУР и др.) в повседневную клиническую практику, что позволяет добиваться лучших послеоперационных результатов при минимальном количестве осложнений, угрожающих жизни больных.
Кроме того, появившиеся современные диагностические технологии способствуют выявлению ДГПЖ на ранних стадиях развития болезни, а динамическое диспансерное наблюдение позволяет своевременно начинать лекарственную терапию либо проводить малоинвазивное оперативное вмешательство, не дожидаясь осложнений болезни.