Введение. Результаты анализа отечественной и зарубежной литературы свидетельствуют о том, что мочекаменная болезнь является одной из самых актуальных проблем урологии и медицины в целом [1–3]. Наличие микроорганизмов в лоханке почки после чрескожной нефролитотрипсии может способствовать развитию инфекционно-воспалительных осложнений [4, 5], а также рецидиву заболевания [6]. Антибактериальную терапию, направленную на ликвидацию потенциальных возбудителей инфекций мочевыводящих путей, проводят с учетом результатов посева мочи и антибиотикограммы [7]. Однако ряд авторов указывают на различия в структуре микрофлоры, выделенной из лоханочной и пузырной мочи [8, 9], что может снижать эффективность проводимой терапии, а также на низкую диагностическую значимость бактериологических посевов из мочевого пузыря [10].
В связи с вышеизложенным целью нашего исследования cтало изучение частоты встречаемости микроорганизмов различных таксономических групп и их ассоциаций в лоханочной и пузырной моче при мочекаменной болезни у взрослых.
Материалы и методы. В исследование были включены 252 пациента в возрасте от 23 до 87 лет, средний возраст составил 52 года; из них было 124 мужчины и 128 женщин. Больным выполнено оперативное лечение по поводу камней почек и верхней трети мочеточников в урологическом отделении Оренбургской областной клинической больницы. Конкременты из верхней трети мочеточника смещали в лоханку и удаляли методом чрескожной нефролитотрипсии и литоэкстракции. Все операции заканчивались установкой нефростомического дренажа с закрытой системой. При хирургическом вмешательстве отбирали пробы мочи из почечной лоханки и мочевого пузыря для проведения бактериологического исследования. Пробы мочи доставляли в бактериологическую лабораторию в течение 1–2 часов. Число микроорганизмов в 1 мл мочи (степень бактериурии) определяли методом секторных посевов [11].
Микроорганизмы выделяли в чистой культуре и идентифицировали до вида с использованием тест-систем «Lachema» (Чехия). Генетическое исследование патологического материала (выявление бактериального разнообразия) проводили на базе Центра коллективного пользования «Персистенция микроорганизмов» ИКВС УрО РАН. Для этого образцы мочи объемом 20–50 мл центрифугировали и из полученного осадка методом механической гомогенезации выделяли тотальную ДНК, проводили метагеномное секвенирование выделенных ДНК по 16S-рибосоме с помощью секвенатора II поколения MiSeq (Illumina, США). Каждая полученная последовательность была идентифицирована путем сравнения с последовательностями баз данных GenBank и Rdp с использованием алгоритмов BLASTN (Basic Local Alignment Search Tool Nucleotide) поиска и попарного сравнения.
Результаты. При бактериологическом исследовании мочи у 113 (44,8%) пациентов были выделены микроорганизмы, из них у 82 (72,6%) пациентов бактерии были обнаружены в моноварианте и у 31 (27,4%) – в ассоциациях, степень бактериурии варьировалась от 1,103 до 1,108 КОЕ/мл. Роста микроорганизмов при посевах мочи не получено у 139 (55,2%) пациентов, среди них были 61 (44,9%) женщина и 78 (56,1%) мужчин. Причем отсутствие роста микрофлоры из мочи, выделенной из лоханки и мочевого пузыря, отмечено у 65 мужчин и 56 женщин; из лоханочной мочи – у 7 и 1, из мочевого пузыря – у 5 и 4 пациентов соответственно.
При исследовании лоханочной мочи у 12 (10,6%) пациентов бактериальная флора отсутствовала.
В структуре микроорганизмов, выделенных из почки, лидирующее место занимали псевдомонады: Pseudomonas aeruginosa – 24 штамма, P. mendocina – 11 штаммов, P. putida (4), P. stutzeri (1); реже выделяли эшерихии – Escherichia coli (15) и E. vulneris (1); Klebsiella oxytoca – 12 штаммов; цитробактер – Citrobacter freundii (7), C. koseri (2), C. murliniae (1); энтеробактер – Enterobacter cloacae (4), E. aerogenes (3), E. brevis (1), E. pyrinus (1); Morganella morganii (7); стафилококки – Staphylococcus aureus (9) и S. epidermidis (1). Также были выделены Alcaligenes faecalis (3), A. xylosoxidans (3), A. plechaudii (1); Moraxella oslonsis (2); Serracia marcescens (1) и грибы рода Candida (1).
В 78,2% наблюдений бактерии выделяли в моноварианте (79 пациентов) и в 21,8% – 2- и 3-компонентные ассоциации (22 пациента). В монокультуре наиболее часто выделялись Pseudomonas spp. (27 штаммов), E. coli (10 штаммов) и K. oxytoca (9 штаммов). В ассоциациях также доминировали псевдомонады разных видов: так, в 2-компонентных ассоциациях P. aeruginosa выделяли совместно с S. aureus (2), K. oxytoca; P. mendocina с A. xylosoxidans, C. freundii, Burkholderia cepatica; P. putida с M. oslonsis. Кроме того, были выделены ассоциации из псевдомонад двух видов: P. aeruginosa c P. putida и P. mendocina, а также S. aureus и C. freundii. Ассоциация из трех компонентов была представлена E. coli, M. morganii и P. mendocina.
При исследовании пузырной мочи у 12 (10,6%) пациентов микроорганизмы бактериологическим методом не выделялись. В структуре выделенной микрофлоры преобладали псевдомонады: P. aeruginosa (25 штаммов), P. mendocina (5 штаммов), P. putida (3), P. stutzeri (1); реже выделялись эшерихии – E. coli (14) и E. vulneris (1); M. morganii (14); K. oxytoca – 9 штаммов; стафилококки: S. aureus (7) и S. epidermidis (1). Также были выделены C. freundii (6), A. faecalis (6), E. cloacae (3), E. aerogenes (3), C. koseri (3), Edwardsiella ictaluri (1) и E. hoshinae (3), C. murlinae (1).
В 82,2% наблюдений микроорганизмы выделяли в монокультуре (83 пациента) и в 17,8% – ассоциации из 2 и 3 видов микроорганизмов (18 пациентов).
В монокультуре лидирующее место занимали псевдомонады: P. aeruginosa (19 штаммов), P. mendocina (4 штамма), P. stutzeri (1 штамм); реже выделяли M. morganii (13); E. coli (10 штаммов). В ассоциациях доминировали псевдомонады: так, P. aeruginosa выделялись с P. mendocina, S. aureus, A. faecalis, K. oxytoca; также были выделены ассоциации A. faecalis с E. hoshinae, P. putida и E. ictaluri. Эшерихии были выделены со следующими микроорганизмами: E. coli с C. freundii, M. morganii, K.oxytoca; E. vulneris с K. oxytoca. Выделенные 3-компонентные ассоциации представлены E. aerogenes, S. marcescens, A. faecalis; S. aureus, C. freundii, K. oxytoca; B. cepacia, P. putida, K. oxytoca.
Проведенные исследования показали, что микроорганизмы, относящиеся к одинаковым видам, выделены из лоханочной и пузырной мочи у 48 (54,5%) пациентов, к одному одинаковому виду – у 14 (16,0%), к двум – у 3 (3,4%) пациентов и микрофлора разных видов высевалась у 23 (26,1%) пациентов. Приоритетные микроорганизмы, выделенные из лоханочной и пузырной мочи, представлены в таблице.
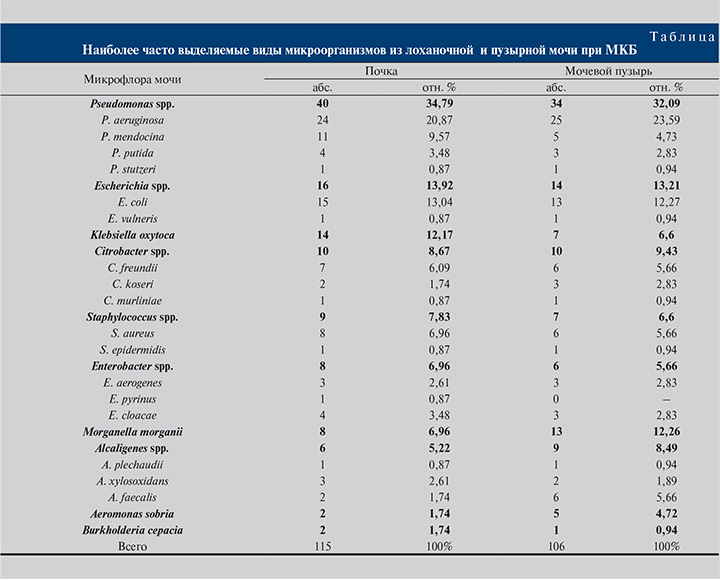
Далее нами проведен анализ частоты встречаемости микроорганизмов различных таксономических групп в исследуемых образцах с использованием генетических методов исследования.
При метагеномном анализе пробы, полученной от больной с камнем правого мочеточника, и у которой с использованием бактериологического исследования из лоханочной мочи были выделены E. coli, M. morganii, P. mendocina, а из пузырной мочи – E. coli и M. morganii, с помощью секвернирования дополнительно в первом случае была выявлена ДНК P. plecoglossicida, P. putida, P. entomophila, Salmonella infantis, Veilonella atypical, V. dispar; во втором – Gavaginalis, Strratia marcescens, S. entomophila, Prevotella bivia, Streptococcus infantis. В образце лоханочной мочи удельный вес ДНК псевдомонад составил 4,92%, вейлонелл – 1,29%, стрептококков – 1%. В образце пузырной мочи обнаружено преобладание ДНК G. vaginalis, что составило 62,97% от всего спектра возбудителей, на втором месте оказались микроорганизмы рода Serracia (4,04%), 0,28% пришлось на долю ДНК P. bivia и 0,17% – ДНК S. infantis.
В результате метагеномного секвенирования по 16S-рибосоме в исследуемых образцах, полученных от больной с камнем правого мочеточника, из лоханочной мочи были выделены P. mendocina, V. parvula, V. dispar, S. infantis; бактериологическим методом – только P. mendocina. Удельный вес ДНК вейлонелл составил 13,45%, стрептококков 5,43%. Из мочи, собранной из мочевого пузыря бактериологическим методом, микроорганизмы не выделены, а с помощью секвенирования выявлены ДНК S. capitis, V. atypical, V. parvula, Corynebacterium durum, Kingella denitrificans, Streptococcus spр., Pseudomonas sрp.
При метагеномном анализе пробы, полученной от больной с камнем левой почки, у которой бактериологическим методом микроорганизмы не выделены, была обнаружена ДНК 14 различных видов микроорганизмов. В образце из лоханочной мочи преобладала G. vaginalis (5,8%), удельный вес ДНК превотелл (P. bivia и P. corpi) составлял 4,97%, Neisseria flavescens – 1,99%, S. sanguinis – 1,77%. В моче, собранной из мочевого пузыря, 1,53% пришлось на долю ДНК Acinetobacter iwofii, 0,9% – бактерий рода Neisseria (N. elongata – 0,58%, N. mucosa – 0,32%). Удельный вес ДНК остальных видов был ниже: от 0,49% (V. dispar) до 0,79% (S. infantis) от всего спектра ДНК возбудителей.
Заключение. Сравнительный анализ структуры микробной флоры при бактериологическом анализе лоханочной и пузырной мочи при мочекаменной болезни у взрослых показал наличие широкого спектра микроорганизмов с преобладанием P. aeruginosa. Микробиота в обоих случаях имела приблизительно одинаковый спектр, однако у 26,1% пациентов нами установлено ее несоответствие. Поэтому, в связи с тем что очаг инфекции находится в лоханке почки, для постановки антибиотикограммы необходимо выделение возбудителя из лоханочной мочи, взятой во время оперативного вмешательства. Вместе с тем метагеномный анализ показал наличие ДНК микроорганизмов в пробах мочи, в которых бактериологическим методом микроорганизмы не обнаружены, а также значительное видовое разнообразие бактерий в тех пробах, в которых стандартная микробиологическая диагностика позволила выделить и идентифицировать 1–3 вида микроорганизмов. Полученные данные указывают на условность результатов подбора антибиотиков, поскольку контролируются не все бактерии, присутствующие в очаге инфекции.
Работа выполнена по проекту ИКВС УрО РАН № 15-3-4-34 в рамках Комплексной программы фундаментальных исследований УрО РАН.



