Актуальность. Острый пиелонефрит (ОП) характеризуется прогрессивным ростом заболеваемости населения, редицивированием инфекции у 10–30% пациентов и возрастающей тенденцией к хронизации процесса [1, 2]. К уропатогенам, вызывающим более 90% случаев инфекций мочевыводящих путей (ИМП), относятся представители семейства Enterobacteriaceae, среди которых доминируют E. coli, обусловливающие 60–85% всех симптоматических ИМП, в том числе и ОП [3–6]. Известно, что для этиологически обоснованного назначения антибактериального лечения всем пациентам с ИМП, и ОП не является исключением, должно проводиться бактериологическое исследование средней порции мочи, полученной при самостоятельном мочеиспускании, либо мочи, полученной уретральным катетером [7–9]. Однако бактериологическое исследование мочи у пациентов с ОП выявляет микроорганизмы лишь в 49,1–90% случаев [10, 11]. При наличии осложненных (обструктивных) форм пиелонефрита микробиота мочи характеризуется более широким спектром причинных микроорганизмов и, соответственно, большим риском прогрессирова-ния осложнений с возникновением внутрипочечного или околопочечного абсцессов, эмфизематозного пиелонефрита, уросепсиса [12–15]. Совершенно очевидно, что результаты лечения ОП зависят от своевременно начатой и рациональной стартовой эмпирической антибактериальной терапии [16–18].
Цель исследования: изучить спектр уропатогенов и их чувствительность к антибиотикам при остром обструктивном пиелонефрите.
Материалы и методы. Проведен ретроспективный анализ данных 72 пациентов, подвергнутых полуригидной уретероскопии и ультразвуковой литотрипсии по поводу камней мочеточника после предшествовавшего декомпрессии верхних мочевыводящих путей острого обструктивного пиелонефрита (ООП) в стационаре, аффилированном с медицинским университетом. Критерии включения в исследование: обструктивный уретеролитиаз, симптомы острой инфекции верхних мочевыводящих путей и дренирование лоханки путем ретроградного стентирования мочеточника либо ее чрескожной пункции (ЧПНС), письменное согласие пациентов. Исследование одобрено локальным этическим комитетом ФГБОУ ВО РостГМУ Минздрава России (протокол № 20/12 от 20.12.2012).
Бактериологическое исследование пузырной мочи, полученной уретральным катетером в ближайшие 3 ч госпитализации, проводили на расширенном (10) наборе питательных сред для культивирования и идентификации аэробных и анаэробных бактерий. В работе использованы питательные среды фирмы «HiMedia» (Индия). Антибиотики, к которым определяли чувствительность всех уропатогенов, были сгруппированы в 4 класса. Антибиотикочувствительность уропатогенов определяли дискодиффузионным методом на агаровой среде Mueler Hinton (МУК 4.2.1890-04 от 04.03.04) с помощью стандартных дисков («HiMedia», Индия). Спектр микробных паттернов, уровень бактериурии и антибиотикограммы уропатогенов получали к 5–6-м суткам от начала эмпирической антибио-тикотерапии, после чего начинали этиотропную терапию.
Статистический анализ включал определение средних значений и среднеквадратичной ошибки Т-критерия Стъюдента. Применяли общепринятые уровни значимости (р<0,05).
Результаты. После выявления обструктивных камней мочеточника, осложненных во всех 72 случаях ОП, проводили ретроградное стентирование мочеточника. В отношении 8 пациентов оно не удалось, в связи с чем была произведена ЧПНС. Средний возраст больных составил 54,6±3,2 (18–76) года, большинство составили женщины – 60 (83,3%) человек. Более 90% пациентов были госпитализированы при длительности ООП более 1 сут, пик госпитализации женщин пришелся на 2–4-е сутки, мужчин – 3–7-е сутки. Уровень гипертермии на момент госпитализации у 55,5% пациентов составил 38,1–38,5°С, у 27,7% – 38,6–39,0°С и у 13,3% – выше 39,1°С. У всех пациентов уровень лейкоцитов крови находился в пределах 10–15×109/л. Лейкоцитурия при госпитализации была выявлена у 77,7% поступивших.
От всех 72 больных получен положительный результат бактериологического исследования пузырной мочи. В 5 (6,9%) случаях канонические уропатогены в моче отсутствовали. В каждом из этих случаев был выявлен только один из таксонов анаэробов (Peptococcus spp., Eubacterium spp., Bacteroides spp.). В других 7 (9,7%) случаях уропатогены (E. coli, Klebsiella spp., Enterococcus spp.) находились в моче в концентрации ≤102 КОЕ/мл, которые не учитываются при стандартном бактериологическом исследовании. По общему мнению, такие уровни бактериурии не являются клинически значимыми.
У 68 пациентов были выявлены микробные ассоциации, из них в 94,2% случаев – аэробно-анаэробные, в 5,8% – аэробно-аэробные.
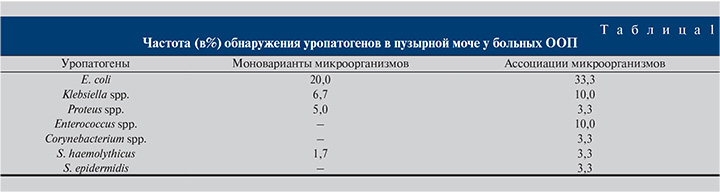
Для анализа антибиотикорезистентности отобраны пробы 60 (83,3%) пациентов, в которых уровень бактериурии составил ≥103 КОЕ/мл. В 20 (33,3%) случаях в моче был обнаружен 1 канонический уропатоген (табл. 1), в 40 (66,7%) – ассоциации уропатогенов, в которых по уровню бактериурии доминировали представители семейства Enterobacteriaceae (78,3%), реже (21,7%) превалировала грампозитивная флора.
Таким образом, из верифицированных в моче уропатогенов среди представителей семейства Enterobacteriaceae преобладали E. coli (53,3%), а среди грампозитивной флоры – Enterococcus spp. (10%).
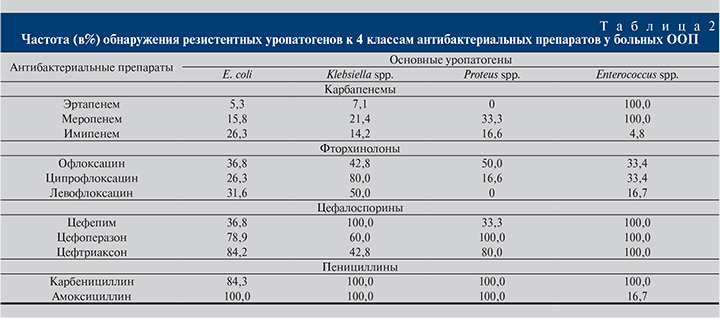
Были изучены особенности резистентности доминирующих уропатогенов к 4 классам антибактериальных препаратов (табл. 2).
Установлено, что наименьшая резистентность уропатогенов определяется к карбапенемам, а среди них – к эртапенему. В большей мере, чем к карбапенемам, уропатогены демонстрируют резистентность к фторхинолонам. Меньшая резистентность E. coli выявлена к ципрофлоксацину (26,3%), Klebsiella spp. – к офлоксацину (42,8%), Proteus spp. – к ципрофлоксацину (16,6%) и левофлоксацину (отсутствие резистентности), Enterococcus spp. – к левофлоксацину (16,7%). Таким образом, даже в узком паттерне уропатогенов (E. coli, Klebsiella spp., Proteus spp., Enterococcus spp.) невозможно выбрать оптимальный препарат группы фторхинолонов, обладающий равнозначной эффективностью по отношению к вышеперечисленным уропатогенам. Цефалоспорины показывают низкую активность по отношению к уропатогенам. Наиболее эффективным среди них в отношении E. coli и Proteus spp. является цефепим с показателями резистентности 36,8 и 33,3% соответственно. Среди полусинтетических пенициллинов можно отметить высокую активность амоксициклина только к энтерококкам.
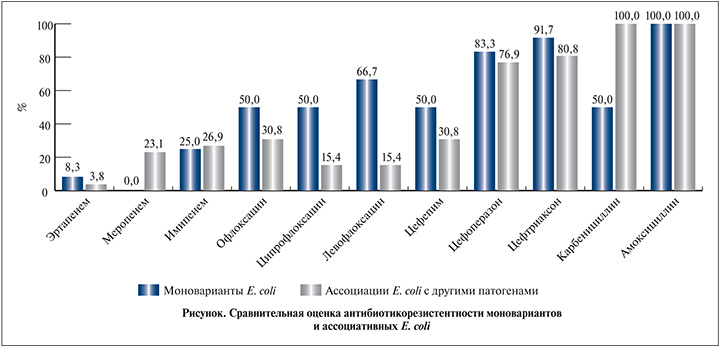
В связи с тем что уропатогены регистрируют в пузырной моче в виде монокультуры канонических уропатогенов или в составе ассоциаций, целесообразным представилось исследовать резистентность к антибактериальным препаратам как моновариантов, так и ассоциативных штаммов на примере наиболее распространенного уропатогена E. coli (см. рисунок). В моноварианте, т.е. вне ассоциаций с каноническими патогенами, из мочи выделено 12 штаммов E. coli, в составе бактериальных ассоциаций с каноническими патогенами – 26 штаммов. Удивителен тот факт, что резистентность E. coli, выделенных в моноварианте, к мерапенему отсутствовала. В то время как ассоциативные E. coli имели резистентность к двум карбапенемам более 20%. Абсолютно противоположная ситуация наблюдалась с резистентностью E. coli к фторхинолонам: моноварианты E. coli оказались к ним более резистентными (50–66,7%), чем E. coli, входящие в состав ассоциаций (15,4–30,8%; р<0,05). Аналогичные различия в резистентности моновариантов и ассоциативных штаммов отмечены у Klebsiella spp. и Proteus spp., но в силу небольшого количества выделенных штаммов (15) статистическую обработку по ним мы не приводили. К карбенициллину резистентность выявлена для 50% штаммов E. coli в моноварианте и во всех случаях – для ассоциативных E. coli. Все штаммы E. coli, выделенные как в моноварианте, так и в составе ассоциаций, были резистентны к амоксициллину. Суммарно мультирезистентными являлись 57,9% штаммов E. coli.
Обсуждение. Краеугольным камнем в лечении ОП, возникшего при обструктивном камне мочеточника, является немедленное дренирование верхних мочевыводящих путей и применение эмпирических антибиотиков с целью предотвращения уросепсиса, потери почки и даже смерти. Известны риски морбидности и смертности, связанные с отсрочкой начала лечения инфекционного процесса [19]. В связи с этим в исследуемой когорте больных обращает на себя внимание несвоевременность дренирования верхних мочевых путей в связи с задержанной госпитализацией. Вопрос состоит даже не в способе оптимального дренирования: стент или ЧПНС [20–22]; мнения относительно этого вопроса противоречивы. Главная проблема заключается в роли эмпирической терапии антибактериальными препаратами, так как от ее эффективности напрямую зависят исходы почечного воспаления. Очевидно, что выбор эмпирического антибиотика базируется прежде всего на представлениях о микробиоте мочи при ООП в конкретной больнице. Именно поэтому знание этого вопроса принципиально для проведения эффективной антибиотикотерапии.
В исследуемой когорте больных имел место высокий (83,3%) уровень выявления канонических уропатогенов в пузырной моче благодаря использованию расширенного набора питательных сред, причем с уровнем бактериурии ≥103 КОЕ/мл. Детальный анализ показал, что у 5 из 72 пациентов канонические патогены в моче отсутствовали, а у 7 – уровень бактериурии не превышал 102 КОЕ/мл.
Моноварианты уропатогенов обнаружены у 20 пациентов, а ассоциации уропатогенов – у 40. Мы не рассматриваем случаи выделения из мочи ассоциаций бактерий как следствие контаминации, так как ранее в эксперименте нами было показано, что мультибактериальная инвазия лоханки вызывает более тяжелое гнойное поражение почки, чем каждый из микробов в монокультуре [23]. Спектр уропатогенов, вызвавших ООП у 60 больных, оказался подобным таковому, описанному в мировой литературе [24].
На основании полученных нами локальных антибиограмм рациональная противомикробная рекомендация заключается в использовании карбапенемов, а именно эртамепенема или меропенема в качестве стартовых эмпирических антибиотиков. Вместе с тем, исходя из данных о резистентности, лечение карбапенемами может оказаться недостаточным не менее чем у 20% больных ООП, вызванном энтеробактериями. Однако R. Rosa и соавт. [25] при терапии различных вариантов (форм) ИМП не рекомендуют проводить эмпирическую терапию карбапенемами в отсутствие информации о наличии в моче БЛРС-продуцирующих штаммов бактерий. Использование фторхинолонов в качестве первой линии лечения может оказаться недостаточным в 15–67% случаев. Причем даже в отношении E. coli трудно выделить какой-либо один препарат из этой группы, который был бы эффективным как для штаммов эшерихий, выделенных в моноварианте, так и для штаммов, обнаруженных в моче в составе бактериальных ассоциаций. Согласно данным по резистентности уропатогенов к цефалоспоринам и полусинтетическим пенициллинам, можно сделать следующий вывод: они не могут являться препаратом выбора для проведения эмпирической антибиотикотерапии ООП в конкретном урологическом стационаре.
Сравнительный анализ резистентности к антибиотикам моновариантов и ассоциативных E. coli выявил более высокую резистентность ассоциативной E. coli к карбапенемам и меньшую – к фторхинолонам. Не вызывает сомнений необходимость объяснения этого явления, чего мы пока сделать не можем. Тем не менее уже сейчас знание этого факта может способствовать лучшему выбору эмпирического антибиотика и, возможно, лучшему исходу лечения. В контексте данной работы актуальным является мнение T.E. Finucane [26] «… вместо вопроса: есть ли у этого пациента ИМП, правопреемником является вопрос: есть ли доказательство того, что лечение антиботиками может принести пользу этому пациенту?». Ограничениями данного исследования являются его ретроспективный характер и относительно небольшой набор образцов. Данные были также ограниченными, поскольку мы не могли дать оценку приему антибиотиков ранее, так как это не было отражено в имеющихся медицинских документах.
Заключение. В проведенном исследовании продемонстрирована высокая резистентность уропатогенов к большинству антибиотиков при остром обструктивном калькулезном пиелонефрите. Только некоторые из карбапенемов могут обеспечить оптимальный лечебный эффект. В связи с этим чрезвычайно важно критически подходить к выбору эмпирического антибиотика и принимать во внимание результаты локальных антибиотикограмм. Следует признать, что стратегии рационального использования антибиотиков пока с трудом внедряются в практическую работу больниц. Вместе с тем выбор эмпирических антибиотиков уже сегодня можно оптимизировать путем разработки персональных антибиотикограмм, на основании которых необходимо создавать реестры антибиотикочувствительности и/или резистентности для конкретных стационаров.



