Введение. Рак предстательной железы (РПЖ) является одним из самых часто встречающихся злокачественных новообразований в структуре общей заболеваемости взрослого населения. Поскольку на ранних стадиях РПЖ практически не имеет самостоятельных клинических проявлений, выявляемость поздних стадий заболевания по-прежнему остается высокой. По данным Американского общества по борьбе с раком, в 2015 г. в мире было диагностировано свыше 1 млн новых случаев заболевания РПЖ, из которых 20% приходится на метастатический и местнораспространенный РПЖ [1–3]. Симптомы нижних мочевыводящих путей (СНМП) являются общим проявлением различных урологических состояний. Проведенные ранее исследования показывают, что более 40% пациентов с РПЖ также могут иметь умеренные или выраженные СНМП [4], сказывающиеся на их качестве жизни и отрицательно влияющие на их повседневную жизнедеятельность.
Признаки инфравезикальной обструкции, наблюдаемой при росте предстательной железы, а также симптомы, связанные с прорастанием опухоли в шейку мочевого пузыря, уретру, сосудисто-нервные пучки и т.д., в большинстве случаев появляются при прогрессировании опухолевого процесса [5, 6]. По мнению Е. Ream и соавт. [7], почти у всех пациентов с РПЖ наблюдается по крайней мере один из СНМП, умеренная степень тяжести которых имеет место у 39% пациентов, выраженная – у 11%.
В исследовании, проведенном A. Peltier [8], было показано, что среди пациентов с распространенным и метастатическим РПЖ выявляемость СНМП умеренной и выраженной степеней составляет 62%.
Согласно рекомендациям Европейской ассоциации урологов 2017 г. [9], терапией первой линии при наличии СНМП являются α1-адреноблокаторы (α1-АБ). Тамсулозин – эффективный и безопасный представитель группы α1-АБ, широко используемый при консервативном лечении СНМП.
На протяжении долгого периода времени андрогенодепривационная терапия (АДТ) была стандартным методом паллиативного лечения пациентов с распространенным РПЖ. Исследование по оценке комбинированного применения АДТ и трипторелина (агониста гонадотропин-рилизинг-гормона [ГнРГ]) показало значительное снижение частоты СНМП у пациентов с распространенным РПЖ в течение первых 24 нед применения [8].
В настоящее время данные об эффективности и безопасности тамсулозина для пациентов с СНМП при распространенном РПЖ отсутствуют [10]. Этот факт побудил нас провести собственное исследование, целью которого стала сравнительная оценка эффективности АДТ и АДТ в комбинации с препаратом Омник Окас в лечении СНМП, а также эффективности и безопасности препарата Омник Окас для облегчения симптомов нарушенного мочеиспускания у пациентов с распространенным РПЖ в течение 6 мес.
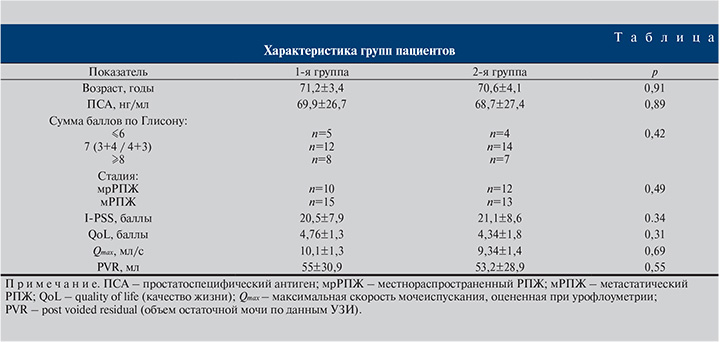
Материалы и методы. В рандомизированное открытое одноцентровое исследование, проведенное на кафедре урологии МГМСУ им. А. И. Евдокимова, были включены 50 пациентов с диагностированным распространенным РПЖ, имеющие СНМП умеренной (8–19 баллов) и выраженной (20–35 баллов) степеней тяжести по шкале I-PSS.
Возраст пациентов не превышал 75 лет, ожидаемая продолжительность жизни была больше года. Критерии исключения: наличие в анамнезе инфекции мочевыводящих путей, нейрогенного мочевого пузыря, стриктуры уретры, камней мочевого пузыря, сахарного диабета, почечной недостаточности, прием α1-АБ в течение 1 мес и более до начала исследования.
Все пациенты, подписавшие информированное согласие, были рандомизированы на две группы по 25 человек (см. таблицу): в 1-й группе проводилась АДТ в режиме монотерапии (лейпрорелин 45 мг подкожно), во 2-й – АДТ (лейпрорелин в указанной выше дозировке) в комбинации с препаратом Омник Окас (0,4 мг ежедневно перорально). Продолжительность лечения составила 6 мес. Группы были сопоставимыми по анализируемым показателям (см. таблицу).
Всем пациентам помимо регистрации стандартных данных, получаемых при обследовании больных РПЖ (определение уровня общего ПСА, сумма баллов по Глисону и пр.), выполнялось также анкетирование, определение максимальной скорости мочеиспускания, определение объема остаточной мочи.
Для статистической обработки использовали программу Microsoft Exсel 2010, с помощью которой проведено объективное сравнение полученных результатов и комплексная оценка достоверности различий в результатах. Критерий Стьюдента (t- и χ2-тест) использовался для определения наличия статистической разницы между двумя группами. Разница считалась статистически достоверной при p<0,05.
Результаты. Эффективность проводимого лечения была оценена в каждой группе при последующих визитах спустя 2 мес (визит 1), 4 мес (визит 2) и 6 мес (визит 3) по результатам заполнения валидизированых опросников (I-PSS), урофлоуметрии (Qmax) и УЗИ (PVR), а также определения уровня общего ПСА крови и выявления побочных явлений. Клинически значимый ответ определялся при изменении оценки по шкале I-PSS на 3 и более баллов (см. рисунок).
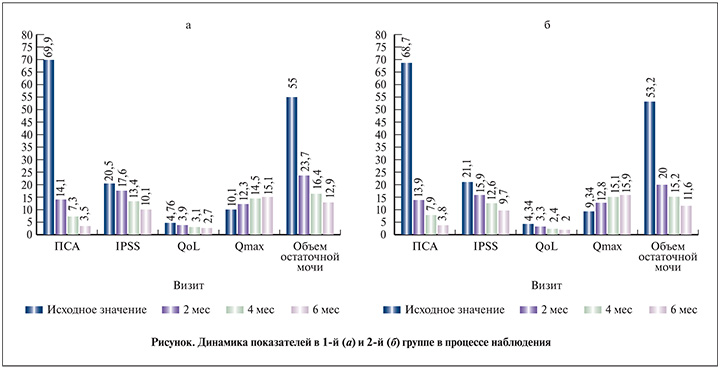
В 1-й группе спустя 2 мес лечения анализ суммарного балла по шкале I-PSS не выявил статистически значимого снижения по сравнению с исходным показателем (20,5 балла против 17,6; р>0,05). Существенное улучшение по сравнению с исходным уровнем было достигнуто спустя 4 и 6 мес проведения АДТ (р<0,001). Во 2-й группе суммарный балл по шкале I-PSS на визите 1 также статистически значимо не отличался от исходного (р>0,05), в то же время при последующем наблюдении отмечено более выраженное снижение данного показателя (р<0,05 и р<0,001 спустя 4 и 6 мес соответственно). Сравнительный анализ показал, что в течение первых 2 мес лечения снижение общего балла по шкале I-PSS во 2-й группе происходило главным образом за счет уменьшения выраженности обструктивной симптоматики. Однако к концу периода наблюдения (6 мес терапии) статистически значимых различий между группами в снижении выраженности обструктивной и ирритативной симптоматики выявлено не было (р>0,05).
Показатель качества жизни (QoL) также продемонстрировал прогрессирующее улучшение по сравнению с исходными значениями в обеих группах, при этом значительное снижение балла (р<0,01) наблюдалось в 2-й группе на момент прохождения последнего визита. Разница в показателе качества жизни спустя 6 мес проведения терапии была статистически значимой (р<0,05) по сравнению с исходными показателями.
В обеих группах отмечено увеличение показателя Qmax на всех визитах (р<0,0001). При этом во 2-й группе имела место более выраженная динамика по сравнению с 1-й: среднее изменение относительно исходного значения на визите 1 в 1-й группе составило 2,2 мл/с, во 2-й – 3,46 мл/с (р<0,01), на визите 2 – 4,4 и 5,76 мл/с соответственно (р<0,001) и на визите 3 – 4,9 и 6,56 мл/с соответственно (р<0,05).
Также в обеих группах на каждом визите констатировали значительное улучшение по сравнению с исходным значением показателя PVR. Во 2-й группе разница по сравнению с исходными значениями была больше на визитах 1 и 2, однако к концу периода наблюдения показатели в группах уже не различались, составив 42,1 и 41,6 мл в 1-й и 2-й группах соответственно (р>0,05).
В обеих группах зафиксировано значимое снижение уровня ПСА по сравнению с исходными значениями (р<0,0001); статистически значимых различий между группами не выявлено (р>0,05).
Побочные явления, связанные с приемом препарата Омник Окас, включая головокружение, сухость во рту и тошноту, имели место у 3 (12%) в первые 2 нед приема препарата.
Обсуждение. Высокая распространенность и тяжесть (от умеренной до выраженной) СНМП у пациентов с РПЖ требуют внимания со стороны клиницистов [7, 8, 10]. В ряде экспериментальных и клинических исследований продемонстрирована эффективность АДТ в уменьшении объема предстательной железы и как следствие – дизурических явлений у пациентов с РПЖ [11, 12]. Комбинированное применение АДТ с агонистами и антагонистами ГнРГ позволяет в значительной степени снизить выраженность СНМП у пациентов с РПЖ [8, 13].
Исследование in vitro и in vivo показало, что теразозин и доксазозин негативно влияют на рост клеток РПЖ, индуцируя апоптоз и не влияя на пролиферацию клеток, тем самым оказывают противоопухолевое действие [14]. В качестве высокоселективного α1-АБ тамсулозин в основном блокирует адренергические рецепторы подтипа α1A и α1D, распределенные в предстательной железе, шейке мочевого пузыря и мочеиспускательном канале, и является препаратом первой линии терапии СНМП, связанных с гиперплазией предстательной железы [15].
Показатели I-PSS, QoL, Qmax и PVR являются важными параметрами в оценке степени тяжести СНМП и результатов лечения. В ходе настоящего исследования показано, что АДТ как в режиме монотерапии, так и в сочетании с α1-АБ способствовала значительному улучшению указанных параметров к концу периода наблюдения. Во 2-й группе проводимая терапия обеспечила более выраженное снижение суммарного балла по шкале I-PSS, увеличение балла QoL и снижение PVR к концу 2-го и 4-го месяцев по сравнению с 1-й группой, показатели Qmax также были более высокими на протяжении всего периода наблюдения. Кроме того, значительное улучшение показателей I-PSS и QoL во 2-й группе было достигнуто уже к концу 2-го месяца лечения, тогда как в 1-й группе больных аналогичного улучшения удалось достичь лишь к 4-му месяцу.
Выполненные ранее клинические исследования подчеркивают, что проведение АДТ уменьшает выраженность СНМП, что может быть обусловлено уменьшением объема предстательной железы, а не самой опухоли [16, 17]. К подобным выводам пришли ряд авторов [13, 18, 19], показавших в своих исследованиях уменьшение объема предстательной железы в среднем на 20–50% спустя 3–8 мес проведения АДТ.
В работе S. Mommsen и L. Petersen [11] сообщается о том, что более 62% пациентов с РПЖ и острой задержкой мочи восстанавливают способность самостоятельного мочеиспускания в течение 3 мес после хирургической кастрации. L. Klarskov и соавт. [12] было высказано предположение, что проведение АДТ в течение всего периода клинического использования уменьшает выраженность СНМП и снижает объем предстательной железы у пациентов с РПЖ.
Заключение. Проведенное клиническое исследование показало эффективность АДТ и АДТ в сочетании с препаратом Омник Окас при лечении СНМП у пациентов с распространенным РПЖ. Комбинированное применение АДТ и препарата Омник Окас приводит к более выраженному и быстрому облегчению проявлений СНМП, чем при проведении АДТ в режиме монотерапии. Омник Окас продемонстрировал хорошую переносимость, отсутствие значимых побочных явлений и комплаентность.
Проведение более масштабных мультицентровых исследований, направленных на оценку эффективности комбинированного использования АДТ и тамсулозина в отношении пациентов с распространенным РПЖ, позволит в значительной степени расширить показания к клиническому применению α1-АБ.
В статью вошли результаты работ, выполненных при поддержке Гранта Президента РФ МК-5594.2016.7


