Введение. На сегодняшний день монополярная трансуретральная резекция гиперплазии простаты (ТУР простаты) является стандартом лечения доброкачественной гиперплазии предстательной железы (ДГПЖ) при объеме простаты менее 80 см3 [1]. Биполярная ТУР простаты позволяет удалять железы и большего объема. Обе методики зарекомендовали себя как высокоэффективные операции с высокой степенью безопасности. При этом частота рецидивов после ТУР простаты варьируется от 5 до 15% [1–4], а данный показатель для лазерной энуклеации гиперплазии простаты (тулиевой лазерной энуклеации [ThuLEP] и гольмиевой лазерной энуклеации [HoLEP]) в среднем составляет 1–1,5% [2, 5, 6]. Однако существует мнение [7], будто проведение эндоскопической лазерной энуклеации при рецидивах гиперплазии простаты остается технически сложной задачей.
Цель работы: описать отличительные особенности ThuLEP и HoLEP гиперплазии простаты при рецидиве ДГПЖ и показать, что возникающие при этом технические трудности не являются препятствием к широкому применению данной методики.
Материалы и методы. Исследование было проведено в период с декабря 2013 по март 2017 г. и носило ретроспективный характер. В нем участвовали 676 пациентов в возрасте от 54 до 87 лет.
Критерием включения пациентов в исследование являлось наличие клинически выраженной инфравезикальной обструкции, обусловленной гиперплазией предстательной железы (IPSS>20; Qmax<10).
Критерием исключения пациентов из исследования являлось наличие гистологически подтвержденного злокачественного новообразования предстательной железы, наличие острого воспалительного процесса в мочевых путях или предстательной железе.
Все пациенты были разделены на четыре группы. Первая группа (I; 489 пациентов) – после HoLEP гиперплазии простаты; третья (III; 153 пациента) – после ThuLEP; во вторую (II; 23 пациента) и четвертую (IV; 11 пациентов) группы вошли больные с рецидивом гиперплазии простаты, перенесшие HoLEP (вторая группа) и ThuLEP (четвертая группа). Троим пациентам из группы HoLEP (13,0%) и одному из группы ThuLEP (9,0%) первично была выполнена открытая аденомэктомия; все остальные пациенты с рецидивом гиперплазии предстательной железы изначально перенесли трансуретральную резекцию простаты.
Перед проведением лазерной энуклеации и через 6 мес после нее проведена оценка функциональных показателей мочеиспускания (IPSS – международная шкала оценки простатических симптомов, QoL – показатель качества жизни, Qmax – максимальная скорость потока мочи, PVR – объем остаточной мочи) (табл. 1).
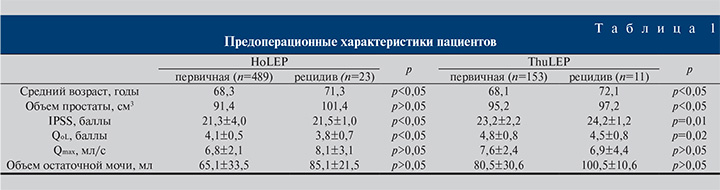
В работе использовался резектоскоп № 26 Ch с постоянной ирригацией, обеспечивавший низкое давление ирригационной жидкости (типа Iglesias), и рабочий элемент с каналом для проведения лазерного волокна.
Для проведения гольмиевой лазерной энуклеации гиперплазии простаты применялась лазерная установка VersaPulse («Lumenis», Израиль) мощностью 100 Вт с длиной волны 2100 нм и лазерное волокно диаметром 550 мкм с концевым свечением. Операция проводилась при мощности лазерного излучения 70 Вт; при работе в области семенного бугорка мощность снижалась до 40 Вт.
Для проведения тулиевой лазерной энуклеации использовался тулиевый лазер Urolase (НТО «ИРЭ-ПОЛЮС», Россия) мощностью 120 Вт с длиной волны 1940 нм и лазерное волокно с диаметром светонесущей жилы 600 мкм. Операции выполнены при средней мощности лазерного излучения 60 Вт и энергии 1,5 Дж. При работе в зоне семенного бугорка мощность излучения снижалась до 30 Вт.
Удаление аденоматозной ткани проводилось с помощью ригидного нефроскопа (диаметр рабочего канала – 5 мм) и морцеллятора VersaCut («Lumenis», Израиль) [8, 9].
Для сравнительного анализа были использованы метод хи-квадрат и критерий Фишера. Величина p<0,05 была принята за статистически значимое различие.
Результаты. При оценке эффективности HoLEP и ThuLEP нами было установлено, что:
- средняя масса удаленной ткани после первичного и повторного вмешательств статистически значимо не различалась (p>0,05);
- средняя длительность гольмиевой энуклеации несколько превышала среднюю длительность тулиевой лазерной энуклеации (p=0,02);
- средние длительности первичных и повторных операций статистически не различались (p>0,05);
- разницы в длительности госпитализации и катетеризации между четырьмя группами отмечено не было (p>0,05) (табл. 2).
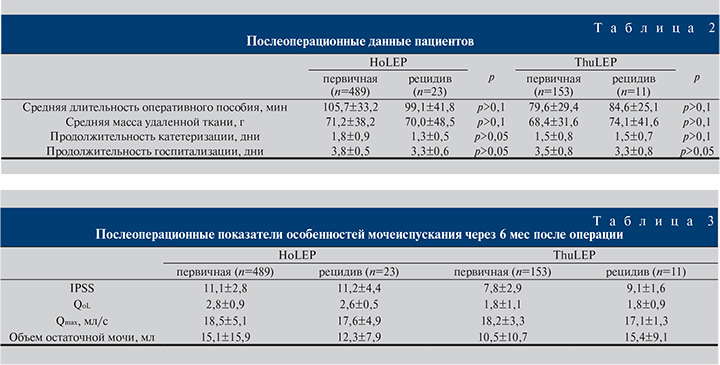
Через 6 мес после оперативного вмешательства во всех группах было выявлено статистически значимое улучшение показателей IPSS, Qmax, QoL, PVR в отсутствие различий в них между группами (p>0,05) (табл. 3).
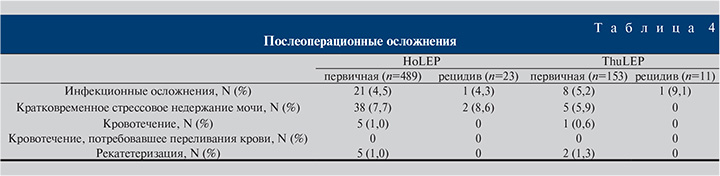
Кроме того, в группах II и IV (повторные операции) не наблюдалось повышения частоты осложнений: после повторной HoLEP частота кратковременного стрессового недержания мочи не превышала 10%, а после повторной ThuLEP данное осложнение не было отмечено ни в одном из наблюдений. Частота повторной катетеризации после первичной операции не превышала 1,5%, в группах пациентов II и IV повторной установки уретрального катетера не потребовалось ни в одном из наблюдений.
Все остальные осложнения относились к первой категории по шкале Clavien–Dindo (табл. 4).
Обсуждение. В литературе существует мнение [10–12], что основной причиной рецидива гиперплазии предстательной железы после ТУР простаты является неполное удаление ткани аденомы в апикальной части. При проведении резекции ткани в зоне апекса хирурги предпочитают не приближаться к зоне семенного бугорка, боясь повредить сфинктер (особенно при объеме гиперплазии простаты более 80 см3) [13].
В свою очередь, при выполнении лазерной энуклеации простаты операция начинается в зоне апекса; обнаружив нужный слой, мы проводим наиболее радикальное удаление гиперплазированной ткани из этой зоны, предупреждая последующие рецидивы [12].
По данным нашей работы и данным ряда других авторов [11, 12], средний возраст пациентов, перенесших повторное пособие, значительно превышает таковой пациентов с впервые возникшими жалобами на инфравезикальную обструкцию. В группах II и IV (повторная операция) количество пациентов, принимавших антитромботические препараты (11%), было больше, чем в группах I и III (5%). Оба эти факта говорят о том, что проведение лазерной энуклеации при рецидиве гиперплазии простаты не просто один из вариантов лечения, а метод выбора, позволяющий избегать осложнений и снижать риск рецидива у больных старшей возрастной группы.
Продолжительность первичных и повторных операций в нашей работе была сопоставимой, однако при проведении энуклеации при рецидивах ДГПЖ нами был отмечен ряд особенностей:
- значительная деформация зоны операции (в нашем исследовании этот факт отмечен во всех случаях), что может быть связано с неполноценным удалением всех узлов гиперплазированной ткани при первичной операции;
- выраженная деформация шейки мочевого пузыря (у 15 пациентов – 44,1%);
- локализация устья мочеточника в области шейки мочевого пузыря (у 5 больных – 14,7%) и в ложе простаты (у 1 больного – 2,9%);
- отсутствие семенного бугорка ввиду его удаления в ходе операции имело место у 2 пациентов – 5,9%;
- меньшая кровоточивость тканей (у большинства прооперированных) обеспечивала лучшую видимость при проведении энуклеации;
- как правило, нами отмечена более высокая плотность тканей при проведении морцелляции; в завершение энуклеации перед смещением аденоматозной ткани в мочевой пузырь мы провели несколько инцизий лазером по поверхности узла гиперплазии, что в последующем облегчало захват морцеллятором ткани;
- сравнительно высокий процент больных с многоузловой аденомой (70,6%) [11], требующий тщательного выделения всех узлов гиперплазии из значительно меняющей рельеф зоны операции;
- в отношении одного пациента при вовлечении устьев мочеточников в зону энуклеации интраоперационно от дренирования верхних мочевых путей было решено воздержаться; в послеоперационном периоде проведен ультразвуковой мониторинг за состоянием верхних мочевых путей, не было отмечено ни нарастания дилатации чашечно-лоханочной системы, ни клинических проявлений нарушенного оттока мочи;
- не наблюдалось отличий в проведении повторной лазерной энуклеации у пациентов, изначально перенесших ТУР или открытую аденомэктомию.
Хотелось бы отметить, что при любом изменении рельефа простаты у хирурга всегда имеется ориентир (в виде апикальный зоны и семенного бугорка), по которому возможно определить необходимую глубину инцизии и выйти в слой энуклеации.
В случае потери анатомических ориентиров целесообразно вернуться в зону апекса, где слой энуклеации выражен лучше, и миновать проблемный участок, используя режущие свойства лазера. На наш взгляд, для этого случая больше подходит тулиевый лазер [14] и связано это, прежде всего, с небольшой глубиной проникновения лазерного излучения; кроме того, благодаря его высокой мощности возможно проводить наиболее точные инцизии.
Лазерную энуклеацию при рецидивах гиперплазии простаты можно выполнять также и по технике en-bloc [15]: при наличии выраженной деформации ткани выделяется требуемый слой в зоне апекса и, следуя ему, удаляется вся гиперплазированная ткань.
Но важно отметить, что для проведения энуклеации по методике en-bloc необходимо обладать значительным опытом выполнения эндоскопических энуклеаций.
Заключение. Нами было установлено, что особенности (технические сложности) проведения повторной операции, такие как: тяжелое отделение аденоматозной ткани от капсулы простаты, многоузловой характер аденомы, повышенная плотность ткани – легко преодолимы и не ведут к значительному усложнению методики.
Лазерная энуклеация гиперплазии простаты не просто допускает эффективное избавление от инфравезикальной обструкции, вызванной ДГПЖ, но и является методом выбора при лечении пациентов с рецидивом аденомы простаты благодаря своей высокой радикальности, низкой частоте осложнений и возможности проведения операции даже пожилым пациентам с отягощенным соматическим фоном.


