Первое издание Рекомендаций по лечению инфекций мочевыводящих путей (ИМП) Европейской ассоциации урологов (EAU) опубликовано в 2001 г. [1]. После завершения международного эпидемиологического исследования неосложненного цистита у женщин (ARESC) в 9 странах Европы (включая Россию) и Бразилии в 2006 г. рекомендации были изменены на основании полученных результатов. Согласно данным исследования, основным уропатогеном при неосложненном цистите у женщин стала Escherichia coli (74,6%), далее следовали Enterococcus faecalis (4,0%), Staphylococcus saprophyticus (3,6%), Klebsiella pneumoniae (3,5%) и Proteus mirabilis (3,5%). E. coli показала наибольшую чувствительность к фосфомицину (98,1%), несколько меньшую – к мециллинаму (95,8%), нитрофурантоину (95,2%) и ципрофлоксацину (91,8%). Низкой оказалась чувствительность этого уропатогена к ампициллину (45,1%) и ко-тримоксазолу (70,5%). К амоксиклаву (амоксициллин/клавулановая кислота; 82,1%), цефуроксиму (82,5%) и налидиксовой кислоте (82,5%) уровень чувствительности был средним. В общем спектре чувствительность уропатогенов была следующей: фосфомицин (96,4%), мециллинам (95,9%), ципрофлоксацин (90,3%) и нитрофурантоин (87,0%). Во всех странах уровень чувствительности E. coli оказался выше 90% только к фосфомицину, мециллинаму и нитрофурантоину. Уровень чувствительности к препаратам существенно варьировался в разных странах, за исключением фосфомицина, мециллинама и нитрофурантоина [2]. В России (ДАРМИС, 2010–2011) чувствительность штаммов E. coli, выделенных у пациентов с неосложненной ИМП, составила к фосфомицину 98,9%, нитрофурантоину 94,7%, фуразидину калия 96,8%, ципрофлоксацину 90,0%, левофлоксацину 90,5%, цефиксиму 93,2%, ко-тримоксазолу 77,4% [3].
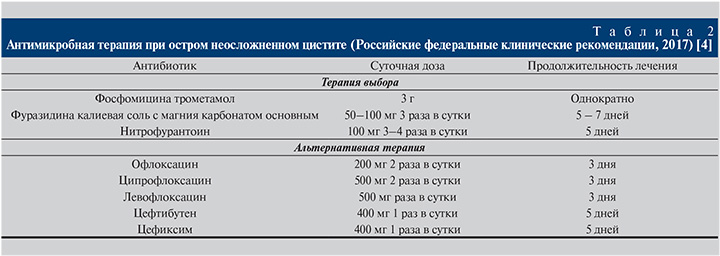
Основные рекомендации по лечению неосложненного цистита (EAU, AUA, IDSA, Российские федеральные клинические рекомендации, 2017) базируются на принципах доказательной медицины и результатах проведенных исследований (табл. 1, 2) [1, 4]. Доказано, что короткие курсы антимикробной терапии являются методом выбора по многим причинам: лучшая комплаентность, меньшее количество нежелательных и коллатеральных эффектов, меньшая стоимость, в то же время равная эффективность по сравнению со стандартной терапией. Вместе с тем не все антибиотики одинаково подходят для этого режима дозирования. В настоящее время доказанной эффективностью в лечении больных с инфекцией нижних мочевыводящих путей (ИНМП) обладают несколько препаратов, среди которых многими специалистами предпочтение по-прежнему отдается фосфомицину [5–13].
Фосфомицин был открыт в Испании в 1969 г.; являясь оригинальным препаратом, он по своей химической природе не похож на другие антибиотики и проявляет активность в отношении многих уропатогенов. Фосфомицин существует в двух пероральных формах – фосфомицина трометамин (синоним трометамол), растворимая соль с улучшенной биоэквивалентностью, и фосфомицин кальций. Имеется также фосфомицин дисодиум, препарат для внутривенного введения. Фосфомицин является ингибитором синтеза клеточной стенки микроорганизмов. Биоэквивалентность препарата составляет около 40%, а период полувыведения – 4 ч. Благодаря активной почечной экскреции создается высокая концентрация фосфомицина в моче, превышающая МПК для большинства уропатогенов. Спектр активности фосфомицина включает как грамнегативные, так и грампозитивные бактерии. Помимо E. coli препарат высокоактивен в отношении S. aureus, Enterococcus, а также P. aeruginosa и K. pneumoniae. Его уникальный механизм действия обеспечивает синергичный эффект с другими классами антибиотиков, включая β-лактамы, аминогликозиды и фторхинолоны [14].
Для лечения неосложненной ИНМП рекомендуется однократная доза фосфомицина 3 г. Фосфомицин не связывается с белками плазмы, поэтому в первый день лечения оказывается в моче, превышая в 440 раз МПК E. coli. Такая концентрация сохраняется в течение 80 ч. Изменения дозы при нарушении функции почек или печени не требуется. Нежелательные явления (НЯ) включают тошноту, рвоту, диарею, головную и абдоминальную боль, вагинит. При наблюдении более чем за 800 больными умеренные НЯ отмечены только в 6,1% случаев [15]. Больные должны быть предупреждены, что после однократного приема препарата симптомы регрессируют медленно в течение 2–3 дней и это не свидетельствует о его неэффективности. Применение препаратов 5-аминосалициловой кислоты и метоклопрамида может приводить к снижению концентрации фосфомицина в сыворотке крови и моче. Фосфомицин эффективен и безопасен при беременности [16]. В США недавно проведен и опубликован новый анализ частоты НЯ при применении фосфомицина с учетом данных the Food and Drug Administration Adverse Event (AE) Reporting System (FAERS) и последних публикаций в литературе. Отмечено отсутствие новых тревожных сигналов, связанных с безопасностью как перорального, так и парентерального более широкого применения препарата [17].

Сравнению эффективности 3 г фосфомицина с другими антибиотиками при неосложненном цистите были посвящены 6 рандомизированных контролируемых исследований [18, 19]. Сравнительные исследования эффективности фосфомицина в лечении неосложненной инфекции нижних МВП показали, что однократная доза препарата имеет одинаковую клиническую эффективность по сравнению с 5-дневным курсом триметоприм-сульфаметоксазола. Клиническая эффективность фосфомицина была сопоставимой с 7-дневным курсом лечения нитрофурантоином, эрадикация возбудителя составила 78 и 86% в ранние сроки, а спустя 4–6 нед после окончания терапии – 96 и 91% соответственно [19]. В опубликованных мета-анализах проведенных исследований отмечено, что фосфомицина трометамол (3 г однократно) является адекватным выбором для лечения неосложненного цистита (уровень доказательности A-I) и имеет минимальный уровень резистентности [20, 21].
Резистентность к фосфомицину наблюдается редко и обусловлена нарушением транспорта препарата в бактериальную клетку или энзиматической модификацией препарата. Уровень резистентности E. coli к фосфомицину в мире на протяжении многих лет не превышает 1–4%. При лечении острого неосложненного цистита, вызванного в 73% случаев E. coli, ее резистентность к ко-тримоксазолу, офлоксацину, цефиксиму, нитрофурантоину, была равна соответственно 25,5%; 17; 5,6 и 2,2%. В то же время по данным 12 амбулаторных лабораторий, резистентность E. coli к фосфомицину не превышала 1,2% [22]. В ходе национального исследования CANWARD, проведенного в Канаде с 2010 по 2013 г., из мочи пациентов было выделено 868 штаммов E. coli. Согласно лабораторному стандарту CLSI, концентрации фосфомицина, ингибирующие рост 50 и 90% микроорганизмов, составили ≤1 и 4 μg/ml; 99,4% микроорганизмов были чувствительными к антибиотику [23].
Фосфомицин появился в клинической практике в период, когда микроорганизмы еще не вырабатывали β-лактамазы расширенного спектра (БЛРС) или карбапенемазы. Десятилетия спустя стало обычным выделение штаммов с множественной резистентностью (MDR) или даже панрезистентных микроорганизмов (PDR), что ограничивает возможности лечения ряда тяжелых пациентов. Многие микроорганизмы, резистентные к другим антибиотикам, в том числе продуцирующим БЛРС E. coli, сохраняют чувствительность к фосфомицину [24–26]. Бактерицидное действие препарата проявляется на более раннем этапе синтеза микробной клеточной стенки по сравнению с β-лактамными антибиотиками. В связи с этим сегодня не только сохраняется широкое применение пероральной формы фосфомицина, но и вырос интерес к его парентеральному введению. Фосфомицин создает высокую концентрацию в моче и тканях, проникает в биофильмы. In vitro препарат проявляет высокую активность в отношении БЛРС- и карбапенемазпродуцирующих Enterobacteriaceae; чувствительность к P. aeruginosa с множественной устойчивостью зависит от локальных условий.
S. Giancola и соавт. [27] провели ретроспективный анализ эффективности лечения ИПМ ≥1 дозы фосфомицина с 2009 по 2015 г. Из 57 пациентов у 44 (77,2%) имела место осложненная ИМП, в 36 (63,2%) случаях выделены MDR-уропатогены, а у 23 (40,4%) пациентов имелась осложненная ИМП, обусловленная MDR-уропатогенами: E. coli (n=2 8), Enterococcus spp. (n=22) и P. aeruginosa (n=8). Из 31 изолята 30 (96,8%) были чувствительными (зона подавления ≥16 мм) к фосфомицину, у 15 из 20 (75%) пациентов при повторном бактериологическом исследовании отмечено микробиологическое излечение. Результаты этого ретроспективного исследования показали возможность эффективной альтернативной терапии осложненной ИМП фосфомицином per os.
В одном из крупных госпиталей Великобритании с 2013 по 2015 г. 75 пациентам проведено лечение фосфомицином 151 эпизода ИМП, а также в лаборатории проанализирована чувствительность к препарату более 18 тыс. изолятов E. coli и Klebsiella spp. В большинстве случаев выделена E. coli (69%), 59% штаммов были продуцентами БЛРС. Уровень резистентности к фосфомицину E. coli составил 1%, а Klebsiella spp. – 19% (p<0.0001). Рекомендованная однократная доза фосфомицина была назначена 53/75 (71%) пациентам, в остальных случаях проведено два и более курсов лечения. Пять пациентов получали пролонгированное лечение фосфомицином (от 15 до 81 дозы), при этом серьезных НЯ не отмечено [28].
В исследовании [29] при лечении 178 амбулаторных пациентов с ИМП, вызванной БЛРС-продуцирующими уропатогенами, проведено сравнение эффективности фосфомицина и эртапенема. В 149 (83,7%) случаях выделена E. coli, в 26 (14,6%) – Klebsiella spp. и у 3 (1,7%) пациентов – другие уропатогены. Фосфомицин 3 г per os получали 89 пациентов каждые 72 ч (62%) или каждые 48 ч (23%). Другой группе из 89 пациентов проведена терапия эртапенемом в дозе 1 г в сутки внутривенно. Повторное обращение в течение 30 дней потребовалось 14,6% пациентов группы фосфомицина и 13,5% – эртапенема. По клинической эффективности фосфомицин не превосходит эртапенем в лечении ИМП, вызванной БЛРС-продуцирующими уропатогенами, но может рассматриваться как подходящий препарат для ступенчатой терапии.
B. Grabein и соавт. [30] проанализировали 128 опубликованных исследований эффективности внутривенного применения фосфомицина 5527 пациентами. Фосфомицин назначается преимущественно для лечения сепсиса/бактериемии, ИМП, инфекций респираторного тракта, костной и центральной нервной систем. В сравнительных исследованиях не выявлено различий в клинической и микробиологической эффективности между фосфомицином и другими антибиотиками. При монотерапии фосфомицином уровень резистентности к нему микроорганизмов составляет не более 3,4%. Фосфомицин показал благоприятный профиль безопасности с умеренно выраженными НЯ, не требовавшими прекращения лечения. Комбинированная терапия (фосфомицин+β-лактамы или аминогликозиды) нередко применяется для лечения инфекций, вызванных MDR-микроорганизмами. Авторы считают, что фосфомицин может играть жизненно важную роль в обеспечении антимикробными препаратами, что обусловлено длительной историей его эффективности и безопасного применения.
Опубликованы результаты успешного комбинированного лечения фосфомицином с карбапенемами заболеваний, вызванных Pseudomonas aeruginosa, а также сепсиса, обусловленного Morganella morganii, продуцирующей New Delhi metallo-β-lactamase (blaNDM-1) и qnrD [31, 32]. В случаях сепсиса, вызванного карбапенемрезистентными Klebsiella pneumoniae, добавление к комбинированной терапии фосфомицина существенно увеличивало выживаемость тяжелых пациентов [33].
В связи с ростом резистентности уропатогенов к антибиотикам, особенно к фторхинолонам, рядом экспертов высказывается обоснованное мнение о возможности применения фосфомицина для периоперативной профилактики ИМП при выполнении эндоурологических операций [34], а также трансректальной биопсии предстательной железы (ТРБП) [35, 36]. В мультицентровом европейском исследовании, в котором приняли участие 1109 пациентов, при выполнении ТРБП в 632 случаях для профилактики инфекционных осложнений было назначено 2 дозы фосфомицина 3 г с интервалом 24 ч, в остальных случаях стандартно применялся ципрофлоксацин 1000 мг в сутки в течение 5 дней [35]. Эффективность фосфомицина оказалась выше, а частота НЯ ниже, чем в группе пациентов, получавших стандартную профилактику. Хорошая фармакокинетика фосфомицина в ткани предстательной железы и высокая чувствительность к нему микроорганизмов с множественной устойчивостью позволяют в ряде случаев применять фосфомицин для лечения пациентов, страдающих хроническим простатитом [37–39]. Исследований эффективности фосфомицина в лечении осложненной ИМП недостаточно, а в условиях растущей резистентности микроорганизмов к антибиотикам они необходимы.
В заключение необходимо подчеркнуть, что в условиях все более часто диагностируемой резистентности микроорганизмов к антимикробным препаратам необходимо их осторожное и взвешенное применение с учетом возможных факторов риска развития резистентности. Клинические рекомендации должны способствовать более адекватному назначению антибиотиков больным ИМП. Предпочтение следует отдавать антибиотикам с меньшим потенциальным риском увеличения уровня резистентности. Фторхинолоны и антибиотики широкого спектра действия должны быть резервированы для терапии второй линии. Необходимо минимизировать профилактическое применение антибиотиков при рецидивирующей ИМП, пытаться устранить имеющиеся у больных факторы риска развития рецидивов и продолжить поиск альтернативных методов лечения и профилактики ИМП.
Следует также отметить, что патентная защита оригинального фосфомицина трометамола истекла и уже в прошлом году на российском рынке появилось несколько дженерических фосфомицинов для перорального применения при неосложненных инфекциях мочевыводящих путей. Следует принять во внимание, что стоимость таких препаратов существенно ниже оригинального фосфомицина, при этом качество, а, следовательно, и безопасность и эффективность лечения в значительной степени зависят от компании производителя. Поэтому стоит более внимательно присмотреться к вновь появившимся и ожидаемым европейским дженерикам фосфомицина, особенно немецкого происхождения. Так Фосфомицин Эспарма производства немецкой компании «Эспарма ГмбХ» уже более 3 лет продается в Германии, где прекрасно зарекомендовал себя среди врачей и пациентов и с каждым месяцем спрос на него увеличивается. В странах Западной Европы и в США на сегодняшний день больше половины всех выписываемых лекарств – это дженерики. Данная тенденция отмечается и на российском рынке.



