Бесплодие – неспособность сексуально активной, не использующей контрацептивы пары достичь беременности в течение 1 года. Около 25% семейных пар не достигают беременности в течение 1 года, среди них 15% супружеских пар лечатся по поводу бесплодия, при этом все же менее 5% семейных пар так и остаются бесплодными. Примерно 30–40% случаев приходится на мужское бесплодие, 50% – на женское, еще 20–30% – на смешанное [1–3]. Мужское бесплодие прямо или косвенно обусловлено массой разнообразных факторов (см. таблицу) [3–5]. По меньшей мере в 30–40% наблюдений причинный фактор мужского бесплодия не выявляется (идиопатическое бесплодие). У этих пациентов в анамнезе нет проблем с фертильностью, изменений при физикальном осмотре и в лабораторных данных гормональных исследований. При этом в анализе эякулята выявляется снижение числа сперматозоидов (олигозооспермия), снижение подвижности сперматозоидов (астенозооспермия) и множество сперматозоидов с измененной формой (тератозооспермия). Эти изменения в спермограмме часто наблюдаются одновременно и обозначаются как олигоастенотератозооспермия (ОАТ-синдром) [6]. Прогностические факторы мужского бесплодия: длительность бесплодия, первичное или вторичное бесплодие, данные спермограммы, возраст и фертильность партнерши. В бесплодных парах с длительностью наблюдения 2 года и с олигозооспермией в качестве первичной причины бесплодия кумулятивный уровень беременностей составляет 27% [2].
Необструктивная азооспремия (НОА) – наиболее тяжелое проявление мужского бесплодия. Она не представляет собой редкость, затрагивая 1% всех мужчин и 10% бесплодных мужчин [7]. В основе НОА часто лежат необратимые нарушения: генетические (микроделеции Y-хромосомы и синдром Клайнфелтера) и врожденные (аплазия яичек, крипторхизм), осложнения инфекций (орхит при паротите), воздействие на синтез гонадотропинов (лучевая или химиотерапия), травма яичек. Также НОА может быть идиопатической. В целом складывается в некоторой степени парадоксальная ситуация: специалисту не составляет труда установить факт наличия бесплодия у мужчины (т.е. определить его фертильность), но весьма сложно и трудоемко выявить причину патоспермии, вызвавшую бесплодие, и тем более добиться успеха в его лечении [8, 9].
В настоящее время ведутся исследовательские работы по изучению возможности восстановления нормального сперматогенеза у мужчин с помощью методик регенеративной медицины [10, 11]. Первостепенную роль в данном процессе играют уникальные клетки в базальной мембране извитых канальцев яичек – сперматогенные стволовые клетки (ССК). R. Brinster и соавт. первыми доказали возможность изолировать и трансплантировать ССК для восстановления фертильности у мышей [12]. Это дало толчок к поиску альтернативных и эффективных методов лечения азооспермии.
Существует несколько направлений по восстановлению нормального сперматогенеза у мужчин с азооспермией. Первое – это создание «искусственных сперматозоидов» из соматических клеток [13, 14]. В 2006 г. на заседании Международного общества по исследованиям стволовых клеток в Торонто (Канада) прозвучал доклад S. Yamanaka, где он привел удивительно простой рецепт: активации всего лишь четырех генов (репрограммирующих факторов) достаточно для того, чтобы превратить фибробласты (взятые из мышиной кожи) обратно в плюрипотентные стволовые клетки [15]. Из таких индуцированных плюрипотентных стволовых клеток можно получать разные типы зрелых клеток, включая клетки кожи, нейроны головного мозга, клетки сердечной мышцы и половые клетки.
 С помощью данного механизма обратного репрограммирования клеток высокодифференцированную клетку трансформируют обратно в стволовую, а затем в сперматозоид, который может быть использован для интрацитоплазматической инъекции (ICSI). В доклинических исследованиях на мышах уже получены первые поколения таких потомств. При этом у людей в экспериментальных работах такие сперматозоиды также были получены, но попытки оплодотворения не предпринимались [16].
С помощью данного механизма обратного репрограммирования клеток высокодифференцированную клетку трансформируют обратно в стволовую, а затем в сперматозоид, который может быть использован для интрацитоплазматической инъекции (ICSI). В доклинических исследованиях на мышах уже получены первые поколения таких потомств. При этом у людей в экспериментальных работах такие сперматозоиды также были получены, но попытки оплодотворения не предпринимались [16].
Второе направление – аутологичная трансплантация культивируемых ССК для восстановления сперматогенеза. При сохранении функциональных ССК проводят биопсию яичка. Затем in vitro ССК культивируют и вводят в яичко. Поколения, выращенные в результате такой трансплантации, уже получены от мышей [17], крыс [18], однако на людях подобные трансплантации не проводились [19].
Другим многообещающим направлением в восстановлении нормального сперматогенеза является применение мезенхимальных стволовых клеток (МСК) взрослых людей. М. Ghasemzadech-Hasankolaei и соавт. в 2016 г. в эксперименте in vitro выделили МСК костного мозга тремя способами и генерировали ССК с последующей трансплантацией в семенники барана [20]. Мезенхимальные стволовые клетки возможно выделить практически из всех видов тканей. В настоящее время большинство работ посвящено изучению свойств МСК, выделенных из костного мозга человека. В 2014 г. в Университете аль-Азхар (Каир, Египет), было начато клиническое исследование по применению аутологичных МСК костного мозга при НОА. В исследование включены 60 пациентов с диагностированной НОА. Для получения стволовых клеток выполнен забор 60 мл костного мозга, из которого получено 5 мл концентрата стволовых клеток с последующей инъекцией в яичко. При количественной оценке инъецированной дозы получали 3–5 млн аутологичных стволовых клеток (в 5 мл). Целью исследования стала оценка безопасности применения данных клеток, их влияния на гормональный статус мужчин (повышение тестостерона, снижение ФСГ, ЛГ и пролактина), на морфологию яичек, а также на эректильную функцию. Исследование продолжается [21].
В другом клиническом исследовании аутологичные стволовые клетки из костного мозга вводили в интратестикулярную артерию (Man Clinic, Каир, Египет, 2013). Оценка эффективности использования МСК костного мозга проведена 20 мужчинам через 3–6 мес после введения на основе анализа спермограммы и ингибина В, который используется как маркер сперматогенеза у мужчин и функции яичников у женщин [22]. Исследование также продолжается.

Несмотря на то что костный мозг является основным источником МСК, существует ряд ограничений в использовании указанного типа клеток. Во-первых, для получения костного мозга необходимо выполнение трепанобиопсии. Во-вторых, без риска для организма возможно получение только небольшого количества костного мозга. В то же время МСК костного мозга составляют менее 0,01% от всех клеток костного мозга, что требует длительной культивации полученного материала для получения достаточного их количества.
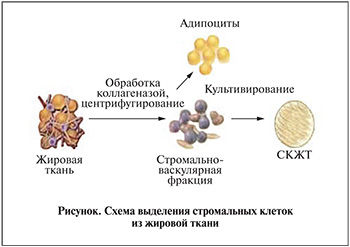
Недавно было показано, что наиболее перспективными в применении являются мезенхимальные клетки, полученные из жировой ткани. У взрослого человека в ее состав входят жировые клетки – адипоциты, а также клетки, составляющие стромально-васкулярную фракцию (СВФ) жировой ткани: преадипоциты, эндотелиальные и гладкомышечные клетки кровеносных сосудов, периваскулярные фибробласты и поддерживающая волокнистая коллагеновая строма (см. рисунок). В строме была обнаружена популяция стволовых/прогениторных клеток с мультилинейным потенциалом дифференцировки, во многом сходных с МСК костного мозга. Насыщенность жировой ткани стволовыми клетками может в 100 раз превышать таковую в костном мозге. Данная находка послужила толчком к проведению различного рода исследований, поскольку, в отличие от костного мозга, жировая ткань может быть легко получена и обработана без ущерба для организма донора.
Было показано, что стволовые клетки, выделенные из жировой ткани (Adipose-Derived Stem Cells, ADSC), могут дифференцироваться в клетки различных типов – клетки костной, хрящевой, жировой ткани, поперечно-полосатой мускулатуры, клетки сосудов и нервной ткани. Кроме того, происходящие из жировой ткани стволовые клетки секретируют значительное количество способствующих ангиогенезу цитокинов, таких как фактор роста гепатоцитов и фактор роста эндотелия сосудов. C. Cakici и соавт. в исследовании на 20 крысах применяли МСК из жировой ткани [23]. Для оценки эффективности в одном яичке моделировали азооспермию при помощи бусульфана (алкилирующий мутаген), другое яичко оставляли для контроля. Через 12 нед после введения стволовых клеток 4 крысы были отобраны для контрольного измерения размеров яичек, еще 4 – для иммуногистохимического анализа и выявления помеченных стволовых клеток. Оставшихся 12 крыс скрестили с крысами женского пола. При оценке эффективности оказалось, что яички, в которые вводили стволовые клетки, морфологически были нормальными, тогда как в контрольных яичках наблюдалась атрофия ткани. При иммуногистохимическом анализе в извитых канальцах констатировали сперматогенез, но не во всех. При этом был проведен идентичный анализ у потомства для регистрации экспрессии вводимых стволовых клеток. Оказалось, что экспрессия сохраняется в жировой ткани, костном мозге и эякуляте, что подтверждает сохранность генетической информации в последующих поколениях. Стволовые клетки жировой ткани требуют длительного культивирования с участием специально подготовленного персонала с навыками работы; процесс культивирования достаточно трудоемкий и затратный по времени.
Сравнительно недавно предложен новый метод получения регенеративных клеток из жировой ткани (Adipose-Derived Regenerative Cells, ADRC) путем ферментативной обработки. Данный тип клеток обладает большим регенераторным потенциалом и не требует предварительного культивирования (готов к использованию сразу после выделения). Эффект регенеративных клеток жировой ткани реализуется за счет нескольких механизмов, учитывая гетерогенность их популяции. За счет стволовых клеток, входящих в их состав, ADRC способны к дифференцировке в различных направлениях и замещению поврежденных участков тканей. Кроме того, ADRC вырабатывают массу паракринных факторов, которые обеспечивают иммуномодулирующий эффект, предотвращают клеточную гибель по механизму апоптоза, способствуют неоангиогенезу, ремоделированию фиброзной и соединительной тканей [24, 25].
Изучением клеточных технологий занимаются российские врачи-исследователи на базе Сеченовского Университета. Проведен ряд исследований по оценке эффективности и безопасности применения аутоплазмы крови, обогащенной тромбоцитарными факторами роста (АОТ), и СВФ в лечении эректильной дисфункции, которые показали улучшение артериального кровотока и восстановление эндотелиальной функции [26–30]. Таким образом, была выдвинута гипотеза, что применение АОТ и СВФ может быть альтернативным методом лечения мужского бесплодия, обусловленного НОА. За счет широкого спектра факторов роста и других молекул, содержащихся в α-гранулах тромбоцитов, происходит стимуляция образования коллагена, ускорение регенерации клеток, индуцирование роста сосудов, обеспечение гемостаза [31]. В 2017 г. при грантовой поддержке Сеченовского Университета совместно с виварно-экспериментальным комплексом ООО «НИИ Митоинженерии МГУ» начато доклиническое исследование на самцах крыс. Эксперимент предполагает моделирование бесплодия на лабораторных животных с последующим введением активированной и неактивированной АОТ интратестикулярно и/или в семенные канатики с оценкой безопасности и эффективности применения данного метода в лечении мужского бесплодия. Также планируется проведение доклинического исследования на лабораторных животных по оценке безопасности и эффективности применения СВФ в лечении мужского бесплодия.
Полученные результаты позволят продолжить изучение данных методов клеточной терапии в лечении мужского бесплодия с проведением клинических исследований.
Таким образом, в настоящее время идет активное внедрение клеточных и регенеративных технологий в области репродуктологии, что значительно расширяет арсенал терапевтических средств, используемых в лечении мужского бесплодия, и в скором будущем позволит разработать новые подходы к ведению пациентов с данным патологическим состоянием.


