Введение. Почечно-клеточный рак остается одной из наиболее актуальных проблем современной онкоурологии в связи с растущей заболеваемостью. В 2012 г. по всему миру зафиксировано 338 тыс. новых случаев почечно-клеточного рака и 144 тыс. летальных исходов по этой причине [1]. Раннее обнаружение новообразований, связанное с широким распространением лучевых методов диагностики, позволяет до 70% опухолей выявить в локализованной форме (стадия T1–2N0M0), что дает возможность провести радикальное лечение [2]. Оперативный метод – основной в арсенале комплексного лечения больных локализованным почечно-клеточным раком [3]. Согласно последним рекомендациям Европейской ассоциации урологов, пациентам, страдающим почечно-клеточным раком стадии T1a–T1b, рекомендовано выполнять органосохраняющее вмешательство – резекцию почки [4].
Резекция почки по поводу почечно-клеточного рака в стадии T1N0M0, как и нефрэктомия, обеспечивает высокие и сопоставимые показатели 3-летней опухольспецифической выживаемости – до 99,3% [5]. В последнее время все больший интерес урологов вызывает функциональное состояние органа после резекции почки [6, 7], поскольку данная операция характеризуется существенно более низким риском развития хронической почечной недостаточности и сердечно-сосудистых осложнений, лучшими показателями общей выживаемости [8]. Органосохраняющие операции при новообразованиях почек, выполняемые с полным пережатием сосудов почки, приводят к ишемическим нарушениям почечной паренхимы, что доказано результатами исследования М. С. Мосоян [9]. Даже при среднем времени тепловой ишемии, равном 14,4 мин, снижение почечной функции наступает уже через 24 ч и усугубляется через 1 год. Это подтверждается исследованиями [10, 11], в которых продемонстрировано влияние каждой минуты ишемии на отдаленные функциональные результаты резекции почки.
 Несмотря на различные варианты органосохраняющих резекций почек, ухудшение функционального состояния оперированной почки в послеоперационном периоде возникает в 18–20,7% случаев [3, 12], к чему приводит изначальное состояние оперируемой почки, в 65–70% подверженной нефросклеротическим изменениям на фоне имеющегося атеросклероза, гипертонической болезни, сахарного диабета [13]. Хирургическая травма почки при ее выделении для последующей резекции сама по себе обусловливает ишемические нарушения в почечной паренхиме [14–16]. Применяемая нами методика лапароскопической резекции почки с суперселективной баллонной эмболизацией (ССБЭ) почечной артерии [17] позволяет выполнять резекцию образования почки с минимальной травматизацией органа и с наименьшими функциональными потерями. Оценке функционального состояния резецированной почки посвящено настоящее исследование.
Несмотря на различные варианты органосохраняющих резекций почек, ухудшение функционального состояния оперированной почки в послеоперационном периоде возникает в 18–20,7% случаев [3, 12], к чему приводит изначальное состояние оперируемой почки, в 65–70% подверженной нефросклеротическим изменениям на фоне имеющегося атеросклероза, гипертонической болезни, сахарного диабета [13]. Хирургическая травма почки при ее выделении для последующей резекции сама по себе обусловливает ишемические нарушения в почечной паренхиме [14–16]. Применяемая нами методика лапароскопической резекции почки с суперселективной баллонной эмболизацией (ССБЭ) почечной артерии [17] позволяет выполнять резекцию образования почки с минимальной травматизацией органа и с наименьшими функциональными потерями. Оценке функционального состояния резецированной почки посвящено настоящее исследование.
Материалы и методы. За 2016 г. выполнено 11 операций по методике лапароскопической резекции почки с ССБЭ почечной артерии [17] по поводу новобразований почки (основная группа). Среди прооперированных было 3 мужчины и 8 женщин, их средний возраст составил 56,8 года (от 29 до 72 лет). В 5 наблюдениях процесс локализовался справа, в 6 – слева; верхний сегмент почки был поражен в 1 случае, средний – в 3, нижний – в 7. Размер опухолей варьировался от 0,9 до 3,8 см, в среднем составив 1,9 см. Всем больным до операции выполнялись рутинные исследования (УЗИ почек с допплерографией сосудов почек, МСКТ органов брюшной полости и забрюшинного пространства, реносцинтиграфия, общеклинические исследования). По данным МСКТ, степень сложности резекции почки по шкале R.E.N.A.L. составила 5,1 балла, что соответствует легкой степени резектабельности. Эмболизацию сегментарной почечной артерии, питающей участок паренхимы с образованием, проводили непосредственно перед лапароскопической резекцией почки. После выполнения суперселективной почечной ангиографии в сегментарную или долевую артерию почки устанавливали коронарный баллон соответствующего диаметра (2,5–3,5 мм), раздували его до достижения окклюзии и прекращения кровотока в паренхиме, после чего приступали к лапароскопическому этапу операции. После резекции и ушивания раны почки баллон тотчас сдували, запуская кровоток в ишемизированный участок. Среднее время тепловой ишемии сегмента почки составило 112,5 мин (от 90 до 150 мин), что обусловлено техническими причинами: баллонная эмболизация выполнялась в условиях рентгенхирургического кабинета, лапароскопический этап – в операционном зале.
 В контрольную группу вошли 10 больных с новообразованиями почек, которым выполнена резекция почки с пережатием почечной ножки en-block сосудистым зажимом с временем тепловой ишемии не более 20 мин. Средний возраст больных составил 57,3 года (от 36 до 70 лет), локализация и размеры опухоли были сопоставимыми с таковыми в основной группе: слева процесс локализовался в 6 случаях, справа – в 4; верхний сегмент был поражен у 4 больных, средний – у 4 и нижний – у 2. Размеры опухоли варьировались от 1 до 4,1 см, в среднем составив 2,2 см. Средний балл по шкале R.E.N.A.L. составил 6,1.
В контрольную группу вошли 10 больных с новообразованиями почек, которым выполнена резекция почки с пережатием почечной ножки en-block сосудистым зажимом с временем тепловой ишемии не более 20 мин. Средний возраст больных составил 57,3 года (от 36 до 70 лет), локализация и размеры опухоли были сопоставимыми с таковыми в основной группе: слева процесс локализовался в 6 случаях, справа – в 4; верхний сегмент был поражен у 4 больных, средний – у 4 и нижний – у 2. Размеры опухоли варьировались от 1 до 4,1 см, в среднем составив 2,2 см. Средний балл по шкале R.E.N.A.L. составил 6,1.
Для оценки функциональных свойств почек у всех пациентов определяли скорость клубочковой фильтрации (СКФ) по формуле Реберга:
СКФ = (креатинин мочи/креатинин крови) ∙ минутный диурез.
Для определения уровня креатинина мочи осуществляли катетеризацию обоих мочеточников мочеточниковыми катетерами размером 6 Ch посредством цистоскопии и получали определенный обьем выделенной мочи из разных почек за единицу времени. В мочевой пузырь устанавливали цистоскоп с инструментальным каналом, через устья выполняли катетеризацию обоих мочеточников под УЗ-контролем с заведением мочеточниковых катетеров в полостную систему почек. Получали раздельный (справа и слева) обьем мочи за единицу времени. В собранной моче определяли концентрацию креатинина. В то же время измеряли уровень креатинина сыворотки крови. Скорость клубочковой фильтрации у пациентов обеих групп определяли за несколько дней до операции, в ходе оперативного вмешательства непосредственно после запуска кровотока в резецируемую почку и в последующие 5 дней после операции 1 раз в сутки.
Анализ полученных данных проводили с использованием статистических пакетов SPSS (Windows версия 7.5.2). Достоверность различий между количественными показателями вычисляли по критерию t-Стьюдента для нормально распределенных величин. Различия признавали значимыми при p<0,05.

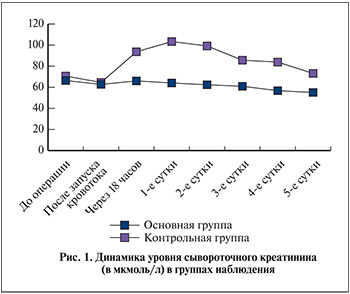
Реультаты и обсуждение. Полученные данные достоверно отражают динамику функционального состояния обеих почек – оперированной и здоровой – в обеих группах, поскольку основаны на прямом измерении содержания креатинина в моче и одновременно в крови. Уровень сывороточного креатинина оставался в пределах нормы на всем протяжении периода исследований в обеих группах (рис. 1).
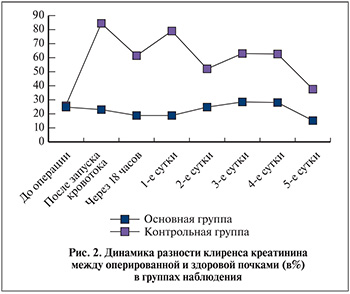
Незначительное на первый взгляд до верхней границы нормы повышение уровня креатинина крови в контрольной группе объясняется функциональной компенсацией контралатеральной почки: снижение функции оперированной почки компенсируется повышением работы здорового органа, что в итоге обусловливает незначительный рост уремии. При более детальном рассмотрении оказалось, что по отношению к исходному уровню креатинина в основной группе отмечено некоторое, на 2,2%, снижение содержания остаточного азота, в контрольной группе, наоборот, повышение почти наполовину (45,5%). Объясняется это разностью клиренса креатинина оперированной и здоровой почек в обеих группах (рис. 2).
 Разность клиренса в основной группе колебалась в пределах от 24,9% до операции до 28,73% в максимальном отклонении, что в среднем составило 22,75%. Клиренс креатинина резецированной и здоровой почек в основной группе не претерпевал значительных изменений (рис. 3, а). В контрольной группе разброс разности клиренса креатинина между резецированной и здоровой почками за весь период наблюдения оказался более значимым: от 26,4% накануне операции до 85,04% сразу после прекращения тепловой ишемии, что составило в среднем 58,4%.
Разность клиренса в основной группе колебалась в пределах от 24,9% до операции до 28,73% в максимальном отклонении, что в среднем составило 22,75%. Клиренс креатинина резецированной и здоровой почек в основной группе не претерпевал значительных изменений (рис. 3, а). В контрольной группе разброс разности клиренса креатинина между резецированной и здоровой почками за весь период наблюдения оказался более значимым: от 26,4% накануне операции до 85,04% сразу после прекращения тепловой ишемии, что составило в среднем 58,4%.
В контрольной группе клиренс креатинина оперированной почки восстанавливался только к исходу первой недели и сопровождался компенсаторным повышением клиренса интактной почки (рис. 3, б).
Таким образом, в послеоперационном периоде отмечено статистически значимое снижение клиренса креатинина оперированной почки в 1,02 раза при ССБЭ и в 1,92 – при пережатии сосудов почки (p=0,03). Одновременно имело место компенсаторное повышение СКФ контралатеральной почки в 1,15 раза при ССБЭ и в 1,66 – при пережатии почечной ножки.
Качественные изменения работы почек сопровождаются и количественными изменениями. Это находит отражение в изменении минутного диуреза оперированной и контралатеральной почек. Восстановление минутного диуреза в основной группе происходило к началу вторых суток послеоперационного периода (рис. 4, а).
Наблюдалось равномерное снижение минутного диуреза обеих почек в момент операции и в первые часы послеоперационного периода, что обусловлено операционным стрессом, и такое же равномерное восстановление количества продуцируемой мочи к началу вторых суток: минутный диурез оперированной почки после эмболизации снизился в среднем на 43,53%, здоровой почки – на 20,71%.
У больных контрольной группы наблюдалось более позднее и менее выраженное восстановление минутного диуреза резецированной почки (рис. 4, б). Так, диурез резецированной почки снизился в среднем на 83,21%, интактной почки – на 31,61%, что указывает на более выраженные функциональные нарушения оперированного органа.

В основной группе разность диуреза между резецированной и здоровой почками изменилась с 23,94 до 29,73%, в контрольной – более существенно: с 39,7% до операции до 64,03% в послеоперационном периоде (рис. 5).
Из представленных графиков наглядно видно, что восстановление диуреза оперированной почки, подвергшейся селективной эмболизации, происходило к началу вторых суток, а во время операции и в первые 18 ч количество мочи практически не отличалось от показателя интактной почки, чего нельзя сказать о резецированной почке с пережатием сосудов: выработка мочи оперированной почкой снижалась к исходу первых суток до олигоурии и только со вторых суток постепенно возобновлялась, не достигая дооперационного уровня за весь период наблюдения.
Концентрация креатинина в моче, выделяемой обеими почками, не сильно разнилась в обеих группах (рис. 6). Разность креатинина мочи между оперированной и здоровой почками в основной группе выросла с 12,02 до 22,19%, в контрольной – с 14,67 до 31,5%.
Заключение. Полученные результаты показали, что СКФ отдельно взятой резецированной почки при ССБЭ почечной артерии практически не снижается по сравнению с дооперационными значениями (изменения в 1,02 раза), а при тотальной ишемии, вызванной пережатием сосудистой ножки почки, зафиксировано почти двукратное снижение СКФ (в 1,92 раза) без выраженных изменений уровня остаточного азота в крови в обеих группах, что обусловлено незначительным повышением (в 1,15 раза) СКФ контралатеральной почки в экспериментальной группе и более чем полуторакратным (в 1,66 раза) повышением СКФ интактной почки в контрольной группе. Приведенные данные наглядно показывают отсутствие значимых функциональных нарушений при резекции почки с предварительной ССБЭ почечной артерии.



