Введение. Проблема ранней диагностики острого повреждения почек (ОПП) у больных с сочетанной травмой является одной из существенных в клинической медицине и до сих пор находится в стадии разработки. Многие вопросы диагностики и лечения пока остаются нерешенными. Изучение ранних клинико-диагностических особенностей острого повреждения почек у больных с сочетанной травмой позволят своевременно и точно диагностировать нарушение почечной функции и выбирать верную тактику лечения.
На сегодняшний день ведется поиск различных биомаркеров, которые позволили бы осуществить раннюю диагностику острого повреждения почек с последующим их включением в алгоритм обследования [1].Такими маркерами в сыворотке крови являются цистатин С, NGAL, пропредсердный натрийуретический пептид, CD 11b-нейтрофил. Показателями ОПП в моче является повышение уровня NGAL, ИЛ-18, молекулы повреждения почек 1, ЛДГ, N-ацетилглюкозаминидазы, матриксной металлопротеиназы 9 [2, 3].
Так как скорость клубочковой фильтрации (СКФ) – наиболее надежный показатель, который отражает функционирование почек, особенно актуален поиск точного, простого, малотравматичного и быстрого метода определения СКФ у пострадавших с сочетанной травмой. Определение сывороточного цистатина С – относительно новый метод для оценки СКФ [4, 6, 9]. Цистатин С – наиболее надежный показатель сохранности функций почек, является более чувствительным, чем сывороточный креатинин, показателем снижения СКФ, что дает возможность считать его эффективным критерием диагностики ОПП даже при нормальных значениях сывороточного креатинина [5, 7]. На темп выработки цистатина С в отличие от креатинина не влияют такие факторы, как возраст, мышечная масса, пол, особенности питания, воспалительные реакции в организме [8–12].
Цель исследования: определение ранних диагностических критериев ОПП у больных с сочетанной травмой путем внедрения в план обследования пострадавших от измерения сывороточного биомаркера цистатина С.
Материалы и методы. Исследование, проведенное кафедрой факультетской и эндоскопической хирургии Кабардино-Балкарского государственного университета на базе отделения сочетанной травмой республиканской клинической больницы. Обследованы 42 пациента, получивших сочетанную травму за период с 2015 по 2016 г. По тяжести состояния, основным антропометрическим критериям и социальным параметрам пациенты статистически значимо не различались. Подавляющее большинство (39; 92,8%) пострадавших были в возрасте от 21 года до 60 лет, т.е. в наиболее трудоспособном возрасте, что имеет важное значение с позиций медико-социальной реабилитации. Среди пострадавших преобладали мужчины (80%).
Биоматериалом для определения уровня цистатина С служила сыворотка крови. Забор крови осуществлен на 1-й, 3, 7, 14-й день с момента травмы.
 Для оценки фильтрационно-реабсорбционной функции почек применяли пробу Реберга–Тареева. Этот метод позволяет определить очистительную способность почек, основан на определении почечного клиренса экзогенного креатинина. У всех пациентов определены следующие показатели: креатинин крови, креатинин мочи, количество мочи за 1 ч, минутный диурез, клубочковая фильтрация, канальцевая реабсорбция, количество выделенной мочи за сутки. Скорость клубочковой фильтрации определяли по пробе Реберга–Тареева и по цистатину С.
Для оценки фильтрационно-реабсорбционной функции почек применяли пробу Реберга–Тареева. Этот метод позволяет определить очистительную способность почек, основан на определении почечного клиренса экзогенного креатинина. У всех пациентов определены следующие показатели: креатинин крови, креатинин мочи, количество мочи за 1 ч, минутный диурез, клубочковая фильтрация, канальцевая реабсорбция, количество выделенной мочи за сутки. Скорость клубочковой фильтрации определяли по пробе Реберга–Тареева и по цистатину С.
Полученные при исследовании данные обработаны вариационно-статистическим методом по t-критерию Стьюдента. Рассчитаны средняя арифметическая (), среднее квадратическое отклонение (Δ), стандартная ошибка средней величины (σ). Данные представлены в форме Δ±σ. Различия считали статистически значимыми при p<0,05, что является мерой достаточной надежности в медицинских исследованиях [13]. Также использованы пакет статистического анализа и встроенные формулы расчетов компьютерной программы Microsoft® Excell (Microsoft Office, 2010).
Результаты. В ходе исследования выявлено, что у 40 (95,3%) больных показатели пробы Реберга–Тареева были в пределах нормы, у 2 (4,7%) – ниже нормативных значений, что было связано с развитием у них клиники острой почечной недостаточности на 6–7-й день после травмы. Проба Реберга–Тареева была выполнена до развития олигурической стадии.
Напомним, что у данной группы больных параллельно определяли в крови уровень сывороточного цистатина С в 1-е, 3, 7, 14-е сутки с момента получения травмы. Так как мы использовали реагент DiaSys CystatinC FS, расчет СКФ осуществляли по уравнению Хоука (по рекомендации производителя реагента): СКФ [мл/мин/1,73 м2]=(80,35/цистатин С [мг/л]) – 4,32. Следует отметить, что ни у одного из пациентов в анамнезе хронических заболеваний почек не было. В норме показатели сывороточного цистатина С для возрастной группы 19–49 лет составляют 0,53–0,92 мг/л; для лиц 50 лет и старше – 0,58–1,02 мг/л.
По результатам клинического применения данного способа диагностики ОПП и субклинического ОПП у больных с сочетанной травмой нами разработаны диагностические критерии указанных патологических состояний. При значениях показателя сывороточного цистатина С в диапазоне 0,92–2 (19–49 лет) и 1,02–2 мг/л (>50 лет) мы диагностировали субклиническое ОПП, что также подтверждалось отсутствием клинической симптоматики. В случае получения уровня цистатина С в сыворотке крови, превышающего 2 мг/л в обеих возрастных группах, нами выставлялся диагноз острого повреждения почек, клиника которого была ярко выраженной.
В ходе исследования выявлено, что подавляющее большинство пациентов с сочетанной травмой имели нормальный уровень сывороточного креатинина (38 человек). Уровень же сывороточного цистатина С у 33 (78,6%) пострадавших более чем на 30% превышал нормальные значения. Причем повышение уровня цистатина С наблюдалось в первые 3 сут, затем происходило постепенное его снижение.
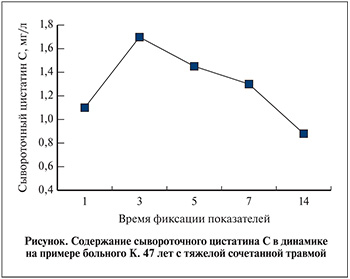
В качестве примера приводим динамику показателя сывороточного цистатина С у конкретного пациента (см. рисунок).
У 7 (21,2%) пострадавших с повышенным уровнем цистатина С высокие цифры сохранялись и спустя 1 нед с момента получения травмы. У 24 пациентов был диагностирован ушиб почек, из них у 15 (62,5%) показатель цистатина С оказался выше нормы. У 1 больной, за 1 мес до травмы перенесшей нефрэктомию слева, уровень цистатина С также превысил нормальные значения (1,4 мг/л).
Скорость клубочковой фильтрации, согласно данным пробы Реберга–Тареева, была снижена только у 4 больных, тогда как при расчете по формуле Хоука – у 33 пострадавших.
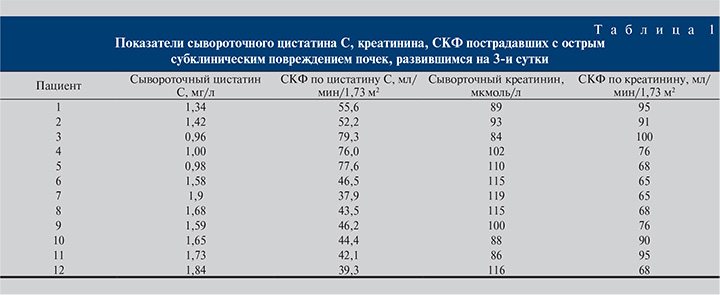
На 3-и сутки с момента травмы у 12 пострадавших на основании повышения уровня сывороточного цистатина С было диагностировано субклиническое ОПП. При этом показатели азотемии у данной группы больных были в пределах нормы (табл. 1).
Из представленных данных видно, что СКФ по сывороточному цистатину С ниже, чем по сывороточному креатинину, что свидетельствует о скрытой почечной дисфункции, субклиническом ОПП.
Благодаря рано начатым лечебно-профилактическим мероприятиям удалось в отношении 10 пациентов с сочетанной травмой предотвратить развитие ОПП. В 2 наблюдениях субклиническое повреждение почек перешло в ОПП, содержание сывороточного цистатина С на 5-е и 7-е сутки было выше 2 мг/мл (2,6 и 2,75 мг/л соответственно).
Нефропротективная терапия проведена N-ацетилцистеином (N-АЦ), который назначали в стандартной дозе: 1200 мг внутривенно струйно после поступления в стационар и проведения оперативного лечения, далее по 600 мг внутривенно 2 раза в сутки в течение 72 ч, затем внутрь по 600 мг 2 раза в сутки в течение 10 дней. После выписки из стационара пациентам назначали повторный курс лечения N-АЦ 1 раз в 3 месяца в дозе 1200 мг в сутки в течение 14 дней.
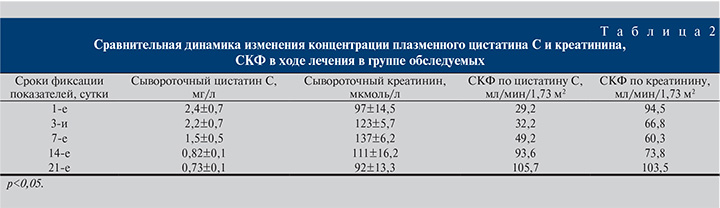
Антиоксидант N-АЦ связывает свободные радикалы, вызывающие в том числе повреждения канальцев почек. Также N-АЦ взаимодействует с эндотелием, действуя как расслабляющий фактор, тем самым повышая капиллярный кровоток; увеличивает уровень цГМФ, действует как вазодилататор и как ингибитор агрегации тромбоцитов. Все вышеуказанное обеспечивает нефропротективное действие N-АЦ в периоперационном периоде у больных с сочетанной травмой, которое подтверждается низким уровнем сывороточного цистатина С. N-ацетилцистеин уменьшает выраженность воспалительной реакции в организме и тем самым снижает секрецию плазменного цистатина С с последующим его полным метаболизированием в почках [14–20]. В ходе лечения проведен мониторинг фильтрационной способности почек (табл. 2).
Обсуждение. Необходимо отметить, что в отличие от креатинина крови сывороточный цистатин С отреагировал повышением концентрации в первые же сутки после травмы, тогда как гиперкреатининемия наблюдалась лишь к 3-м суткам. Скорость клубочковой фильтрации при расчете по формуле Хоука снизилась в 1-е сутки и восстановилась к 2-й неделе. При расчете СКФ по пробе Реберга–Тареева снижение отмечено к 3-м суткам с момента травмы. Это еще раз подтверждает, что креатинин крови не надежен по ряду причин, одна из которых заключается в повышении его уровня при уже развившемся повреждении почек [21, 22].
Самым главным преимуществом цистатина С по сравнению с кретинином при определении СКФ является то, что он способен выявить пострадавших даже с незначительными нарушениями функций почек, так как он обладает большей специфичностью и чувствительностью [23].
Выводы
- Включение определения сывороточной концентрации цистатина С в диагностику ренальной дисфункции у больных с сочетанной травмой в панель исследования более предпочтительно по сравнению с креатинином.
- Установлено, что СКФ, рассчитанная по сывороточному цистатину С (формула Хоука), наиболее достоверно в ранние сроки отражает почечную дисфункцию по сравнению с СКФ по пробе Реберга–Тареева.
- Сывороточная концентрация цистатина С в диапазоне 0,92–2 мг/л (для возраста 19–49 лет) и 1,02–2 мг/л (>50 лет) может быть маркером субклинического острого повреждения почек в отсутствие клинической симптоматики.
- Определена нефропротективная роль N-ацетил-цистеина в комплексе консервативных мероприятий для профилактики и лечения острого повреждения почек больных с сочетанной травмой.



