Введение. Составив около 7–10% в популяции развитых стран Европы и Северной Америки, мочекаменная болезнь (МКБ) остается социально значимым заболеванием, занимая 2-е место среди урологических нозологий после инфекций мочевых путей и лидируя по частоте причин госпитализаций в урологические стационары [1, 2]. За последнее десятилетие в Европе и Северной Америке прирост заболеваемости МКБ составил до 37% [2–5], аналогичный показатель в отдельных регионах Российской Федерации достиг 29,1% [6]. Подобные тенденции связаны как с сохранением значимости традиционных причин МКБ, а именно генетических и эндемических факторов и аномалий мочевой системы, так и ростом влияния болезней, урбанизации (характер питания, образ жизни), а также глобального потепления и т.д. [7]. Последние вносят свой вклад в динамику прироста уратного уролитиаза в общей структуре МКБ [8, 9].
Пристальное внимание исследователей и рост числа экспериментальных и клинических публикаций также связаны с отсутствием на сегодняшний день эффективных профилактических и метафилактических мероприятий по МКБ [10–14].
При этом нельзя отрицать несомненный прогресс за последние 20 лет в разработке методик лечения пациентов, страдающих МКБ, что свело к минимуму потребность в открытых оперативных вмешательствах, частота которых не только в экспертных центрах, но и в профильных урологических отделениях не превышает 8% [15, 16]. На пальму первенства претендуют три основных направления в лечении МКБ: дистанционная ударно-волновая литотрипсия, нефролитотрипсия посредством антеградного перкутанного или ретроградного доступов. Использование комбинированного ультразвукового и рентгеновского наведения, четкой фокусировки и возможности регулирования ударной волны в современных аппаратах для дистанционной ударно-волновой литотрипсии, минимизация диаметра и применение гибких эндоскопов, различных источников энергии для дезинтеграции конкрементов, систем доступа и обеспечения гемостаза для проведения контактной литотрипсии из ретроградного и антеградного доступов позволяют решать большинство задач по удалению мочевых камней [15, 16]. Однако лечение пациентов с коралловидным нефролитиазом представляет большие технические трудности [15, 17].
Секционные нефролитотомии, тем более экстракорпоральные вмешательства с аутотрансплантацией почки имеют лишь исторический интерес [18], а различные методические решения и проведение многократных сеансов ДУВЛ этой категории пациентов не зарекомендовали себя с хорошей стороны [17, 19]. Публикации, посвященные ретроградной нефролитотрипсии при коралловидном нефролитиазе, содержат небольшое число наблюдений, а сами авторы указывают на то, что основным ограничивающим фактором остается размер конкремента [20]. Кроме того, в литературе пока отсутствует анализ состояния мочеточника в отдаленные сроки после длительных ретроградных, а иногда и многоэтапных вмешательств при коралловидном уролитиазе. Поэтому, на наш взгляд, трудно сравнить преимущества от отсутствия перкутанного доступа с состоянием мочеточника после такого вмешательства. Использование мини- и микроперка не позволяет удалять коралловидные конкременты, поэтому по сути единственной эффективной методикой остается перкутанная нефролитотрипсия (ПНЛТ) с созданием достаточного для удаления всей массы конкремента доступа (24–30 Сh), а в случае анатомических предпосылок со стороны чашечно-лоханочной системы (ЧЛС) или вследствие распространенности нефролитиаза – формирование одного или двух дополнительных доступов аналогичного диаметра. Это, несомненно, увеличивает травматичность вмешательства и, соответственно, риск геморрагических и инфекционных осложнений [19, 21, 22].
Целью настоящего исследования стала оценка частоты геморрагических осложнений после ПНЛТ.
Материалы и методы. За 2010–2016 гг. выполнено 146 ПНЛТ, из них в 81 (55,5%) случае вмешательство выполнено по поводу коралловидного нефролитиаза. Анатомию ЧЛС и распространенность нефролитиаза, согласно рекомендациям РОУ, EAU и AUA, оценивали на основании данных низкодозной спиральной КТ без контрастирования. Наша клиника не располагает наборами оборудования для мини- и микроперка, поэтому ПНЛТ всем пациентам выполняли после формирования доступа телескопическими бужами и установки кожуха Amplatz 28 или 30 Ch под комбинированным ультразвуковым и рентгенологическим контролем. Визуализацию обеспечивали нефроскопами Karl Storz 24 и 28 Ch с прямым рабочим каналом и углом обзора 12,5°. Первичную пункцию ЧЛС для снижения риска ранения дуговых сосудов делали под УЗ-контролем в режиме цветного допплеровского картирования. Дезинтеграцию конкрементов проводили комбинированным пневмомеханическим и ультразвуковым литотриптером Swisslithoclast® master («ElectroMedicalSystems», Швейцария). Гемостаз осуществлен тампонированием канала баллоном катетера Фоли 24 Сh с 3–5 мл контраста и парентеральной гемостатической терапией: этамзилат и транексам по 2 г в сутки, разделенные на 4 введения внутривенно. Объем интраоперационной кровопотери рассчитан по модифицированной методике Moore, где за должные взяты предоперационные, а за фактические – послеоперационные показатели гемограммы. Необходимость тампонирования нефростомического хода больше суток с или без трансфузии свежезамороженной плазмы для обеспечения гемостаза после ПНЛТ расценивали как послеоперационное кровотечение.
Стандартный хирургический подход позволил нам провести сравнение по частоте геморрагических осложнений у пациентов с коралловидным нефролитиазом и без такового (контроль).
Распространенность коралловидного нефролитиаза оценивали по классификации НИИ урологии МЗ РФ [23], в соответствии с которой при стадии К-1 коралловидный камень занимает лоханку, имеются небольшие отроги чашечки почки; при стадии К-2 – коралловидный камень занимает лоханку, часть или одну часшечку почки (менее 60% объема ЧЛС); при К-3 – коралловидный камень занимает лоханку и не менее двух чашечек почки (менее 60–80% объема ЧЛС), а при К-4 – коралловидный камень занимает всю ЧЛС или более 80% объема ЧЛС.
Статистическая обработка выполнена с использованием непараметрического критерия Манна–Уитни, различия считали статистически значимыми при вероятности 95%.
Результаты. Обе группы были сопоставимыми по возрасту и полу (р>0,05). Масса тела пациентов основной группы была статистически значимо выше таковой в контрольной группе, составив 94,1±15,4 и 68,3±9,6 кг соответственно (р<0,05), индекс массы тела в основной группе составил в среднем 45,9±7,6 против 28,5±9,4 кг/м2 в контрольной (p<0,05).
По классификации коралловидного нефролитиаза стадия К-1 диагностирована у 21 (25,9%) пациента, К-2 – у 43 (53,1%), К-3 – у 7 (8,6%) и К-4 – у 10 (12,3%).
Двусторонний нефролитиаз отмечен у 32 (39,5%) пациентов основной группы, при этом коралловидные конкременты определены у 19 (23,5%), что было статистически значимо выше, чем в контрольной группе, где аналогичные показатели составили 11 (16,9%) и 3 (4,6%) соответственно (р<0,05).
Формирование дополнительного доступа потребовалось 7 (8,6%) пациентам основной группы, 2 (2,5%) больным нефролитотрипсия была выполнена из трех доступов. В контрольной группе использование одного доступа обеспечило удаление конкремента.
Ни в одном из наших наблюдений не отмечено интенсивного кровотечения, потребовавшего конверсии или отсроченной ревизии почки. Продолжительность операции (от катетеризации почки до фиксации нефростомического дренажа) была статистически значимо выше в основной группе наблюдения, составив 75,4±22,7 мин против 31,6±12,2 в контроле (p<0,05). Аналогичная динамика прослеживалась по объему интраоперационной кровопотери, рассчитанной по снижению уровня гемоглобина после операции. Данный показатель в основной группе наблюдения составил 415±157 мл, причем у пациентов с дополнительными доступами средняя кровопотеря была и того выше – 502±64 мл, но не достигла статистически значимых различий с показателями пациентов основной группы, которым был выполнен один доступ (p>0,05). В контрольной группе наблюдения интраоперационная кровопотеря составила 170±58 мл (p<0,05).
Данное обстоятельство, однако, не повлияло на выраженность послеоперационных геморрагических осложнений и необходимость трансфузии свежезамороженной плазмы в послеоперационном периоде. Трансфузия плазмы проведена 6 (7,4%) пациентам основной группы и 4 (6,2%) – контрольной (p>0,05). Еще 7 (8,6%) пациентам основной группы потребовалось тампонирование нефростомического хода более суток в связи с кровотечением по нефростоме, т.е. в целом частота хирургических послеоперационных осложнений II степени по классификации Clavien–Dindo составила 16%. Аналогичное число пациентов с продленным тампонированием увеличило встречаемость послеоперационных кровотечений в контроле до 16,9%, что статистически значимо не отличалось от показателя основной группы наблюдения (р>0,05).
Четверо (4,9%) пациентов основной группы и 3 (4,6%) – контрольной за 2 нед до операции были переведены с непрямых антикоагулянтов на нефракционированные прямые, более длительное тампонирование нефростомического канала потребовалось лишь одному пациенту контрольной группы (p>0,05). Мы не смогли ретроспективно оценить длительность приема дезагрегантов, но сам по себе прием не повышал вероятности геморрагических осложнений. Так, из 34 (42%) пациентов основной группы, находившихся на дезагрегантной терапии, геморрагические осложнения отмечены у 4 (4,9% от всей группы), что составило 30,8% от числа пациентов с осложнениями и 11,8% от получавших дезагреганты (p>0,05). В контрольной группе число пациентов с данным видом антитромботической профилактики составило 28 (43,1%), геморрагические осложнения также отмечены в 4 наблюдениях – 6,2% от всей группы, 36,4% от числа пациентов с осложнениями и 14,3% от получавших дезагреганты (p>0,05).
Десять пациентов основной группы с геморрагическими осложнениями имели труднокорригируемую артериальную гипертензию на операции, что составило 76,9%. Склонность к гипертензии у пациентов этой группы без геморрагических осложнений при анализе анестезиологических карт отмечена в 7 наблюдениях, что составило 10,3% (p<0,05). Аналогичные показатели контрольной группы составили 8 (72,7%) и 4 (7,4%) пациента соответственно (p<0,05).
Этапные вмешательства (у пациентов с ранее установленными нефростомическими дренажами) в основной группе выполнены в 10 (12,3%) наблюдениях, в контроле – в 14 (21,5%). Важно отметить, что ни после одной из этапных операций не отмечено геморрагических осложнений (p<0,05). Одномоментные ПНЛТ выполнены 71 (87,7%) пациенту основной и 51 (78,5%) контрольной групп наблюдения (р>0,05). Все геморрагические осложнения в обеих группах наблюдения регистрировали при одномоментных вмешательствах, при этом достоверных различий отмечено не было, а их частота в основной и контрольной группах наблюдения составила 21,3 и 21,6% соответственно (р>0,05).
В завершение анализа причин геморрагических осложнений представляем наблюдение отсроченного кровотечения (11-е сутки после операции) у пациентки контрольной группы, потребовавшей рентгенваскулярного рентгенэндоваскулярного вмешательства (IIIа-класс по Clavien–Dindo).
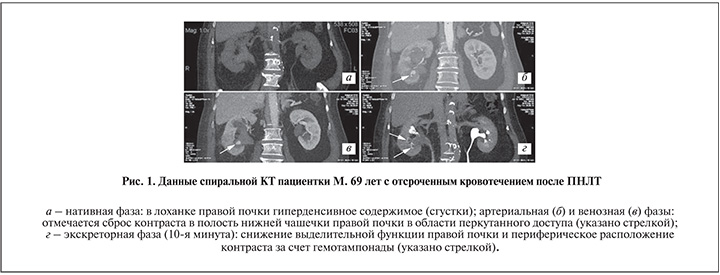
П а ц и е н т к а М. 69 лет госпитализирована в плановом порядке с диагнозом МКБ. Камни лоханки и нижней чашечки правой почки. Гидронефроз II ст. справа. Хронический калькулезный пиелонефрит, ремиссия, ХПН0. Гематурия. Причиной гематурии был признан крупный лоханочный конкремент размером 2×4 см.
Пациентке выполнена типичная ПНЛТ с доступом через нижнюю чашечку, продолжительность операции – 25 мин. Клинически значимая кровопотеря не определялась. Показатели гемограммы до операции: эр. – 4,93×1012/л, Hb – 131 г/л; после операции – 4,7×1012/л и 131 г/л соответственно. Течение после операционного периода стандартное: баллон спущен на 1-е сутки, нефростома удалена на 3-и. Из факторов риска нужно отметить прием аспирина 75 мг/сут. На 11-е сутки после операции на фоне гипертонического криза у больной возникло профузное почечное кровотечение с нестабильностью гемодинамики, коллапсом. Экстренное обследование выявило умеренную постгеморрагическую анемию: эр. – 2,79×1012 /л, Hb – 92 г/л. При УЗИ отмечены гемотампонада почки, а также сгустки в мочевом пузыре в объеме до 150 мл. Источник кровотечения визуализирован по данным спиральной КТ в ангиографическом режиме, где в артериальную фазу определялся сброс контраста в ЧЛС (рис. 1).
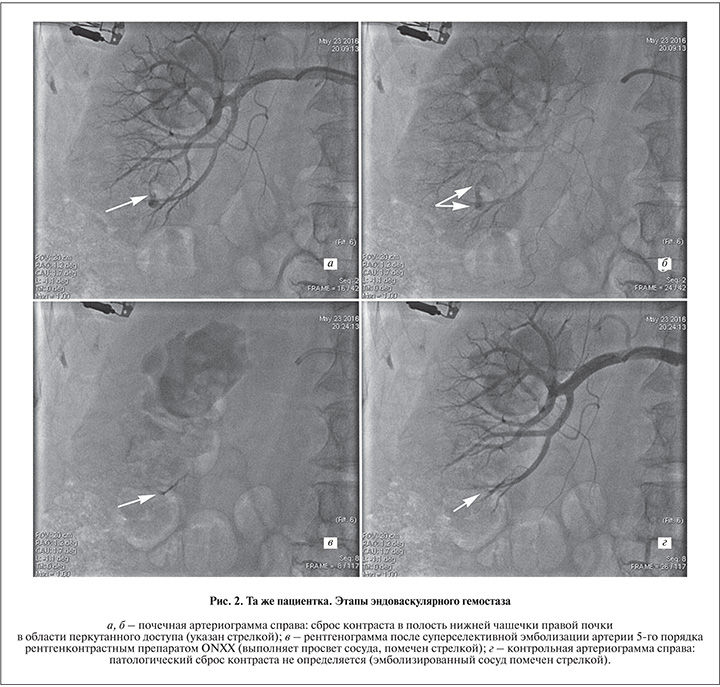
В экстренном порядке выполнена суперселективная эмболизация артерии 5-го порядка препаратом ONXX, что исключило рецидив кровотечения (рис. 2). Хотелось бы отметить, что все манипуляции были завершены в течение часа от поступления пациентки в приемное отделение.
После обеспечения стабильного гемостаза сгустки из мочевого пузыря были отмыты. От дренирования почки отказались, фибринолиз почечных сгустков отмечен к 5-м суткам. Через неделю пациентка выписана, показатели гемограммы при выписке: эр. – 3,89×1012 /л, Hb – 113 г/л.
Сделать однозначное заключение об этиологии данного осложнения в представленном наблюдении невозможно. Вероятно, его причиной стал прием дезагрегантов или все связано с бактериальным фибринолизом на фоне мочевой инфекции, или пациентка имела артериовенозную мальформацию, что сопровождалось гематурией еще до операции. Однако неоспорим провоцирующий фактор в виде гипертонического криза.
Обсуждение. Опираясь на собственные данные (55,5% составили коралловидные камни), мы безусловно не можем с уверенностью говорить об эпидемии коралловидного уролитиаза в нашем регионе, что связано с селекцией пациентов как на догоспитальном этапе, так и непосредственно в клинике. Однако нельзя не обратить внимания на частоту уратного уролитиаза у пациентов основной группы, которая составила 50,6%. Это коррелирует с увеличением доли уратных камней на 17,4% в структуре уролитиаза в России за последние 25 лет [24], что отражает тенденции в развитых странах мира, где доля уратного уролитиаза достигает 37% и подчеркивает всенарастающее влияние на патогенез МКБ характера питания и образа жизни, а может быть, и пресловутого метаболического синдрома [25], что осталось за рамками данного исследования, а эта гипотеза требует подтверждения.
Внимание к структуре корраловидных камней обусловлено трудностями выполнения ПНЛТ пациентам с уратными конкрементами, так как крайне затруднителен рентгенологический контроль резидуального нефролитиаза и требуется тщательный эндоскопический осмотр ЧЛС, который может быть причиной кровотечения из шеек чашечек.
В нашем исследовании длительность операции и число доступов выступали независимым фактором интраоперационной кровопотери, что также находит подтверждение в публикациях других авторов [19, 22]. Однако интраоперационная кровопотеря не сказалась на частоте послеоперационных геморрагических осложнений, что, видимо, связано с небольшим объемом кровопотери, не вызвавшим нарушений системы гемостаза.
Нами также не зарегистрирована зависимость риска развития геморрагических осложнений в послеоперационном периоде с приемом антикоагулянтов и дезагрегантов, хотя многие авторы находили корреляции между данными параметрами [26]. По нашему мнению, основной причиной такого результата можно назвать небольшое число наблюдений с данной патологией и, возможно, более пристальное внимание к этой категории пациентов и настороженность ввиду возможных осложнений. Другим вероятным объяснением такого результата может быть то, что риск кровотечения определяется доступом, а не временем операции (типом конкремента), поэтому мы и не получили различий в группах наблюдения.
Несомненно, использование этапного подхода может сократить риски геморрагических осложнений, однако это утверждение требует детализации. В нашем исследовании нефростомы устанавливали по поводу обструктивного пиелонефрита и дренирование проводилось не менее 2 нед и мы не можем сказать, что формирование доступа за 2–5 дней до операции сведет к минимуму риск кровотечения. Другими отрицательными сторонами такой тактики являются снижение качества жизни и повышение частоты катетер-ассоциированной инфекции у пациента с наружным дренажом.
Анализ причин послеоперационных кровотечений показал, что основным фактором риска развития геморрагических осложнений, по нашим данным, стала артериальная гипертензия. Мы не склонны думать, что это единственный этиологический фактор, но считаем, что коррекция гипертензии может стать залогом гладкого течения послеоперационного периода.
Наш небольшой опыт лечения почечных кровотечений после ПНЛТ показывает, что рентгенэндоваскулярная эмболизация служит эффективным инструментом в достижении окончательного гемостаза. Это нашло подтверждение в работах отечественных и зарубежных авторов [27].
Заключение. Уратный нефролитиаз в структуре коралловидного нефролитиаза среди наших пациентов составил 50,6%, что отражает как мировые, так и российские тенденции к его росту. Объем интраоперационной кровопотери коррелировал со временем операции и числом перкутанных доступов, но не влиял на частоту послеоперационных геморрагических осложнений, которые превалировали у пациентов с некорригированной артериальной гипертензией и не встречались у больных со сформированным более 2 нед нефростомическим ходом. Антикоагулянтная и дезагрегантная терапия в нашем исследовании не увеличила числа геморрагических осложнений. Рентгенэндоваскулярный гемостаз обеспечивает хорошие результаты и должен быть использован в случае продолжающегося почечного кровотечения.



