Введение. Поиск новых подходов к лечению инфекций в урологии, систематизации и стандартизации схем лечения в клинической практике диктует необходимость постоянного мониторинга эпидемиологической ситуации, знания структуры возбудителей, изучения уровня резистентности микроорганизмов по регионам.
Известно, что в этиологической структуре возбудителей внутрибольничных и внебольничных инфекций мочевыводящих путей (ИМП) ведущая роль принадлежит грамотрицательным микроорганизмам. По данным многочисленных исследований, примерно в 50–90% случаев этиологическим фактором выступает E. coli [1–6]. При этом отмечается некоторое увеличение (по сравнению с неосложненными) доли K. pneumoniae (10,3%) и P. aeruginosa (4,3%) в структуре возбудителей осложненных ИМП [7].
В настоящее время одной из наиболее клинически значимых проблем химиотерапии является резистентность возбудителей к современным цефалоспоринам и карбапенемам вследствие эпидемического распространения штаммов, продуцирующих β-лактамазы расширенного спектра действия (БЛРС), металло-β-лактамазы класса B (МБЛ) [8–16]. Также при планировании политики антимикробной терапии целесообразно опираться на локальные (региональные) данные, полученные в данной стране или в ее регионе.
Цель: провести анализ структуры и молекулярных механизмов антибиотикорезистентности грамотрицательных бактерий – возбудителей ИМП у взрослых пациентов Алматы.
Материалы и методы. В исследование было включено 87 клинически значимых изолятов (≥103 КОЕ/мл) бактерий и грибов, собранных от пациентов с ИМП отделения урологии ГКБ № 12 Алматы в рамках внутривузовского научного проекта «Мониторинг резистентности возбудителей внебольничных и нозокомиальных инфекций к антимикробным препаратам и изучение его молекулярных механизмов».
Микробиологическое выделение из мочи и первичная идентификация бактериальных изолятов проведены в лаборатории кафедры микробиологии КазНМУ им. С. Д. Асфендиярова. Окончательную видовую идентификацию и определение их чувствительности к антимикробным препаратам осуществили в НКДЛ НИИ им. Атчабарова. Все исследованные изоляты были идентифицированы до вида, была определена их антибиотикочувствительность на бактериологическом автоматизированном анализаторе VITEK-2 Compact, дополнительно использован классический дискодиффузионный метод определения антибиотикочувствительности на агаре Мюллера–Хинтона, согласно рекомендациям EUCAST [17].
Продукцию БЛРС определяли с помощью фенотипического метода двойных дисков по наличию расширенной зоны подавления роста между дисками с цефтазидимом (CAZ, 30 мкг), цефепимом (CPM, 30 мкг) и диском, содержащим комбинацию амоксициллина с клавулановой кислотой (AMC 20/10 мкг) [18]. Для контроля качества определения чувствительности использованы штаммы E. coli ATCC 25922, K. pneumoniae ATCC 700603 (ESBL+).
Детекцию наиболее распространенных и клинически значимых генов класса А (TEM1, СTX-M1, SHV, OXA) для культур с подтвержденным ESBL-фенотипом проводили методом ПЦР [19]. Геномную и плазмидную ДНК грамотрицательных бактерий выделяли по стандартной методике с помощью набора Easy Pure Bacteria Genomic DNA Kit (выделение геномной ДНК) и Easy Pure Plasmid MiniPrep Kit (выделение плазмидной ДНК) («TransGenBiotech», Китай). Использовали по 5 мл 18–20-часовой культуры бактерий.
Использованные праймеры для проведения ПЦР на 4 пары генов БЛРС (TEM1, CTX-M1, SHV, OXA) приведены в табл. 1.

Для ПЦР использовали по 10 пмоль каждых праймеров и 20 нг геномной и плазмидной ДНК бактерий, т.е. проводили 2 реакции на 1 образец. Применяли готовый мастер миксPlatinum® PCRSuperMix (LifeTechnologies, CAUSA), объем реакции составил 25 мкл, амплификацию осуществляли с использованием термоциклера BioRadIQ5 (Bio-RadLaboratories, Inc., CAUSA) по стандартному протоколу. Последующую детекцию генов проводили на 1%-ном агарозном геле с добавлением этидиум бромида. По образованию продукта амплификации делали заключение о наличии или отсутствии гена, характеризующегося определенной длиной.
 Детекцию генов карбапенемаз класса B металло-β-лактамаз (VIM-2) у выделенных и идентифицированных бактериальных изолятов P. aeruginosa провели методом ПЦР в режиме реального времени с использованием коммерческих наборов «АмплиСенс®. MDRAcinetobacter-OXA-FL» и «АмплиСенс®. MDRMBL-FL» (ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Россия) и системы Rotor-Gene 6000 («CorbettResearch», Австралия) в НИИ антимикробной химиотерапии Смоленска в рамках участия в многоцентровом проекте APEх.
Детекцию генов карбапенемаз класса B металло-β-лактамаз (VIM-2) у выделенных и идентифицированных бактериальных изолятов P. aeruginosa провели методом ПЦР в режиме реального времени с использованием коммерческих наборов «АмплиСенс®. MDRAcinetobacter-OXA-FL» и «АмплиСенс®. MDRMBL-FL» (ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Россия) и системы Rotor-Gene 6000 («CorbettResearch», Австралия) в НИИ антимикробной химиотерапии Смоленска в рамках участия в многоцентровом проекте APEх.
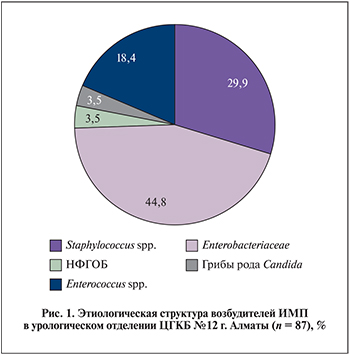
Результаты. В этиологической структуре ИМП в отделении урологии ГКБ № 12 Алматы ведущую роль играли представители семейства Enterobacteriaceae – 44,8%, при этом E. coli оказались возбудителем для 31% пациентов. Доля изолятов неферментирующих грамотрицательных бактерий (НФГОБ) составила 3,5% (рис. 1).
Распределение всех видов выделенных изолятов в этиологической структуре ИМП представлено в табл. 2, из них наибольшее количество (27 [31%]) изолятов было представлено E. coli. Значительно реже выделяли K. pneumoniaе (4,6%), E. cloacae (2,3%). Изолятов НФГОБ было выделено 3, из них 2 штамма P. aeruginosa. Среди грамположительных уропатогенов наиболее распространенными были Staphylococcus haemolyticus (11,5%), Enterococcus faecalis (10,4%), Staphylococcus aureus (8,1%).

Результаты оценки чувствительности основных изолятов Enterobacteriaceae и НФГОБ представлены в табл. 3.
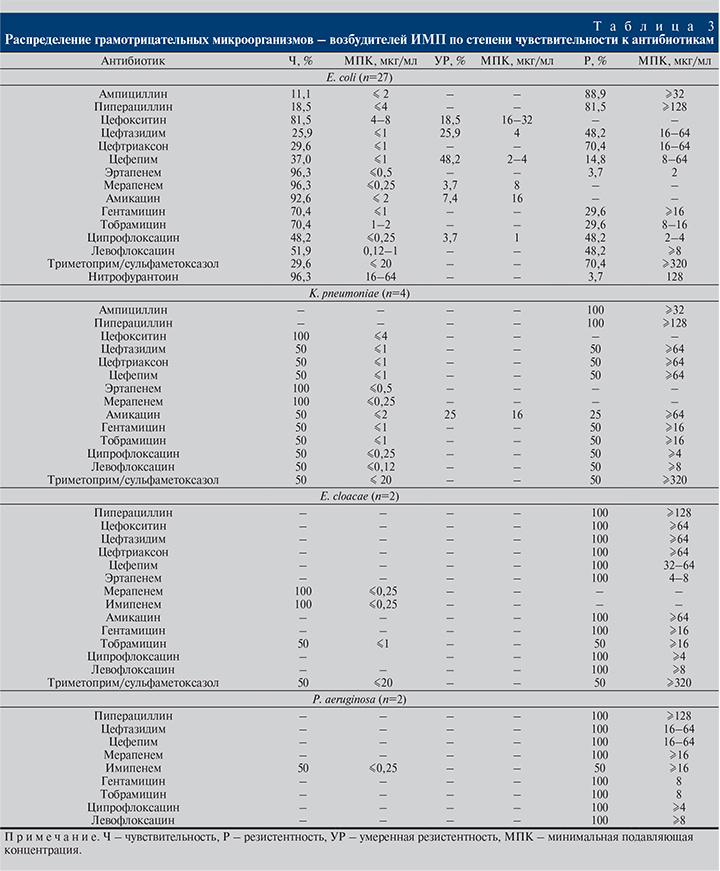
Как видно из результатов исследования, имеется высокая доля штаммов E. coli, резистентных к ампициллину (88,9%), пиперациллину (81,5%), а также к триметоприму/сульфаметоксазолу (70,4%). Зарегистрирован относительно высокий уровень резистентности к фторхинолонам ципрофлоксацину (48,2%) и левофлоксацину (48,2%). К цефалоспоринам III–IV поколений: к цефтазидиму были резистентны 48,2%, условно резистентны – 25,9%; к цефтриаксону – 70,4% и цефепиму – 14,8%, условно резистентны – 48,2% штаммов. К аминогликозидам гентамицину и тобрамицину резистентность проявляли 29,6% штаммов E. coli (рис. 2). Наиболее активными препаратами в отношении E. coli были карбапенемы и амикацин (96,3 и 92,6% чувствительных штаммов соответственно).
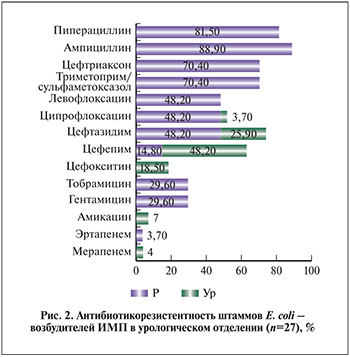 При ПЦР-детекции наличие генов наиболее распространенных групп β-лактамаз (TEM, CTX, OXA) подтверждено у 18 из 27 штаммов уропатогенной E. coli (66,7%).
При ПЦР-детекции наличие генов наиболее распространенных групп β-лактамаз (TEM, CTX, OXA) подтверждено у 18 из 27 штаммов уропатогенной E. coli (66,7%).
У 17 штаммов были зарегистрированы гены TEM1 (продукция β-лактамаз широкого спектра действия), из них 7 изолятов несли одновременно гены двух групп β-лактамаз TEM1+CTX-M1; 3 штамма одновременно – комбинацию генов TEM1+CTX-M1+ OXA; 1 штамм – TEM1+OXA. Изолированно ген CTX-M1 зарегистрирован у 1 штамма E. coli (рис. 3).
Известно, что CTX-M1, OXA генетически связаны с β-лактамазами широкого спектра и отличаются от TEM1 единичными аминокислотными заменами, расширяющими спектр ферментативной активности. Таким образом, продукция БЛРС, которые разрушают все β-лактамные антибиотики, за исключением цефамицинов (цефокситин) и карбапенемов, как основной механизм устойчивости к оксииминоцефалоспоринам была выявлена у 12 (44,4%) штаммов E. coli (по фенотипическим признакам и генетической детекции – blaTEM1+CTX-M1; blaTEM1+CTX-M1+OXA; blaTEM1+OXA; blaCTX-M1).
Выделенные в ходе исследования штаммы K. pneumoniae в 4,6% случаев оказались возбудителями ИМП и отличались абсолютной резистентностью к ампициллину (100%), пиперациллину (100%). Все штаммы K. pneumoniae были чувствительными к карбапенемам. Ко всем остальным группам антибиотиков 50% штаммов проявляли устойчивость (рис. 4).
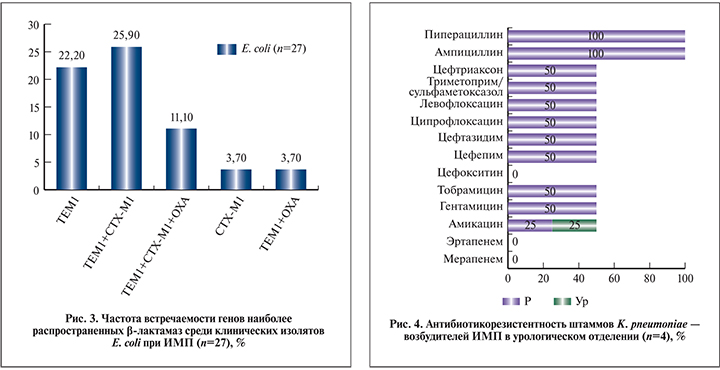
Резистентные к цефалоспоринам III–IV поколений штаммы K. pneumoniae (50%) были продуцентами blaOXA. Резюмируя эти данные, можно сказать, что наиболее часто уропатогенные E. coli в данном стационаре продуцируют β-лактамазы широкого спектра действия TEM-1-типа и ее комбинации с БЛРС CTX-M1, уропатогенные K. pneumoniae – БЛРС OXA-типа.
Два изолята Enterobacter cloacae, выделенные у больных ИМП, проявляли чувствительность к мерапенему и имипенему (100%), тобрамицину (50%) и триметоприму/сульфаметоксазолу (50%). К пиперациллину, амикацину, фторхинолонам, гентамицину, эртапенему, цефалоспоринам III–IV поколений, цефокситину регистрировалась абсолютная резистентность (100%).
Из исследованных генов при ПЦР-детекции у одного из штаммов E. cloacae обнаружены гены TEM1. Резистентность к цефалоспоринам, вероятно, обусловлена продукцией хромосомных β-лактамаз класса С, признаком чего является выявленная у данных штаммов устойчивость к цефокситину.
Неферментирующие грамотрицательные бактерии в этиологической структуре ИМП занимали 3,45%. Выделенные в ходе исследования 2 изолята P. aeruginosa были абсолютно резистентными ко всем исследованным антибиотикам, кроме имипенема в 1 случае.
Нечувствительный к карбапенемам, включая и имипенем, нозокомиальный штамм P. aeruginosa № 349, выделенный от пациента Д. 1963 г. рождения с диагнозом «мочекаменная болезнь, острый пиелонефрит справа; пузырно-мочеточниковый рефлюкс», проявил ассоциированную устойчивость к антибиотикам других классов: пиперациллину, фторхинолонам, аминогликозидам и цефалоспоринам. При ПЦР-детекции выявлен ген VIM-2, кодирующий выработку карбапенемаз молекулярного класса В МБЛ.
Выводы
- По данным нашего исследования, основное место в этиологической структуре возбудителей ИМП занимают представители семейства Enterobacteriaceae (44,8%), к основным возбудителям относятся E. coli (31%) и K. pneumoniae (4,6%).
- Среди изученных антибактериальных препаратов карбапенемы обладают наибольшей активностью по отношению ко всем видам энтеробактерий (96,3–100%). В отношении E. coli высокую активность проявляли нитрофурантоин (96,3%), амикацин (92,6%) и цефокситин (81,5%).
- Высокая частота резистентности к современным цефалоспоринам, обусловленная распространением БЛРС типов CTX-M1 и OXA, у E. coli в 44,4% случаев, у K. pneumoniae в 50%, исключает возможность их эмпирического применения для лечения ИМП, вызванных энтеробактериями.
- Высокая частота сочетанной устойчивости выделенных штаммов E. coli, K. pneumoniae к традиционно используемым не-β-лактамным антибиотикам: фторхинолонам (ципрофлоксацин, левофлоксацин) – 48,2–50%, к триметоприму/сульфаметоксазолу (50–70,4%) также не позволяет рекомендовать их широкое применение, за исключением случаев подтвержденной чувствительности.
- Регистрация нозокомиального МБЛ VIM-2 продуцирующего штамма P. aeruginosa в отделении урологии ГКБ № 12 Алматы, обладающего ассоциированной резистентностью к антибиотикам всех классов, за исключением полимиксинов, ограничивает возможности терапии инфекций, вызванных такими штаммами. В этой ситуации своевременная микробиологическая диагностика и строгое соблюдение мер инфекционного контроля в стационаре – единственный путь сдерживания распространения МБЛ.



