Мочекаменная болезнь (МКБ) – одно из наиболее часто встречающихся урологических заболеваний, доля пациентов с МКБ среди населения составляет 3%. Показатели заболеваемости и распространенности МКБ зависят от географических, климатических, этнических, диетических и генетических факторов и значительно меняются в различных регионах мира, находясь в пределах 1–20% [1, 2]. В России 32,4% всех урологических заболеваний приходится на МКБ, пациенты урологических стационаров с данной нозологией составляют не менее 30–40% [3]. У большинства больных МКБ выявляется в наиболее трудоспособном возрасте – 30–50 лет [4, 5, 8]. С учетом актуальности заболевания разработка новых методов диагностики, лечения и профилактики (метафилактики) приобретают огромную социальную значимость.
Наиболее частым компонентом мочевых конкрементов является кальций, который определяется в качестве основной составляющей почти в 80% камней. Оксалат кальция входит в состав 60% всех камней, смешанный оксалат кальция и гидроксилапатит — в 20 %, брушит — в 2 %. На долю уратных и струвитных конкрементов приходится по 7% для каждого вида, а цистиновые камни встречаются лишь в 1% случаев [6]. Физико-химическое исследование состава мочевых конкрементов позволяет сделать выводы о нарушениях метаболизма, помогает оптимизировать лечение и метафилактику уролитиаза [7].
Совокупность мероприятий при МКБ включает консервативное лечение (литокинетическая терапия, цитратный литолиз) и хирургические пособия (дистанционная литотрипсия [ДЛТ], чрескожную нефролитотрипсию [ЧНЛТ], контактную уретеролитотрипсию [КУЛТ]) [7, 8]. В целях выбора и оптимизации лечебной тактики требуется учитывать ряд диагностических (прогностических) аспектов, таких как размер, локализация, структурная плотность конкремента и т.д. [7, 9].
В настоящее время определение состава мочевых камней имеет высокую ценность в прогнозировании результатов оперативного лечения [7, 10]. Установлено, что камни из цистина, фосфата кальция и кальция оксалата моногидрата (КОМ) наиболее резистентны к ДЛТ, а их разрушение сопровождается образованием относительно больших фрагментов по сравнению с камнями другого физико-химического состава (струвит, дигидрат оксалата кальция и т.д.) [11–15]. К тому же результаты научных работ о прогностической ценности химического состава конкрементов в отношении исхода КУЛТ гольмиевым лазером остаются противоречивыми. Так, к примеру, в исследовании in vitro выявлена связь успешного результата КУЛТ и состава камня: неудовлетворительная дезинтеграция отмечена у КОМ, умеренная – у уратных и цистиновых конкрементов [16].Тем не менее результаты другой работы тех же авторов указывают на успешную фрагментацию камней всех составов с максимальным размером фрагмента до 4 мм [17]. Кроме того, отмечено, что при дополнительном использовании корзинки для извлечения конкрементов химический состав камней не влиял на продолжительность оперативного вмешательства [18].
Лучевые методы визуализации занимают ведущее место в диагностике МКБ, при этом самым точным является мультиспиральная компьютерная томография (МСКТ) [19]. Так, например, нативная МСКТ, признанная «золотым» стандартом в диагностике почечной колики, по точности значительно превышает экскреторную урографию и позволяет определять все виды конкрементов, кроме камней, образовавшихся в результате приема антиретровирусного препарата индинавира, их плотность, внутреннюю структуру и анатомию интересующей области – данная информация необходима для выбора лечебной тактики [20–25]. Изучая возможности стандартной МСКТ, ряд авторов пытались найти связь структурной плотности с составом конкрементов [7, 26–35]. Исследования in vitro и in vivo продемонстрировали различия в значениях структурной плотности между уратами и другими мочевыми камнями, так как ураты имеют более гомогенную структуру в отличие от кальцийоксалатных камней [36]. Однако была затруднена дифференцировка струвитных и цистиновых конкрементов, оксалата кальция и брушита, камней смешанного состава. В одном интервале структурных плотностей могли находиться камни разных типов или одного, но разных составов либо, наоборот, камни одинаковых типов и составов могли попасть в разные интервалы. Таким образом, одним из главных недостатков стандартной МСКТ является невозможность достоверного определения химического состава конкремента in vivo с учетом того, что эти данные необходимы для оценки эффекта лечения и более точного предоперационного планирования [7, 37]. В настоящий момент активно изучается применение в урологии нового метода – двухэнергетической компьютерной томографии (ДЭКТ). Принцип ДЭКТ заключается в получении специфических данных на основе использования источника, генерирующего излучение с разным параметром энергии, и датчиков, способных различать рентгеновские кванты на разных уровнях энергии. Особенность данного метода состоит в способности дифференцировать материал на основе не только его плотности, но и элементарного состава и энергии поглощаемого фотонного пучка. Впервые этот метод был описан исследователями в 1970-х гг., но по причине технических трудностей, связанных с несовершенством старых томографов, внедрение его в клиническую практику началось лишь с 2006 г. [38–43].
Существует несколько технологий двухэнергетического исследования.
- Самые первые системы ДЭКТ с двумя последовательными сканированиями на разных уровнях энергии. Главные их недостатки, мешающие широкому внедрению ДЭКТ в практику, заключались в необходимости длительного получения двух изображений, что приводило к несоответствию получаемых изображений в результате артефактов от движения, дыхания и сердцебиения, в низком разрешении и в трудностях постпроцессинговой отработки [44].
- Двухисточниковая ДЭКТ — системы, включающие два источника излучения, установленные ортогонально в одном гентри, работающие на разных уровнях энергии с соответствующими детекторами. Недостатки таких систем состоят в несовпадении времени получения изображений и как следствие – несовпадения данных, а также в пространственных ограничениях внутри гентри [45].
- ДЭКТ с быстрым переключением параметра энергии – системы с одним источником излучения, способные к быстрому (0,4 с) переключению между высоким и низким параметрами энергии во время сканирования.
- ДЭКТ с энергочувствительными детекторами – системы с одним источником излучения и двойным слоем детекторов разной чувствительности.
- ДЭКТ с фильтрами излучения – системы с двумя фильтрами рентгеновского пучка, позволяющие достигать спектрального разделения.
Принцип получения изображения при КТ основывается на двух типах взаимодействия рентгеновского пучка с тканями: фотоэлектрическом эффекте и комптоновском рассеивании. В то время как комптоновское рассеяние преобладает в органических веществах с малыми атомными номерами (т.е. в мягких тканях) и определяется исключительно электронной плотностью материала, а не используемыми при КТ показателями энергии фотонов, фотоэлектрический эффект в основном зависит от эффективного атомного числа абсорбирующего материала – числа протонов в атомном ядре (Zeff) и показателем энергии фотонов. Так, легкие атомы мягких тканей и воды демонстрируют фотоэлектрический эффект в меньшей степени, в то время как таковой является главным способом фотонных взаимодействий рентгеновского пучка в материалах с высоким Zeff, таких как йод (Z=53), барий (Z=56), ксенон (Z=54), в меньшей степени – кальций (Z=20) [46–48]. Таким образом, только элементы с выраженной разницей в показателях Z будут различимыми по их спектральным свойствам.
Характеристики этих различий:
- двухэнергетический индекс (ДЭИ)=Х80–Х140/Х80+Х140+2000, где Х80 – плотность материала в HU при 80 кВ, Х140 – плотность при 140 кВ [24].
- двухэнергетическое отношение (ДЭО)=плотность материала на низкоэнергетическом изображении/плотность на высокоэнергетическом изображении [48].
- двухэнергетическая разность (ДЭР)=плотность материала на низкоэнергетическом изображении – плотность на высокоэнергетическом изображении [49].
Основная цель ДЭКТ в диагностике мочевых камней состоит в предоперационной оценке химического состава конкрементов и достигается в том числе при помощи клинических приложений, классифицирующих материал в определенные группы. Методика может основываться на данных об эффективном атомном числе (Zeff), вышеуказанных показателях двухэнергетического индекса, отношения и разности.
Роль ДЭКТ в определении физико-химического состава мочевых камней
Новейшие исследования демонстрируют эффективность ДЭКТ в дифференцировке уратов и кальцийсодержащий конкрементов.
По результатам мета-анализа 9 работ (609 камней у 415 пациентов) в отношении распознавания уратных и неуратных камней с помощью ДЭКТ объединенная взвешенная чувствительность составила 0,955, специфичность – 0,985; диагностическое отношение шансов (ОШ) – 538, AUC – 0,9901 [51]. Для выявления кальцийсодержащих камней показатели составили 0,994, 0,973, 654,89 и 0,9915 соответственно. Также A. Spek и соавт. [52] провели ретроспективное исследование группы из 64 пациентов, страдавших МКБ, чувствительность ДЭКТ в выявлении уратных и неуратных камней составила 98%. При этом плотность конкрементов по шкале Хаунсфилда не имела корреляции с их составом.
Исследователей интересует в том числе более подробная характеристика состава конкрементов на основе специфических параметров, определяемых при ДЭКТ и имеющих высокую диагностическую ценность. Однако отсутствие цельности результатов имеющихся работ не позволяет сделать окончательные выводы о возможностях ДЭКТ в подробной оценке состава камней.
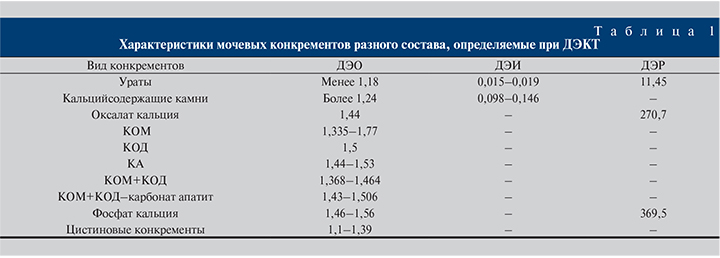
C. Thomas и соавт. [53] провели ретроспективное исследование группы из 40 пациентов (12 из них имели множественные конкременты), которым проводилась ДЭКТ (140 кэВ/80 кэВ) в предоперационном периоде с последующей инфракрасной спектрометрией полученных после хирургического вмешательства камней. Тридцать человек имели кальцийсодержащие камни (КОМ, n=21; карбонат апатит, n=2; кальция оксалата дигидрат (КОД), n=1; кальция фосфат, n=1; КОД+карбонат апатит (КА), n=3; КОМ+КА, n=1; КОМ+урат (50 %/50 %), n=1), 5 – цистиновые, 4 – уратные, 1 – струвитный. Состав камней 38 пациентов был верно определен при ДЭКТ, 1 струвитный камень был неверно определен как цистиновый, 1 кальцийсодержащий конкремент неверно определен как смешанный урат. Чувствительность и специфичность для уратов составили 100 и 97%, для цистиновых камней – 100 и 97%, для кальцийсодержащих камней – 100 и 91% соответственно. Двухэнергетическое отношение для КОМ составило 1,42–1,77, для КОД – 1,50, для КА – 1,44–1,53, для фосфата кальция – 1,46–1,56, для смешанных кальциевых камней – 1,51–1,57, для цистиновых камней – 1,27–1,39, для уратов – 0,88–1,18 и для струвита – 1,34.
В ретроспективном исследовании группы из 70 человек, которым выполнена ДЭКТ (140 кэВ/100 кэВ), S. Acharya и соавт. [54] оценили возможности ДЭКТ в определении химического состава камней in vivo, сделав акцент на дифференцировании различных типов кальцийсодержащих образцов. В группе было обнаружено 114 конкрементов, 93 из которых являлись кальцийсодержащими. Установлено, что ДЭО≤1,14 оказалось характерным для уратных камней, ДЭО≥1,29 – для кальцийсодержащих, а промежуточные значения – для цистиновых камней. Имелись значительные отличия в ДЭО между группой 1 (КОМ [n=32], среднее значение 1,376±0,041), группой 2 (КОД+КОМ [n=51], 1,416±0,048) и группой 3 [КА+КОД+КОМ] [n=10], 1,468±0,038). Следует отметить, что чистый КОМ (группа 1) имел ДЭО значительно более низкое по сравнению со смешанными кальцийсодержащими камнями (группы 2 и 3). Двухэнергетическая разность плотности камней между изображениями с низким и высоким параметрами кэВ не могли различить КОМ и смешанные конкременты. При ROC-анализе ДЭО 1,385 для выявления КОМ имел показатель AUC 0,770 (чувствительность – 65,6%, специфичность – 82%), а значение<1,335 было характерным только для КОМ (специфичность – 100%). Таким образом, продемонстрирована эффективность ДЭКТ в оценке состава различных видов конкрементов in vivo, в том числе для более точной характеристики кальцийсодержащих камней и для обнаружения устойчивых к ДЛТ КОМ.
По результатам исследования группы из 27 человек, которым выполнялась ДЭКТ с последующим оперативным пособием и рентгеновским дифракционным анализом полученных образцов, G. Hidas и соавт. [55] пришли к выводу о высокой диагностической ценности ДЭКТ in vivo в определении химического состава камней. В эксперименте проведено сравнение полученных данных с результатами фантомного исследования 37 образцов известного состав, подвергшихся ДЭКТ. Двухэнергетическое отношение, рассчитанное при исследовании in vitro, составило менее 1,1 для уратных камней, 1,1–1,24 – для цистиновых камней и более 1,24 – для кальцийсодержащих камней. Диапазон ДЭО для струвитных камней пересекался с таковым у кальцийсодержащих, ввиду чего оценка их была затруднена. У 4 пациентов отмечены смешанные камни (<75 % одного компонента), и 1 пациент имел струвитный камень. Состав камней при помощи ДЭКТ был определен верно у 22 (82%) из 27 пациентов: у 6 пациентов с уратами, 15 из 19 пациентов с кальцийсодержащими камнями и у 1 пациента с цистиновым камнем.
B. Matlaga и соавт. [50] в исследовании in vitro констатировали высокую эффективность ДЭКТ (140 кэВ/80 кэВ) в определении фосфата кальция, оксалата кальция и уратов, используя при этом показатели ДЭР и ДЭО. В исследуемых конкрементах отмечались выраженные различия данные параметров: ДЭО оксалата кальция составило 1,44, фосфата кальция – 1,51, уратов – 1,04; ДЭР составила соответственно 270,7, 369,5 и 11,45.
M. Eiber и соавт. [56] подтвердили эффективность метода, обследовав группу из 46 человек, которым выполнена предоперационная прицельная одноисточниковая ДЭКТ (140 кэВ/80 кэВ) с последующим хирургическим лечением, и изучив 71 конкремент, подвергшийся ДЭКТ (140 кэВ/80 кэВ) in vitro. Верификация состава осуществлена при помощи инфракрасной спектрометрии. In vitro ДЭИ для уратов составил 0,018±0,016, для смешанных уратов – 0,035±0,015 и для кальцийсодержащих камней– 0,102±0,015. In vivo ДЭИ составили 0,017±0,002, 0,050 ± 0,019 и 0,122±0,024 соответственно.
N. M. Kulkarni и соавт. [57] провели фантомное исследование 20 конкрементов однородного химического состава (ураты, струвитные, цистиновые и КОМ) in vitro, а также обследовали группу из 11 человек (возраст – 39–67 лет). Во всех случаях после стандартной нативной МСКТ выполнена прицельная одноисточниковая ДЭКТ (140 кэВ/80 кэВ). Для дифференцировки между уратами и неуратами применен алгоритм двукомпонентной декомпозиции. Для дальнейшей классификации неуратов использовался параметр Zeff. Состав конкрементов был верифицирован при помощи инфракрасной спектроскопии. Из 59 образцов (20 камней из фантомного исследования, 39 – из исследования in vivo; средний размер – 6 мм) 16 были уратами, 43 – неуратами. Чувствительность ДЭКТ составила 100% при дифференцировке уратов и неуратов. Применение Zeff позволило с высокой точностью определить струвитные, цистиновые и КОМ в фантомном исследовании.
В группе пациентов с помощью Zeff выявлено 83% кальцийсодержащих камней (n=24), а в смешанных камнях показатель дал возможность выявить доминантный компонент. В исследовании in vitro Zeff для уратов составил 6,2–7,8, для струвитных камней – 9,2–10,0, для цистиновых камней – 10,2–11,8, для КОМ – 12,1–13,8. В исследовании in vivo Zeff для уратов был 6,2–7,7, для КОМ – 11,2–14,4, для смешанного состава с 80% уратного компонента – 7,5–8,5, для смешанного состава с 80% КОМ – 10,9–11,8. Измерение плотности по шкале Хаунсфилда при нативном МСКТ имело чувствительность 71% и точность 69% в выявлении уратов. Таким образом, показано, что ДЭКТ способна выявлять ураты и неуратные камни in vitro и in vivo, также методика позволяет субклассифицировать неуратные камни чистого состава in vitro и in vivo.
С помощью параметра Zeff возможно выявить преобладающий компонент у камней смешанного состава.
В исследованиях n vivo [58–60] был проведен анализ данных ДЭКТ, полученных от пациентов, перенесших оперативное лечение по поводу МКБ. Химический состав камней был подтвержден методами кристаллографии. Была подсчитана точность ДЭКТ в оценке состава: 97,5–100% для уратов, 93,8–100% для цистиновых камней, 80,2% для гидроксиапатита и 93,8–100% для оксалата кальция.
В определении конкрементов смешанного состава возникли явные затруднения, однако выборка этих случаев в данных исследованиях оказалась крайне маленькой.
R. Grosjean и соавт. [61] изучили 241 конкремент in vitro, помещенный в фантомы. В результате была продемонстрирована эффективность ДЭКТ в дифференцировке КОМ, КОД, брушитов, уратов, струвитов и цистиновых камней. Во время исследования симулировалось отсутствие дыхательных движения. При включении в опыт условий, симулирующих дыхательные движения, отмечено выраженное снижение эффективности ДЭКТ.
Клиническое значение ДЭКТ
Влияние диагностических возможностей ДЭКТ на выбор метода лечения и прогноз исхода оперативного лечения изучено недостаточно. Имеющиеся данные преимущественно основаны на небольших выборках и представляются противоречивыми. Большинство авторов сходятся во мнении о высокой диагностической ценности характеристик конкремента, полученных при ДЭКТ, для прогнозирования успешной ДЛТ.
Так, A. Ferrero и соавт. [62] с целью оценки связи морфологических параметров камней с их хрупкостью при оперативном пособии исследовали 33 образца in vitro – КОМ (n=7), КОМ+апатит (n=2), КОМ+КОД+апатит (n=24). Состав был подтвержден данными инфракрасной спектрометрии. Конкременты были сканированы при помощи микро-КТ. Затем после помещения образцов в фантомы их подвергли ДЭКТ. При этом были определены объем, ровность поверхности, ДЭО и проведено описание внутреннего строения образцов по 12 параметрам. Далее хрупкость камня оценивалась путем дезинтеграции в контролируемом эксперименте in vitro с использованием ультразвукового литотриптера и регистрации времени до фрагментации. Средний объем камня составил 300 (134–674) мм3, средняя продолжительность фрагментации, измеренная in vitro, – 32 (7–115) с. Было установлено, что объем камня, ДЭО и ровность поверхности характеризуются наилучшей комбинированной прогностической ценностью в оценке времени фрагментации (R2=0,58). Прогностический потенциал ДЭКТ без использования ДЭО для оценки времени фрагментации был несколько хуже со значением R2=0,54. Таким образом, объем конкремента, ДЭО и морфологические характеристики могут помочь в прогнозировании «хрупкости» камня при ДЛТ, которая измеряется временем фрагментации.
В то же время R. Largo и соавт. [63] изучили возможности стандартной и двухэнергетической КТ с целью прогнозирования успешного исхода ДЛТ. Исследованию in vitro подверглись 33 конкремента разного состава и размером от 3 до 9 мм. Образцы изучены с помощью стандартной КТ (120 кэВ) и ДЭКТ (80/150, 100/150 кэВ), при этом были отмечены плотность камней (HU) и соответствующие ДЭИ. Затем камни подвергли ДЛТ, при этом учитывали количество ударов, необходимое для успешной дезинтеграции, которое в среднем составило 72. Плотность и ДЭИ явились самыми значимыми прогностическими признаками количества ударов для успешной дезинтеграции камня. Не было отмечено значительной разницы в количестве ударов в зависимости от состава камней. При этом коэффициент корреляции между плотностью/ДЭИ и числом ударов при ДЛТ находился в интервале [0,31–0,68], лучшая корреляция отмечена для плотности при 80 кэВ. Таким образом, плотность при КТ с низким параметром энергии – наилучший прогностический признак успешной ДЛТ, в то время как применение ДЭКТ не обеспечивает никакой полезной с данной точки зрения информацией.
Следует также отметить работу [64], в которой была предпринята попытка коррекции терапии в группе из 303 человек, имевших клинически значимые мочевые камни, с помощью информации, полученной при помощи ДЭКТ. Двести семьдесят три (67%) пациента имели кальцийсодержащие камни, 19 (6,3%) – уратные и 11 (3,4%) – смешанные камни. Пятнадцати пациентам с уратными конкрементами была проведена консервативная терапия, у 12 из них отмечен положительный исход (камнеотхождение), что позволило избежать хирургического пособия. Таким образом, было продемонстрировано, что выявление пациентов с уратным нефролитиазом с помощью ДЭКТ и своевременное проведение цитратного литолиза способствуют снижению числа оперативных вмешательств и устранению связанных с ними потенциальных осложнений.
Как видно из представленных сводных таблиц, имеется недостаток информации об определенных видах мочевых камней. Имеющиеся же данные демонстрируют пересечение интервалов некоторых показателей, характерных для камней разных видов, что негативно сказывается на прогностической ценности метода. Указанные погрешности в том числе связаны с отсутствием стандартизированного подхода к работам разных исследователей и порой катастрофически малым выборкам.

Сложности использования ДЭКТ в диагностике МКБ
Несмотря на наличие значительного объема информации о применении ДЭКТ в диагностике МКБ, метод нуждается в дальнейшей оптимизации. Можно выделить следующие главные неизученные аспекты применения ДЭКТ:
- Отсутствие стандартизированного протокола исследования. Так, нет однозначного мнения о целесообразности проведения предварительной нативной МСКТ. До сих пор нет четких указаний об оптимальной лучевой нагрузке – в проанализированных работах доза облучения указывается без учета таких важных аспектов, как дозопродолжительный результат, оптимизация качества изображения, отношение сигнал/шум [65]. Кроме того, отсутствуют четкие указания по поводу применения специфических, определяемых при ДЭКТ показателей: двухэнергетического индекса/отношения/разности, эффективного атомного числа материала; нет информации об их комплексной оценке.
- Необходимость учета результатов исследований, выявляющих ограничения применения ДЭКТ в диагностике МКБ, а именно недостоверная характеристика камней размером менее 3 мм, артефакты, связанные с наличием в мочевыделительной системе стентов и нефростомических дренажей [65].
- Отсутствие стандартов применения данных, полученных при ДЭКТ, в процессе выбора консервативной терапии, хирургического пособия и прогнозирования их результатов, проверенных клинической практикой.
- Недостаточность сведений об оценке зональной структуры камня с помощью ДЭКТ и о связи состава и плотности мочевого конкремента.
- Противоречивость и разрозненность имеющихся данных о возможностях ДЭКТ в определении химического состава конкрементов.
- Отсутствие масштабных работ, описывающих все аспекты применения ДЭКТ в диагностике и лечении МКБ.
- Отсутствие информации о клинико-экономической целесообразности применения ДЭКТ в повседневной работе врачей смежных специальностей.
Таким образом, указанные практические задачи диктуют необходимость скорейшего разрешения для широкого внедрения ДЭКТ в диагностику МКБ.



