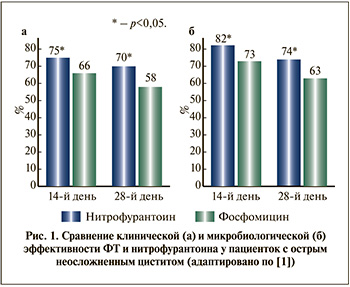
 В литературе можно столкнуться с завышенной оценкой ожидаемой клинической эффективности антимикробного препарата (АМП) в случае выявления низкой устойчивости in vitro по данным микробиологических исследований. В частности, такая ситуация складывается в отношении фосфомицина трометамола (ФТ) как препарата терапии инфекций мочевыводящих путей (ИМП). Для объективной оценки возможностей использования препарата необходимо учитывать не только данные, полученные in vitro, но и результаты сравнительных клинических исследований. В связи с этим представляют интерес результаты самого крупного независимого сравнительного исследования, в котором сравнивали эффективность ФТ и нитрофурантоина в отношении 530 пациенток с острым неосложненным циститом (ОНЦ). В исследовании пациентки получали либо макрокристаллический нитрофурантоин 100 мг 3 р/сут., либо ФТ 3 г однократно [1]. Как клиническая, так и микробиологическая эффективность ФТ оказалась достоверно ниже, чем у нитрофурантоина, составив лишь 58 и 63% соответственно (рис. 1). Интересно, что увеличение длительности курса терапии ФТ не приводит к повышению клинической или микробиологической эффективности, которые после двух или трех доз ФТ, принимаемых через день, остаются на уровне 66,1 и 48,7% соответственно [2].
В литературе можно столкнуться с завышенной оценкой ожидаемой клинической эффективности антимикробного препарата (АМП) в случае выявления низкой устойчивости in vitro по данным микробиологических исследований. В частности, такая ситуация складывается в отношении фосфомицина трометамола (ФТ) как препарата терапии инфекций мочевыводящих путей (ИМП). Для объективной оценки возможностей использования препарата необходимо учитывать не только данные, полученные in vitro, но и результаты сравнительных клинических исследований. В связи с этим представляют интерес результаты самого крупного независимого сравнительного исследования, в котором сравнивали эффективность ФТ и нитрофурантоина в отношении 530 пациенток с острым неосложненным циститом (ОНЦ). В исследовании пациентки получали либо макрокристаллический нитрофурантоин 100 мг 3 р/сут., либо ФТ 3 г однократно [1]. Как клиническая, так и микробиологическая эффективность ФТ оказалась достоверно ниже, чем у нитрофурантоина, составив лишь 58 и 63% соответственно (рис. 1). Интересно, что увеличение длительности курса терапии ФТ не приводит к повышению клинической или микробиологической эффективности, которые после двух или трех доз ФТ, принимаемых через день, остаются на уровне 66,1 и 48,7% соответственно [2].
Существует несколько объяснений несоответствия между высокой активностью ФТ in vitro и относительно низкой клинической эффективностью данного АМП: 1) в настоящее время при определении чувствительности микроорганизмов к ФТ добавляется глюкозо-6-фосфат (Г6Ф), который в десятки раз снижает минимальную подавляющую концентрацию (МПК) (повышает активность по данным исследований in vitro) данного АМП [3]; 2) в некоторых исследованиях выявлена высокая вариабельность фармакокинетических показателей ФТ после приема внутрь; в частности, установлено, что концентрация свыше пограничного значения 32 мг/л в течение 48 ч отмечалась лишь у 67,8% пациентов, а в течение 72 ч – только у 30% [4]; 3) способность быстро формировать устойчивость у грамотрицательных бактерий в ходе лечения [5]; 4) наличие в клинической популяции E. coli явления гетерорезистености к ФТ, когда в популяции чувствительных к ФТ бактерий присутствуют бактерии, имеющие высокую устойчивость к ФТ, при этом наличие подобных штаммов не влияет на МПК, оцениваемую стандартными методами определения чувствительности [6].
Гипотезу о быстром формировании устойчивости в ходе терапии ФТ подтверждает исследование W. Quek et al. [7], в котором была предпринята попытка назначения ФТ пациентам с циститом в том случае, если из мочи выделяли устойчивые к цефтриаксону штаммы уропатогенов. После назначения 3 доз ФТ по 3 г через день оказалось, что микробиологическая эффективность препарата составляет всего 60%, у 28,7% пациентов развились рецидивы инфекции, а у 30% после терапии были выделены штаммы, резистентные к ФТ [7].
По данным недавно проведенного систематического обзора, фармакодинамическим условием предупреждения развития резистентности к фосфомицину считается соблюдение соотношения AUC 24 /МПК ≥3136 (см. табл. 1) [22]. Как видно из таблицы, по этому показателю фосфомицин существенно уступает другим классам антибиотиков, требуемое соотношение AUC 24/МПК может быть достигнуто только при назначении фосфомицина в дозе 2 г каждые 6 ч, т.е. при достижении суточной дозы 8 г. Такие режимы дозирования возможны только при использовании внутривенной формы препарата.

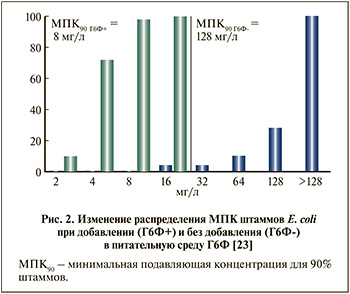 Фосфомицина трометамол был разработан в 1969 г., до середины 1970-х гг. были проведены первые исследования, которые установили умеренную активность в отношении уропатогенов, в первую очередь E. coli (МПК90 32–64 мкг/мл) [8, 9]. Поворотным моментом в истории изучения ФТ стало наблюдение, согласно которому добавление Г6Ф в питательную среду или в состав диска для определения чувствительности приводит к снижению МПК препарата (т.е. к повышению его активности in vitro) в десятки раз (рис. 2). Например, для штаммов E. coli снижение МПК фосфомицина отмечалось в 16–64 раза [8, 10]. Не совсем понятно, по какой причине с начала 1980-х гг. использование Г6Ф является стандартом при определении чувствительности к фосфомицину in vitro, ведь никакого обоснования данная рекомендация не получила [11], а в моче Г6Ф отсутствует или определяется в следовых концентрациях [12].
Фосфомицина трометамол был разработан в 1969 г., до середины 1970-х гг. были проведены первые исследования, которые установили умеренную активность в отношении уропатогенов, в первую очередь E. coli (МПК90 32–64 мкг/мл) [8, 9]. Поворотным моментом в истории изучения ФТ стало наблюдение, согласно которому добавление Г6Ф в питательную среду или в состав диска для определения чувствительности приводит к снижению МПК препарата (т.е. к повышению его активности in vitro) в десятки раз (рис. 2). Например, для штаммов E. coli снижение МПК фосфомицина отмечалось в 16–64 раза [8, 10]. Не совсем понятно, по какой причине с начала 1980-х гг. использование Г6Ф является стандартом при определении чувствительности к фосфомицину in vitro, ведь никакого обоснования данная рекомендация не получила [11], а в моче Г6Ф отсутствует или определяется в следовых концентрациях [12].
В последнее время накапливается все больше данных, согласно котором МПК фосфомицина, определяемые в соответствии с действующими рекомендациями с добавлением в агар или бульон Г6Ф, плохо коррелируют с клиническими исходами, соответственно, имеют низкую клиническую значимость [6, 13]. В связи с этим высказываются предложения пересмотреть существующие рекомендации по определению чувствительности фосфомицина [12].
Обсуждение. Сопоставление данных, выполненных разными научными коллективами в разное время, несомненно, представляет большой практический и научный интерес. Такие сравнения позволяют прежде всего оценить и сопоставить скорость изменения устойчивости уропатогенов к АМП, а также выявить особенности профиля устойчивости в разных регионах. В то же время подобные сравнения имеют ряд методологических ограничений. Список подобных ограничений включает, но не ограничивается следующими проблемами.
Проблема 1. Использование в исследованиях разных критериев интерпретации чувствительности микроорганизмов. Существует несколько организаций, занимающихся разработкой критериев интерпретации, из которых можно выделить две, критерии которых используются чаще всего: Европейский комитет по определению чувствительности к антибиотикам (European Committee on Antimicrobial Susceptibility Testing – EUCAST) и Институт клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute – CLSI), до 2005 г. – Национальный комитет по клиническим и лабораторным стандартам (National Committee for Clinical Laboratory Standards – NCCLS, США). Соответственно, использование разных стандартов оценки, созданных разными организациями в разное время, может приводить к существенным различиям в интерпретации данных.
Например, для ципрофлоксацина пограничные значения для МПК составляли 1–4 и 0,5–1,0 мг/л в 2010 и 2020 гг. по критериям NCCLS и 0,5–1,0 и 0,25–0,5 мг/л в 2010 и 2020 гг. по критериям EUCAST. Подобные изменения произошли и в критериях интерпретации МПК для цефалоспоринов III поколения и амоксициллина клавуланата (АКК). Кроме того, с течением времени изменялись специфические критерии интерпретации чувствительности для штаммов, полученных от пациентов с неосложненными ИМП. Так, EUCAST c 2014 г. предлагает использовать более высокие значения критериев интерпретации МПК для штаммов Enterobacterales, выделенных у пациентов с неосложненными ИМП, для таких препаратов, как АКК, цефуроксим, ФТ [14]. Однако этот важный шаг, сделанный при разработке критериев интерпретации, во многом нивелируется проблемой, связанной с различными определениями понятия «неосложненная ИМП». В частности, существуют различия между руководствами EUCAST и Европейской урологической ассоциации. Определение EUCAST не дает однозначного ответа на вопрос, какие критерии следует применять беременным с ИМП [14, 15].
Проблема 2. Важным фактором, влияющим на результаты микробиологических исследований при ИМП, служат особенности формирования исследуемой популяции пациентов. Хорошо известно, что уропатогены, выделенные у пациентов с осложненными ИМП, чаще демонстрируют устойчивость к АМП. В связи с этим порядок отбора участников исследования крайне важен и в значительной мере влияет на результаты. Кроме того, пациенты с осложненными ИМП могут иметь различный набор осложняющих факторов, например, одни пациенты могут страдать сахарным диабетом, другие – иметь мочекаменную болезнь, онкопатологию или аномалии развития. При этом соотношение указанных осложняющих факторов в разных исследованиях может быть различным. Показано, например, что мочекаменная болезнь служит фактором риска инфицирования резистентными штаммами уропатогенов, тогда как сахарный диабет – нет [16].
Всегда существует риск смешения популяций с разными формами ИМП, при этом подобный риск выше, если формирование популяций происходит ретроспективно. Существует два основных подхода при сборе штаммов для исследования. Первый, очень трудоемкий, подразумевает проспективный сбор клинической информации о пациентах при осмотре и опросе, только после этого сбор образцов мочи для исследования в микробиологической лаборатории – так называемый«population-based surveillance (PBS) метод. Второй подход основан на ретроспективном анализе клинической информации, представленной в документах, сопровождающих образцы мочи в лабораторию, – «laboratory-based surveillance» (LBS)-метод. Показано, что использование стратегии LBS обусловливает завышение показателя доли устойчивых штаммов на 15–30% для таких препаратов, как цефалоспорины III поколения, АКК, фторхинолоны, по сравнению с использованием методики PBS [17]. В России только часть микробиологических исследований выполнена по технологии PBS, т.е. с проспективной клинической оценкой пациентов.
Очень сложным моментом при анализе данных микробиологических исследований считается формирование популяции неосложненных ИМП, особенно если исследование выполнялось ретроспективно. Например, в исследовании DARMIS-2018 при отборе пациентов с неосложненными ИМП в качестве возрастного критерия использована только нижняя граница – 18 лет [18]. В то время как в большинстве определений неосложненных ИМП имеется и верхняя возрастная граница – либо 55 лет, либо период менопаузы [15]. Подобные особенности формирования популяции неосложненных ИМП могут обусловливать более высокие цифры антимикробной резистентности. В частности, при сравнении частоты выделения резистентных штаммов E. coli к цефалоспоринам III поколения в исследовании DARMIS-2018 видно, что у пациентов с неосложненными ИМП резистентные штаммы выделяются почти в 3 раза чаще, чем у беременных (по цефиксиму – 17,2 и 6,8% для «неосложненных ИМП» и беременных соответственно). Очевидно, такое несоответствие наблюдается потому, что популяция беременных в данном случае в большей мере соответствует определению неосложненных ИМП.
Проблема 3. Важным фактором, не всегда позволяющим сравнивать результаты разных исследований, является сбор штаммов на разных географических территориях. Хорошо известно, что существуют географические различия в формировании антимикробной резистентности, поэтому сравнение данных исследований, выполненных на разных территориях или с включением разного количества штаммов в разных регионах, может приводить к ошибочным выводам. Немаловажен момент использования средних значений резистентности по России, на конкретных территориях.
Очевидно, что проблема выбора АМП, в том числе и для терапии внебольничных ИМП, выходит за рамки одной специальности и ее решение требует совместных усилий урологов, терапевтов, акушеров-гинекологов, микробиологов, фармакологов [19]. Выбор АМП определяется многими факторами – клинической эффективностью препарата, его переносимостью, безопасностью, стоимостью и др. Однако в настоящее время помимо вышеперечисленных факторов отечественными и зарубежными учеными в качестве одного из наиболее значимых критериев выбора препарата для антибиотикотерапии ИМП рассматривается антибиотикорезистентность предполагаемого или идентифицированного уропатогена [15, 20].
Необходимо подчеркнуть, что при всей кажущейся простоте и наглядности данных по чувствительности уропатогенов их использование для обоснования рациональной антимикробной терапии связано с многочисленными нюансами, которые могут существенно исказить их объективную оценку. Помимо различий, присутствующих в современных стандартах по оценке результатов определения чувствительности (критериев интерпретации), существует еще проблема клинической значимости стратификации штамма в одну из категорий чувствительный (Ч, S), умеренно-резистентный (У, I), резистентный (Р, R). Нужно отметить, что в 2018 г. EUCAST изменил правила интерпретации результатов определения чувствительности, введя новую категорию – «чувствительный при увеличенной экспозиции антимикробного препарата» (www.eucast.org). Обсуждение этих изменений выходит за рамки статьи, но подтверждает тезис о том, что использование критериев S-I-R не всегда коррелирует с клиническими исходами терапии.
Изучение чувствительности микроорганизмов in vitro – крайне упрощенная модель инфекционного процесса, происходящего в организме человека. Основной целью использования подобной модели является прогнозирование клинической эффективности антимикробной терапии. Очевидно, что несовершенство данной модели обусловлено значительным количеством факторов, некоторые из которых перечислены в табл. 2. С практической точки зрения очень важно знать, какова вероятность достижения клинического успеха или неэффективности терапии при назначении того или иного АМП при разных значениях чувствительности штамма in vitro. Однако в подавляющем большинстве случаев такая информация отсутствует.

В последние годы эту проблему пытается устранить EUCAST, используя при разработке критериев интерпретации чувствительности микроорганизмов методы, основанные на оценке фармакодинамики и фармакокинетики (PK/PD), так называемые клинические пограничные значения (сlinical breakpoints) [14]. Однако даже в этом случае корреляции между клиническими исходами и данными о чувствительности штамма in vitro выполняются далеко не всегда. Экспертами EUCAST выделен перечень АМП и микроорганизмов, для которых такие клинические данные на сегодняшний день не получены.
К числу антибиотиков, чью активность in vitro в отношении бактерий семейства Enterobacterales необходимо сопоставлять с клиническими данными, относят цефалоспорины III–IV, карбапенемы и фосфомицин (самый высокий приоритет изучения), амоксициллин/клавуланат и ампициллин/сульбактам (более низкий приоритет изучения) [21].
Заключение. С 1999 по 2018 г. в России проведено 7 крупных многоцентровых и около 10 небольших локальных микробиологических исследований, позволивших получить необходимую информацию о чувствительности уропатогенов к основным АМП. Анализ данных опубликованных исследований позволяет говорить о сформировавшихся трендах – сохранении высокого уровня устойчивости уропатогенов к незащищенным аминопенициллинам, ко-тримоксазолу, фторхинолонам, росту резистентности к АКК, цефалоспоринам III поколения. Использование данных по чувствительности уропатогенов к АМП при выборе антимикробной терапии требует взвешенного подхода и сопоставления не только микробиологических, но и клинических данных, особенностей фармакодинамики и фармакокинетики АМП.
Сложности в клинической оценке данных чувствительности микроорганизмов заключаются прежде всего в том, что до сих пор степень корреляции данных in vitro с клинической эффективностью терапии ИМП установлена не для всех АМП. В складывающихся условиях важным моментом является проведение не только микробиологических, но и клинических исследований для получения данных о сравнительной эффективности применяемых АМП.



