Введение. Рак предстательной железы (РПЖ) является вторым по встречаемости злокачественным новообразованием у мужчин и пятой по частоте причиной мужской смертности от злокачественных опухолей во всем мире [1]. В России в структуре онкологической заболеваемости мужчин РПЖ занимает 2-е место (14,9%), в структуре онкологической смертности мужского населения – 3-е место (8,2%) [2]. На фоне снижения стандартизованного показателя смертности мужчин от всех злокачественных новообразований за 2008–2018 гг. (-15,36%) данное заболевание прочно удерживает 1-е место по темпам прироста смертности с показателем 9,34% [2].
Основным инструментом для первичного выявления РПЖ являются пальцевое ректальное исследование и уровень простатического специфического антигена (ПСА) в сыворотке крови. Среди недостатков следует выделить низкую специфичность, невозможность дифференцировать индолентную и агрессивную формы РПЖ [3, 4].
В настоящее время диагностическим стандартом при подозрении на РПЖ считается системная биопсия предстательной железы (ПЖ) из 8–12 точек под контролем трансректального ультразвукового исследования (ТРУЗИ) [5]. Однако при этом проводится значительное число ненужных биопсий пациентам без РПЖ или с клинически незначимым раком на фоне высокого уровня ложноотрицательных результатов [6]. С целью повышения точности диагностики рекомендуется выполнение прицельной биопсии из участков ПЖ, подозрительных на РПЖ по данным ТРУЗИ или пальцевого ректального исследования [7]. Долгое время считалось, что наиболее подозрительными на РПЖ являются гипоэхогенные очаги, определяемые в периферической зоне ПЖ, и что наличие таких очагов напрямую коррелирует с агрессивностью опухоли [8]. Однако значительная часть опухолей ПЖ, выявленных при биопсии, при ТРУЗИ бывает представлена изоэхогенными очагами. Кроме того, невысокая специфичность этого признака и высокая операторозависимость метода ограничивают возможности серошкального ТРУЗИ в вопросе таргетирования при биопсии ПЖ [9].
В настоящее время все большее внимание к себе в качестве метода первичной диагностики РПЖ привлекает мультипараметрическая магнитно-резонансная томография (мпМРТ). Было продемонстрировано, что прицельная (таргетная) биопсия очагов, выявленных при помощи мпМРТ, обеспечивает более высокий уровень выявления агрессивного рака, снижая выявляемость индолентного рака по сравнению со стандартной биопсией [10, 11]. Однако данный метод не так широко доступен, как ТРУЗИ. Остаются нерешенными проблемы высокой стоимости мпМРТ [12] и выраженной зависимости результатов от качества подготовки специалистов [13]. Ограничения метода связаны с клаустрофобией или наличием водителя ритма. Все вышеперечисленное пока препятствует внедрению мпМРТ-таргетной биопсии в широкую практику.
Одной из новых ультразвуковых методик, способных улучшать выявление очагов РПЖ, является эластография. Она основана на том, что ткани организма, пораженные злокачественной опухолью, более жесткие по сравнению с неизмененными и доброкачественно измененными тканями. Ультразвуковая эластография делится на компрессионную (качественную) и эластографию сдвиговой волной (ЭСВ) (количественную), которая позволяет проводить реальную количественную оценку жесткости тканей, представляя ее в кПа (единицах модуля Юнга) или м/с (единицах скорости сдвиговой волны). К другим достоинствам ЭСВ относятся хорошая воспроизводимость и меньшая по сравнению с компрессионной эластографией зависимость от исследователя [14–17].
Одной из значимых проблем современной онкоурологии является раннее выявление пациентов с клинически значимым РПЖ. Общепринятого определения понятия «клинически значимый РПЖ» не существует, в практике чаще всего используют модифицированные критерии Эпштейна. В настоящее время для клинически незначимого РПЖ они включают сумму Глисона не более 3+3, получение не более двух биопсийных столбиков с аденокарциномой, при этом опухоль должна занимать 50% длины любого столбика, плотность ПСА менее 0,15 нг/мл [18, 19].
Считается, что радикальное лечение пациентов с клинически незначимым РПЖ не приводит к увеличению продолжительности и качества жизни [20]. Пациенты с клинически незначимым РПЖ являются кандидатами для применения выжидательной тактики – так называемого протокола активного наблюдения [6]. В настоящее время и само понятие активного наблюдения, и критерии включения в его протоколы остаются предметом дискуссии [21, 22]. Также продолжаются поиски методов диагностики, позволяющих выявлять наиболее злокачественные очаги для прицельной биопсии [23–26].
Показано, что использование ЭСВ-таргетной биопсии в дополнение к систематической биопсии может повышать частоту выявления РПЖ [27–29], однако число проведенных по этой теме исследований невелико. Ни в одном из доступных нам исследований не проводился анализ возможностей прицельной биопсии под контролем ЭСВ с учетом объема поражения опухолью столбиков с выявленным РПЖ. Дальнейшего изучения требует вопрос: является ли ЭСВ-таргетная биопсия точнее системной с точки зрения выявления клинически значимого РПЖ?
Цель исследования: оценить эффективность прицельной биопсии под контролем ЭСВ в диагностике РПЖ в сравнении с системной биопсией ПЖ.
Материалы и методы. Проанализированы результаты исследования ПЖ 164 мужчин с подозрением на РПЖ, находившихся на обследовании в Медицинском научно-образовательном центре МГУ им. М. В. Ломоносова. Протокол исследования был одобрен локальным этическим комитетом, все пациенты дали информированное согласие на участие в исследовании. Критерии включения: подозрительные результаты пальцевого ректального исследования и/или повышение уровня общего ПСА в сыворотке крови, и/или подозрительные данные ТРУЗИ. В зависимости от результатов морфологического исследования пациенты были распределены на две группы: РПЖ (n=74) и группа сравнения (n=90). Характеристика пациентов представлена в табл. 1.

Трансректальное УЗИ и биопсию ПЖ под ультразвуковым контролем проводили на аппарате Aixplorer («Supersonic Imagine», Франция) с применением внутриполостного датчика, работавшего в диапазоне частот 3–12 МГц. На первом этапе всем пациентам выполняли ТРУЗИ по стандартной методике (серошкальная эхография и цветокодированная допплерография) и ЭСВ по методике, предложенной Всемирной Федерацией ассоциаций ультразвука в медицине и биологии (World Federation for Ultrasound in Medicine and Biology – WFUMB) [17]. Все исследования проводились опытным врачом (более 25 лет выполнения ТРУЗИ и трансректальных биопсий ПЖ). Пациент находился в положении лежа на левом боку. Для ультразвуковой и эластографической оценки, а также последующей системной биопсии ПЖ условно делили на 12 секторов. При этом каждый секстант основания, средней части и верхушки железы справа и слева делили на латеральный и медиальный секторы.
Сначала выполняли серошкальное исследование с измерением объема ПЖ и детальным анализом ее эхоструктуры и оценку васкуляризации в режиме энергетического допплеровского картирования. Затем после активации режима ЭСВ проводили сканирование железы в поперечной плоскости, стараясь исключить любое давление датчиком на орган. Цветовое окно покрывало половину ПЖ, каждую половину сканировали отдельно от основания до верхушки с остановками продолжительностью до 4 с для получения стабильного изображения. При выбранной цветовой эластографической карте синий цвет соответствовал наиболее эластичным тканям, красный – наиболее жестким (стандартная маркировка при ЭСВ). Настройки ЭСВ включали шкалу жесткости 70 кПа и включение режима пенетрации. Для количественного анализа в периферической зоне в каждом из 12 секторов размещали три зоны интереса округлой формы (Q-Box), покрывавшие всю площадь сектора. Q-Box размещали в центральной части цветового окна. При ЭСВ проводили количественную оценку только периферической зоны, так как в большинстве случаев рак возникает именно в этой зоне, а значения жесткости транзиторных и центральной зон значительно выше [17]. Гипоэхогенные очаги в периферической зоне по данным серошкального режима и/или жесткие очаги по данным ЭСВ расценивали как подозрительные на злокачественные.
Для количественной оценки жесткости и дальнейшего статистического анализа использовали максимальное из трех средних значений модуля Юнга, полученных в каждом секторе (maxEmean). При выявлении гипоэхогенных и/или жестких очагов, подозрительных на РПЖ, отдельно оценивали их жесткость путем размещения Q-Box размером 5 мм в самой жесткой части очага. Для статистического анализа также использовали максимальное из трех значений модуля Юнга в каждом очаге (maxEmean). На первоначальном этапе жесткими считали очаги, значение модуля Юнга которых было больше 35 кПа (по рекомендациям WFUMB [17]). В дальнейшем при сравнении значений модуля Юнга и результатов гистологического исследования ретроспективно был проведен ROC-анализ полученных данных, по результатам которого получен новый оптимальный порог для диагностики РПЖ, с учетом которого проводился весь дальнейший статистический анализ.
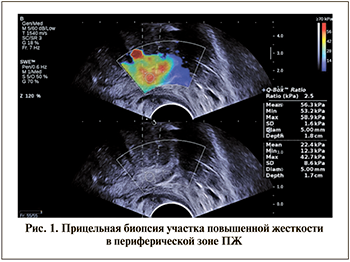 На втором этапе пациентам выполняли системную пункционную биопсию из 12 точек под контролем ТРУЗИ и трансректальную прицельную биопсию ПЖ из подозрительных участков (осуществляли забор до 4 столбиков ткани из каждого гипоэхогенного и/или жесткого очага в периферической зоне) (рис. 1). При этом во всех случаях проводили раздельную маркировку биоптатов с указанием областей забора при системной и прицельной биопсии и выбранного метода таргетирования при прицельной биопсии. Саму манипуляцию проводили под местной анестезией 1%-ным раствором лидокаина и/или гелем «Катеджель» с использованием биопсийного пистолета Bard Magnum и игл 18G.
На втором этапе пациентам выполняли системную пункционную биопсию из 12 точек под контролем ТРУЗИ и трансректальную прицельную биопсию ПЖ из подозрительных участков (осуществляли забор до 4 столбиков ткани из каждого гипоэхогенного и/или жесткого очага в периферической зоне) (рис. 1). При этом во всех случаях проводили раздельную маркировку биоптатов с указанием областей забора при системной и прицельной биопсии и выбранного метода таргетирования при прицельной биопсии. Саму манипуляцию проводили под местной анестезией 1%-ным раствором лидокаина и/или гелем «Катеджель» с использованием биопсийного пистолета Bard Magnum и игл 18G.
Гистологическое исследование осуществляли по стандартной методике. Образцы фиксировали в 4%-ном нейтральном забуференном формалине в течение 48 ч, после чего погружали в парафин. Срезы окрашивали гематоксилином и эозином и изучали под микроскопом. В сомнительных случаях дополнительно проводили иммуногистохимическое исследование. При выявлении РПЖ в образце определяли сумму Глисона и процент поражения раком каждого из столбиков.
При сопоставлении результатов измерения жесткости тканей и результатов гистологического исследования ПЖ проводили анализ относительно столбиков (1) и пациентов (2). При проведении анализа по столбикам значения maxEmean, полученные в каждом секторе и в каждом очаге, сопоставляли с результатами морфологического исследования биоптатов, полученных при системной и прицельной биопсии из конкретного сектора или очага. Выполняли раздельную оценку результатов таргетной биопсии: всех гипоэхогенных очагов, выявленных в В-режиме (категория 1); только тех гипоэхогенных очагов, которым соответствовали участки повышенной жесткости по данным ЭСВ (категория 2); всех очагов повышенной жесткости по данным ЭСВ вне зависимости от картины в В-режиме (категория 3). Участки массивного кальциноза в периферической зоне могут служить причиной ложноположительных результатов ЭСВ в диагностике РПЖ [17]. В связи с этим очаги повышенной жесткости, соответствовавшие участкам массивного кальциноза, исключали из анализа по прицельной биопсии.
Был проанализирован 2171 биоптат (1968 системных и 203 прицельных). Медиана числа биоптатов, полученных от одного пациента, составила 13, интерквартильный размах – 12–14, минимальное–максимальное значения – 12–18. Все биоптаты были разделены на группы: РПЖ+ (n=441) и РПЖ- (n=1730). В группе биоптатов РПЖ+ были выделены подгруппы биоптатов с различными морфологическими прогностическими группами по ISUP (International Society of Urological Pathology), 2014 [30] (1); подгруппы биоптатов с выявленной периневральной инвазией и без инвазии (2).
При проведении анализа по пациентам все обследованные, как было отмечено выше, были разделены на две группы в зависимости от результатов морфологии: РПЖ (n=74) и группа сравнения (n=90). В группе пациентов с РПЖ были выделены подгруппы пациентов с различными морфологическими прогностическими группами по ISUP, 2014 [30] (1); подгруппы пациентов с выявленной периневральной инвазией и без инвазии (2); подгруппы пациентов с клинически значимым и клинически незначимым РПЖ (по модифицированным критериям Эпштейна [19]) (3). Если у пациента выявлялось несколько положительных образцов с различными баллами по Глисону, то для анализа относительно пациентов использовали самый высокий выявленный балл.
Статистическая обработка полученных результатов проведена с помощью программы MedCalc Statistical Software version 19.2.6 (MedCalc Software Ltd., Бельгия). Поскольку при проверке на нормальность распределения основной массив данных не подчинялся нормальному распределению, все количественные данные представлены в виде медианы, интерквартильного размаха (25–75-й процентилей), минимального и максимального значений (min–max). Для сравнения количественных параметров использовали критерий Манна–Уитни, качественных – критерий χ2. Корреляционный анализ осуществляли с помощью рангового коэффициента корреляции Спирмена (rS). Результаты статистического анализа считали значимыми при p<0,05. В процессе работы также проводили ROC-анализ. Представлены следующие показатели информативности эластографических тестов: площадь под ROC-кривой, чувствительность, специфичность, предсказательная ценность положительного теста и предсказательная ценность отрицательного теста.
Результаты. При сравнении значений модуля Юнга в группах биоптатов РПЖ+ (n=441) и РПЖ- (n=1730) получены достоверные различия (p<0,0001). В группе биоптатов РПЖ+ медиана модуля Юнга составила 58,5 кПа, интерквартильный размах – 42,8–77,6, min–max – 12,9–199,5, в группе биоптатов РПЖ– – 28,2, 22,2–34,3 и 8,8–78,0 кПа соответственно.
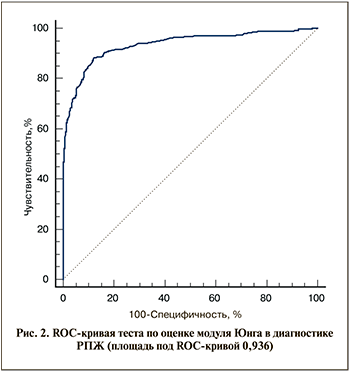
Для поиска оптимального порогового значения модуля Юнга для диагностики РПЖ проведен ROC-анализ относительно столбиков на основании ретроспективной оценки результатов исследования (выделение групп на основе результирующего фактора). Тест «значение модуля Юнга >38 кПа – РПЖ» характеризовался чувствительностью 88,4%, специфичностью 87,9% (площадь под ROC-кривой – 0,936; рис. 2). Предсказательная ценность положительного теста составила 65%, предсказательная ценность отрицательного теста – 96,8% (с учетом соотношения случаев в положительной [441] и отрицательной [1 730] группах по результирующему фактору).
При проведении корреляционного анализа в группе биоптатов РПЖ+ (n=441) были выявлены достоверные положительные средней силы корреляции модуля Юнга и суммы Глисона (rS=0,51, p<0,0001), модуля Юнга и процент поражения столбика (rS=0,59; p<0,0001). Интересно, что наличие признаков периневральной инвазии при гистологическом исследовании также достоверно коррелировало с модулем Юнга (p=0,0001), но значение rS было равно 0,18, что говорит об очень слабой силе связи между признаками.
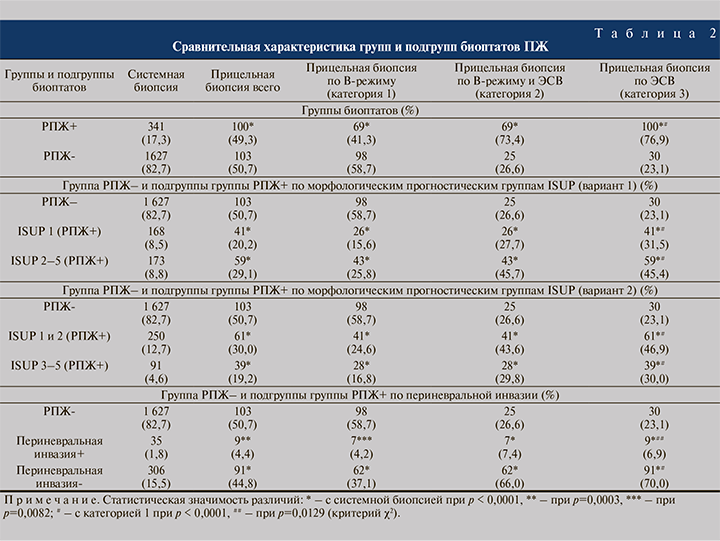
Распределение пациентов на подгруппы по биоптатам представлено в табл. 2. При любых категориях прицельной биопсии процент столбиков с РПЖ был достоверно выше, чем при системной биопсии. Также при любых категориях прицельной биопсии достоверно чаще выявлялись морфологические прогностические группы ISUP 2–5, ISUP 3–5 и периневральная инвазия. При сравнении прицельной биопсии по В-режиму (категория 1) и по ЭСВ (категория 3) процент столбиков с РПЖ был достоверно выше при прицельной биопсии по ЭСВ. Аналогичные закономерности наблюдались при сравнении категорий 1 и 3 по морфологическим прогностическим группам ISUP и периневральной инвазии.
По данным системной биопсии, морфологическая прогностическая группа 1 (ISUP 2014) выявлена у 33 из 74 (44,6%) пациентов, группа 2 – у 21 (28,4%), группа 3 – у 5 (6,8%), группа 4 – у 14 (18,9%), группа 5 – у 1 (1,4%). Прицельная биопсия позволила 4 (5,4%) пациентам повысить морфологическую прогностическую группу: у 2 пациентов сумма Глисона была изменена с 6 на 7 (3 + 4) (ISUP 1 на ISUP 2), у 2 – с 6 на 7 (4 + 3) (ISUP 1 на ISUP 3). По данным системной биопсии периневральная инвазия была выявлена в 18 (24,3%) случаях. Использование прицельной биопсии позволило дополнительно выявить периневральную инвазию еще у 2 (2,7%) пациентов с РПЖ. При оценке клинической значимости РПЖ с использованием модифицированных критериев Эпштейна [19] системная биопсия выявила клинически значимый РПЖ у 53 (71,6%) пациентов. Прицельная биопсия позволила перевести в группу клинически значимого РПЖ дополнительно 7 (9,5%) пациентов.
Обсуждение. Как известно, важным аспектом в диагностике РПЖ служит выявление случаев с суммой баллов по Глисону 7 и более. В результате нескольких исследований было определено, что существует прямая положительная корреляция показателей жесткости патологических очагов и суммы Глисона [14, 15, 24, 29, 31]. Значения rS в этих работах варьировались от 0,343 до 0,66 (p<0,05). В нашем исследовании также была выявлена значимая достоверная корреляция модуля Юнга и суммы Глисона (rS=0,51, p<0,0001).
Ранее было установлено, что процент поражения раком биопсийного столбика – одна из гистологических предоперационных переменных, наиболее тесно связанная с конечной стадией (pT2 против pT3) по результатам радикальной простатэктомии (p=0,00004) [32]. Процент поражения столбика опухолью, как имеющий высокую прогностическую ценность критерий, наряду с суммой Глисона включен в вышеупомянутые модифицированные критерии клинически значимого РПЖ по Эпштейну [19]. Нами была получена значимая положительная корреляция модуля Юнга и процента поражения раком биопсийных образцов (rS=0,59; p<0,0001). В доступных нам работах подобный анализ не проводился.
Также в доступных нам работах не проводился анализ корреляции показателей жесткости и наличия периневральной инвазии в биоптатах. Последняя связана с неблагоприятными онкологическими исходами и более высоким риском биохимического рецидива после радикальной простатэктомии и лучевой терапии и может служить пациентам с РПЖ независимым прогностическим фактором [33]. Периневральная инвазия в биопсийных образцах связана со значительным риском прогрессирования заболевания у пациентов с РПЖ, включенных в протоколы активного наблюдения, и должна учитываться при отборе пациентов для включения в эти протоколы [34]. По нашим данным, наличие периневральной инвазии при гистологическом исследовании достоверно коррелировало со значениями модуля Юнга, хотя степень корреляции была слабой (rS=0,18, p=0,0001). Это может быть связано с небольшим количеством случаев периневральной инвазии.
Как известно, при прицельных биопсиях ПЖ частота положительного результата биопсии является одним из важных показателей эффективности метода таргетирования. K. Boehm et al. [28] провели анализ эффективности использования прицельных биопсий с помощью ЭСВ по сравнению с системной биопсией. Клинически значимый РПЖ (сумма Глисона – 7 и более, или более 2 столбиков с любым числом Глисона, ПСА –10 нг/мл) был выявлен в 10,5% образцов ЭСВ-таргетной биопсии, в 11,8% образцов прицельной биопсии из гипоэхогенных очагов и в 8,6% образцов системной биопсии (различия были статистически незначимы) [28]. Такую низкую частоту положительного результата прицельной биопсии в данном исследовании можно объяснить очень высоким выбранным порогом жесткости – 50 кПа (в нашей работе порог составил 38,0 кПа). Методом сравнения служила системная биопсия, однако, в отличие от нашего исследования, при системной биопсии осуществляли забор 6–18 столбиков, что в свою очередь могло повлиять на выявляемость РПЖ. Противоположные результаты были получены в работе В. В. Митькова и соавт. [27]: частота выявления РПЖ с помощью ЭСВ-таргетной биопсии была достоверно выше при сравнении с системной биопсией. Рак предстательной железы был выявлен в 17,2% биоптатов без учета эластографических признаков и в 89,1% биоптатов с учетом последних [27]. В нашем исследовании были получены сходные результаты (РПЖ был найден в 17,3% образцов системной биопсии и в 76,9% прицельных образцов, взятых под контролем ЭСВ; p<0,0001). Если при этом оценивать частоту выявления агрессивных форм РПЖ, то при любых категориях прицельной биопсии (по В-режиму, по В-режиму и ЭСВ, по ЭСВ) морфологические прогностические группы ISUP 2–5, ISUP 3–5 и периневральная инвазия определялись достоверно чаще, чем при системной биопсии (табл. 2). Необходимо подчеркнуть, что при сравнении с прицельной биопсией по-режиму при прицельной биопсии по ЭСВ достоверно чаще диагностировались морфологически значимый (ISUP) РПЖ и периневральная инвазия (табл. 2).
При анализе результатов относительно пациентов выявлено, что распределение пациентов с РПЖ в морфологические прогностические группы по результатам системной биопсии оказалось не совсем точным: прицельная биопсия позволила 5,4% пациентов повысить морфологическую прогностическую группу, т.е. у них в прицельных образцах сумма Глисона была выше, чем в системных биоптатах. Результатом использования прицельной биопсии стало выявление периневральной инвазии еще у 2,7% пациентов с РПЖ, кроме тех пациентов, у которых периневральную инвазию нашли при системной биопсии. Анализ возможностей прицельной биопсии под контролем ЭСВ с учетом объема поражения опухолью столбиков с выявленным РПЖ позволил нам оценить клиническую значимость РПЖ с использованием модифицированных критериев Эпштейна (2019) [19]. Прицельная биопсия позволила перевести из группы клинически незначимого в группу клинически значимого РПЖ дополнительно 9,5% пациентов, что стало важным аргументом при выборе лечебной тактики в оношении этих больных.
Такие варианты ведения пациентов с РПЖ, как активное наблюдение или фокальная терапия, требуют как можно более точного описания характеристик очагов опухоли. Возможно, применение прицельной биопсии под контролем ЭСВ позволит усовершенствовать диагностику клинически значимого РПЖ, улучшить отбор для последующего активного наблюдения, повысить его эффективность и безопасность.
Заключение. Прицельная биопсия под контролем ЭСВ имеет значительно более высокую частоту положительного результата биопсии, чем обычная системная биопсия. ЭСВ-таргетные биопсии не могут заменить системную биопсию ПЖ, но предоставляют ценную дополнительную информацию о локализации и степени злокачественности опухолевых узлов. Использование прицельной биопсии под контролем ЭСВ в дополнение к системной биопсии позволяет повышать частоту обнаружения клинически значимого РПЖ и улучшать выявляемость периневральной инвазии, что может иметь решающее значение при выборе тактики лечения.



